名校
解题方法
1 . 按要求回答下列问题。
(1)现有以下物质:a.NaOH溶液b.液氨c.Ba(OH)2固体d.NaHSO4e.Fe(OH)3胶体f.铜g.CO2h.盐酸
①以上物质中属于非电解质的是_______ (填序号,下同),属于电解质的有_______ 。
②在足量d溶液中加入少量c溶液,发生反应的离子方程式为_______ 。
(2)银首饰在空气中容易发黄变黑,原因是发生反应:4Ag+O2+2H2S=2Ag2S+2H2O,当消耗了108gAg时,该反应消耗标准状况下的O2的体积为_______ 。
(3)“84消毒液”是家居常用的消毒用品,某小组同学查看包装说明,得到如图信息:

现取适量该“84清毒液”原液进行稀释,配制980mLc(NaClO)=0.05mol/L的溶液。
①稀释过程中,需要用到的玻璃仪器有烧杯,玻璃棒、量筒、胶头滴管、_______ 。
②稀释时,需要用量筒量取该“84消毒液”的体积为_______ mL。
③下列操作会使配制溶液中NaClO浓度偏高的是_______ (填标号)。
A.取用久置的“84消毒液”原液进行稀释
B.量取“84消毒液”原液时,仰视读数
C.容量瓶未干燥直接使用
D.定容时,仰视刻度线
E.定容摇匀后,液面低于刻度线,再加水至刻度线
(1)现有以下物质:a.NaOH溶液b.液氨c.Ba(OH)2固体d.NaHSO4e.Fe(OH)3胶体f.铜g.CO2h.盐酸
①以上物质中属于非电解质的是
②在足量d溶液中加入少量c溶液,发生反应的离子方程式为
(2)银首饰在空气中容易发黄变黑,原因是发生反应:4Ag+O2+2H2S=2Ag2S+2H2O,当消耗了108gAg时,该反应消耗标准状况下的O2的体积为
(3)“84消毒液”是家居常用的消毒用品,某小组同学查看包装说明,得到如图信息:

现取适量该“84清毒液”原液进行稀释,配制980mLc(NaClO)=0.05mol/L的溶液。
①稀释过程中,需要用到的玻璃仪器有烧杯,玻璃棒、量筒、胶头滴管、
②稀释时,需要用量筒量取该“84消毒液”的体积为
③下列操作会使配制溶液中NaClO浓度偏高的是
A.取用久置的“84消毒液”原液进行稀释
B.量取“84消毒液”原液时,仰视读数
C.容量瓶未干燥直接使用
D.定容时,仰视刻度线
E.定容摇匀后,液面低于刻度线,再加水至刻度线
您最近一年使用:0次
名校
2 . 高铁酸钾是一种安全性很高的水处理剂,不仅能去除水污染物和致癌化学物质,还不会产生有害产物。制备原理为: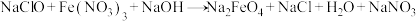 (未配平),最后加入
(未配平),最后加入 ,析出
,析出 沉淀。下列说法不正确的是
沉淀。下列说法不正确的是
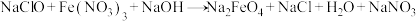 (未配平),最后加入
(未配平),最后加入 ,析出
,析出 沉淀。下列说法不正确的是
沉淀。下列说法不正确的是A.氧化性: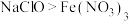 |
B.氧化产物与还原产物的物质的量之比为 |
C.每消耗 ,就会生成 ,就会生成 水 水 |
| D.高铁酸钾的溶解度小于高铁酸钠 |
您最近一年使用:0次
名校
3 . 关于 的下列叙述中不正确的是
的下列叙述中不正确的是
 的下列叙述中不正确的是
的下列叙述中不正确的是A. 是极性分子 是极性分子 | B.同时含有离子键和非极性共价键 |
| C.同时含有极性键和非极性键 | D.1mol 完全分解,转移1mol电子 完全分解,转移1mol电子 |
您最近一年使用:0次
4 . 某同学做实验时白色衣服上沾了一些KMnO4,产生褐色斑点,如果用草酸(H2C2O4)的稀溶液洗涤马上可以复原,其离子方程式为: +H2C2O4+H+→CO2↑+Mn2++_______(未配平)。关于此反应的叙述正确的是
+H2C2O4+H+→CO2↑+Mn2++_______(未配平)。关于此反应的叙述正确的是
 +H2C2O4+H+→CO2↑+Mn2++_______(未配平)。关于此反应的叙述正确的是
+H2C2O4+H+→CO2↑+Mn2++_______(未配平)。关于此反应的叙述正确的是| A.方程式横线上的生成物是OH- |
| B.该反应的还原产物是Mn2+离子 |
| C.标准状况下,有5.6LCO2生成时,转移电子的物质的量为0.5mol |
| D.配平离子方程式,H+的计量数是10 |
您最近一年使用:0次
5 .  光催化反应机理如图所示,当催化剂受到能量大于禁带宽度的光照时,价带上的电子被激发,跃迁到导带,同时形成空穴。导带上的光生电子(
光催化反应机理如图所示,当催化剂受到能量大于禁带宽度的光照时,价带上的电子被激发,跃迁到导带,同时形成空穴。导带上的光生电子( )作还原剂,价带上的光生空穴
)作还原剂,价带上的光生空穴 作氧化剂,下列说法
作氧化剂,下列说法不正确 的是

 光催化反应机理如图所示,当催化剂受到能量大于禁带宽度的光照时,价带上的电子被激发,跃迁到导带,同时形成空穴。导带上的光生电子(
光催化反应机理如图所示,当催化剂受到能量大于禁带宽度的光照时,价带上的电子被激发,跃迁到导带,同时形成空穴。导带上的光生电子( )作还原剂,价带上的光生空穴
)作还原剂,价带上的光生空穴 作氧化剂,下列说法
作氧化剂,下列说法
A.在价带上 被氧化 被氧化 | B.推测 起催化作用 起催化作用 |
| C.反应过程中光能转化为化学能 | D. 生成 生成 得 得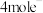 |
您最近一年使用:0次
名校
6 . 某兴趣小组用铬铁矿(FeCr2O4,含SiO2等杂质)为主要原料制备重铬酸钾(K2Cr2O7)晶体,流程如图:

已知:FeCr2O4中Cr元素为+3价;SiO2与Na2CO3高温生成可溶于水的Na2SiO3;CrO 酸性条件下能转化为Cr2O
酸性条件下能转化为Cr2O 。
。
回答下列问题:
(1)“焙烧”时,除生成Na2CrO4和Fe2O3外,还生成一种无色无味的气体,该反应的化学方程式为_______ 。焙烧时气体与矿料逆流而行,目的是________ 。
(2)实验室进行“操作1”用到的玻璃仪器有:烧杯、_______ 。
(3)“晶体X”的化学式为______ 。
(4)交警查酒驾所用检测仪器的工作原理为:2Cr2O (橙红色)+3C2H5OH+16H+=3CH3COOH+11H2O+4Cr3+。该反应中,还原剂为
(橙红色)+3C2H5OH+16H+=3CH3COOH+11H2O+4Cr3+。该反应中,还原剂为_______ ;反应消耗1molK2Cr2O7时,转移电子的数目为________ 。
(5)“结晶”时,为得到杂质较少的K2Cr2O7粗产品,请结合如图从下列选项中选出合理的操作并排序_______ (填字母)。

a.40℃蒸发溶剂 b.90℃蒸发溶剂 c.过滤 d.冷却至室温 e.蒸发至溶液出现晶膜,停止加热
(6)该小组用m1kg铬铁矿(FeCr2O450%)制备K2Cr2O7,最终得到m2kg,产率为______ 。

已知:FeCr2O4中Cr元素为+3价;SiO2与Na2CO3高温生成可溶于水的Na2SiO3;CrO
 酸性条件下能转化为Cr2O
酸性条件下能转化为Cr2O 。
。回答下列问题:
(1)“焙烧”时,除生成Na2CrO4和Fe2O3外,还生成一种无色无味的气体,该反应的化学方程式为
(2)实验室进行“操作1”用到的玻璃仪器有:烧杯、
(3)“晶体X”的化学式为
(4)交警查酒驾所用检测仪器的工作原理为:2Cr2O
 (橙红色)+3C2H5OH+16H+=3CH3COOH+11H2O+4Cr3+。该反应中,还原剂为
(橙红色)+3C2H5OH+16H+=3CH3COOH+11H2O+4Cr3+。该反应中,还原剂为(5)“结晶”时,为得到杂质较少的K2Cr2O7粗产品,请结合如图从下列选项中选出合理的操作并排序

a.40℃蒸发溶剂 b.90℃蒸发溶剂 c.过滤 d.冷却至室温 e.蒸发至溶液出现晶膜,停止加热
(6)该小组用m1kg铬铁矿(FeCr2O450%)制备K2Cr2O7,最终得到m2kg,产率为
您最近一年使用:0次
名校
解题方法
7 . I.铁及其化合物在工业生产中有着重要的用途,其“价—类”二维图如图。

(1)下列推断不合理的是______ 。
(2)用FeCl3溶液腐蚀印刷电路板上的铜,向所得溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是______ 。
a.若无固体存在,则溶液中一定有Fe3+
b.若有固体存在,则溶液中一定有Fe2+
c.若溶液中有Cu2+,则可能有固体存在
d.若溶液中有Fe3+,则可能有Cu析出
Ⅱ.现有含少量杂质的FeCl3•nH2O,为测定n值进行如下实验:
①称取ag样品配成250mL溶液,加入稍过量锌粒将Fe3+还原为Fe2+,过滤;取25.00mL所得滤液,恰好与VmLcmol/L的K2Cr2O7溶液完全反应;
(已知Cr2O +Fe2++H+→Cr3++Fe3++H2O未配平,杂质、Cl-、Zn2+不参与反应)。
+Fe2++H+→Cr3++Fe3++H2O未配平,杂质、Cl-、Zn2+不参与反应)。
②另取ag样品,在脱水剂SOCl2蒸汽作用下,加热至恒重,测得固体质量为bg。(SOCl2遇水极易反应生成气体,该过程中FeCl3未升华)。
(3)加入稍过量的锌粒后,检验溶液中是否存在Fe3+的试剂为_______ 。
(4)若将SO2通入氯化铁溶液,可以使溶液颜色变绿,写出反应的离子方程式:_______ 。
(5)n=_______ ,下列情况会导致n测量值偏小的是_______ (填标号)。
A.实验①中,称重后样品发生了潮解
B.实验①中配制溶液时,俯视刻度线定容
C.实验①中配制溶液时,未对所用过的烧杯和玻璃棒进行洗涤
D.实验②中样品与SOCl2反应时,失水不充分

(1)下列推断不合理的是
| A.FeCl2和FeCl3可通过化合反应相互转化 |
| B.Fe2+既可被氧化,也可被还原 |
| C.FeO在空气中受热,能迅速生成Fe2O3 |
| D.存在Fe3+→Fe2+→Fe(OH)2→Fe(OH)3→Fe3+的循环转化关系 |
(2)用FeCl3溶液腐蚀印刷电路板上的铜,向所得溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是
a.若无固体存在,则溶液中一定有Fe3+
b.若有固体存在,则溶液中一定有Fe2+
c.若溶液中有Cu2+,则可能有固体存在
d.若溶液中有Fe3+,则可能有Cu析出
Ⅱ.现有含少量杂质的FeCl3•nH2O,为测定n值进行如下实验:
①称取ag样品配成250mL溶液,加入稍过量锌粒将Fe3+还原为Fe2+,过滤;取25.00mL所得滤液,恰好与VmLcmol/L的K2Cr2O7溶液完全反应;
(已知Cr2O
 +Fe2++H+→Cr3++Fe3++H2O未配平,杂质、Cl-、Zn2+不参与反应)。
+Fe2++H+→Cr3++Fe3++H2O未配平,杂质、Cl-、Zn2+不参与反应)。②另取ag样品,在脱水剂SOCl2蒸汽作用下,加热至恒重,测得固体质量为bg。(SOCl2遇水极易反应生成气体,该过程中FeCl3未升华)。
(3)加入稍过量的锌粒后,检验溶液中是否存在Fe3+的试剂为
(4)若将SO2通入氯化铁溶液,可以使溶液颜色变绿,写出反应的离子方程式:
(5)n=
A.实验①中,称重后样品发生了潮解
B.实验①中配制溶液时,俯视刻度线定容
C.实验①中配制溶液时,未对所用过的烧杯和玻璃棒进行洗涤
D.实验②中样品与SOCl2反应时,失水不充分
您最近一年使用:0次
名校
8 . 有 存在时,活性炭吸附脱除
存在时,活性炭吸附脱除 的反应方程式为
的反应方程式为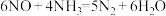 。研究发现:活性炭的表面含有羧基等含氧官能团,活性炭含氧官能团化学吸附
。研究发现:活性炭的表面含有羧基等含氧官能团,活性炭含氧官能团化学吸附 和
和 的机理如下图所示。下列说法
的机理如下图所示。下列说法不正确 的是
 存在时,活性炭吸附脱除
存在时,活性炭吸附脱除 的反应方程式为
的反应方程式为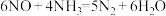 。研究发现:活性炭的表面含有羧基等含氧官能团,活性炭含氧官能团化学吸附
。研究发现:活性炭的表面含有羧基等含氧官能团,活性炭含氧官能团化学吸附 和
和 的机理如下图所示。下列说法
的机理如下图所示。下列说法
A. 和 和 中心原子的杂化方式相同 中心原子的杂化方式相同 |
B.吸附时, 中的 中的 原子与羧基中的 原子与羧基中的 原子发生作用 原子发生作用 |
C.室温时,脱除30g 转移电子数约为 转移电子数约为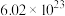 个 个 |
D.含氧官能团化学吸附 、 、 的连接方式与 的连接方式与 、 、 、 、 和 和 的电负性有关 的电负性有关 |
您最近一年使用:0次
2024-03-06更新
|
386次组卷
|
2卷引用:北京交通大学附属中学2023-2024学年高三下学期开学考化学试题
名校
解题方法
9 . 金属及其化合物在生产生活中占有极其重要的地位,请结合金属及其化合物的相关知识回答下列问题:
(1)FeCl3溶液用于腐蚀铜箔印刷线路板,该反应的离子方程式为___________ 。
(2)经检测某酸性废水中所含离子及其浓度如表所示:
则(Al3+)=___________ mol/L。
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如图:

①完成“操作I”所需要的玻璃仪器除烧杯外,还需要的是___________ 、___________ 。
②FeCO3在空气中加热反应生成Fe2O3时,氧化剂和还原剂的物质的量之比为___________ 。
③1.0kg含铁95%的废铁屑,操作I损失率为2%,操作Ⅱ损失率为1%,最后获得Fe2O3的质量为___________ kg。
(4)用托盘天平(1g以下用游码)称量绿矾(FeSO4∙7H2O)晶体配制450mL0.1mol/L溶液,需要绿矾的质量为___________ ;配制过程以下实验操作会导致所配溶液浓度偏低的是___________ 。
a.用托盘天平称量绿矾晶体时,将砝码放在左盘,药品放在右盘
b.洗涤烧杯和玻璃棒后,将洗涤液倒入废液缸中
c.摇匀后发现液面低于刻度线,未补加水
d.定容时,俯视刻度线
(1)FeCl3溶液用于腐蚀铜箔印刷线路板,该反应的离子方程式为
(2)经检测某酸性废水中所含离子及其浓度如表所示:
| 离子 |  |  |  |  |  |
| 浓度/(mol/L) | 2×10-2 | 1×10-1 | 2×10-2 | 1×10-1 |
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如图:

①完成“操作I”所需要的玻璃仪器除烧杯外,还需要的是
②FeCO3在空气中加热反应生成Fe2O3时,氧化剂和还原剂的物质的量之比为
③1.0kg含铁95%的废铁屑,操作I损失率为2%,操作Ⅱ损失率为1%,最后获得Fe2O3的质量为
(4)用托盘天平(1g以下用游码)称量绿矾(FeSO4∙7H2O)晶体配制450mL0.1mol/L溶液,需要绿矾的质量为
a.用托盘天平称量绿矾晶体时,将砝码放在左盘,药品放在右盘
b.洗涤烧杯和玻璃棒后,将洗涤液倒入废液缸中
c.摇匀后发现液面低于刻度线,未补加水
d.定容时,俯视刻度线
您最近一年使用:0次
2024-03-04更新
|
88次组卷
|
2卷引用:河南省许昌高级中学2023-2024学年高一下学期开学化学试题
10 . 完成下列问题。
(1)饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 ,其化学方程式为:
,其化学方程式为: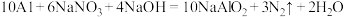 。
。
①上述反应中,被还原的元素是_______ (填写元素符号);氧化产物是_______ (写化学式);若反应生成 (标况下)的
(标况下)的 ,该反应转移电子的数目为
,该反应转移电子的数目为___  。
。
②用双线桥法表示反应中电子转移的方向和数目:________  。
。
③请配平下列离子方程式:____ 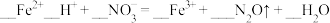 。
。
(2)食品工业经常使用 和
和 作膨松剂。室温下,向含
作膨松剂。室温下,向含 某膨松剂试样(
某膨松剂试样( )溶液中逐滴加入稀盐酸,反应过程中含碳元素微粒的物质的量随
)溶液中逐滴加入稀盐酸,反应过程中含碳元素微粒的物质的量随 变化的图象如图所示。
变化的图象如图所示。
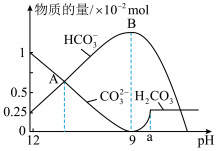
①图中B点溶液溶质的主要成分为________ (填化学式)。
②图中A点所含 的物质的量为
的物质的量为_____ mol。(提醒:注意纵坐标的数量级)
③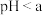 时发生反应的离子反应方程式为
时发生反应的离子反应方程式为_________ 。
④某同学用酒精灯对该试样固体充分加热至恒重,从开始至恒重固体失重______ g。
(1)饮用水中的
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 ,其化学方程式为:
,其化学方程式为: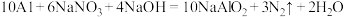 。
。①上述反应中,被还原的元素是
 (标况下)的
(标况下)的 ,该反应转移电子的数目为
,该反应转移电子的数目为 。
。②用双线桥法表示反应中电子转移的方向和数目:
 。
。③请配平下列离子方程式:
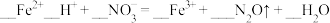 。
。(2)食品工业经常使用
 和
和 作膨松剂。室温下,向含
作膨松剂。室温下,向含 某膨松剂试样(
某膨松剂试样(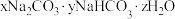 )溶液中逐滴加入稀盐酸,反应过程中含碳元素微粒的物质的量随
)溶液中逐滴加入稀盐酸,反应过程中含碳元素微粒的物质的量随 变化的图象如图所示。
变化的图象如图所示。
①图中B点溶液溶质的主要成分为
②图中A点所含
 的物质的量为
的物质的量为③
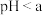 时发生反应的离子反应方程式为
时发生反应的离子反应方程式为④某同学用酒精灯对该试样固体充分加热至恒重,从开始至恒重固体失重
您最近一年使用:0次
2024-03-04更新
|
68次组卷
|
2卷引用:河南省许昌高级中学2023-2024学年高一下学期开学化学试题



