1 . 近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、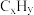 、
、 三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。

在图示的转化中,被还原的元素是___________ ,X的化学式为___________ 。
(2)SCR技术可使 与
与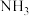 直接反应,实现无害转化。假设
直接反应,实现无害转化。假设 是NO时,发生反应的化学方程式是
是NO时,发生反应的化学方程式是_______ 。
(3)利用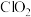 氧化氮氧化物反应过程如下:
氧化氮氧化物反应过程如下: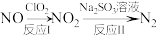 。反应I的化学方程式是
。反应I的化学方程式是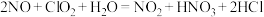 ,反应II的离子方程式是
,反应II的离子方程式是___________ 。
(4)加入过量次氯酸钠可使废水中 完全转化为
完全转化为 ,而本身被还原为NaCl。
,而本身被还原为NaCl。
①检验废水中是否存在 的方法是
的方法是___________ 。
②若处理废水产生了0.448L (标准状况),则需消耗浓度为2mol/L的次氯酸钠的体积为
(标准状况),则需消耗浓度为2mol/L的次氯酸钠的体积为___________ mL。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、
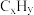 、
、 三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。
在图示的转化中,被还原的元素是
(2)SCR技术可使
 与
与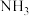 直接反应,实现无害转化。假设
直接反应,实现无害转化。假设 是NO时,发生反应的化学方程式是
是NO时,发生反应的化学方程式是(3)利用
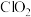 氧化氮氧化物反应过程如下:
氧化氮氧化物反应过程如下: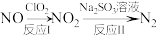 。反应I的化学方程式是
。反应I的化学方程式是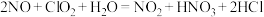 ,反应II的离子方程式是
,反应II的离子方程式是(4)加入过量次氯酸钠可使废水中
 完全转化为
完全转化为 ,而本身被还原为NaCl。
,而本身被还原为NaCl。①检验废水中是否存在
 的方法是
的方法是②若处理废水产生了0.448L
 (标准状况),则需消耗浓度为2mol/L的次氯酸钠的体积为
(标准状况),则需消耗浓度为2mol/L的次氯酸钠的体积为
您最近一年使用:0次
名校
2 . 工业上用含三价钒( )为主的某石煤为原料(含有
)为主的某石煤为原料(含有 、
、 等杂质),钙化法焙烧制备
等杂质),钙化法焙烧制备 ,其流程如下:
,其流程如下: 价钒在溶液中的主要存在形式与溶液pH的关系:
价钒在溶液中的主要存在形式与溶液pH的关系:
(1)焙烧:向石煤中加生石灰焙烧,利用空气中的氧气将 转化为
转化为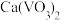 。在该过程中,
。在该过程中, 与
与 的物质量之比为
的物质量之比为_______ 。
(2)酸浸:已知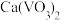 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的
难溶于水,可溶于盐酸。若焙砂酸浸时溶液的 ,此时
,此时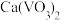 溶于盐酸的离子方程式是
溶于盐酸的离子方程式是_______ 。
(3)转沉:将浸出液中的钒转化为 固体,其流程如下:
固体,其流程如下:_______ 。
②向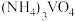 溶液中加入
溶液中加入 溶液,控制溶液的
溶液,控制溶液的 。当
。当 时,
时, 的产量明显降低,原因是
的产量明显降低,原因是_______ 。
(4)煅烧:煅烧时生成 的化学方程式是
的化学方程式是_______ 。
(5)测定产品中 的纯度:称取
的纯度:称取 产品,先用硫酸溶解,得到
产品,先用硫酸溶解,得到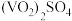 溶液。再加入
溶液。再加入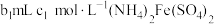 溶液。过量的
溶液。过量的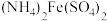 恰好能与
恰好能与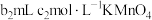 溶液完全反应。
溶液完全反应。
已知:ⅰ.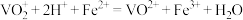 ;
;
ⅱ.测定过程中 被
被 还原为
还原为 。
。
假设杂质不参与反应,则产品中 的质量分数是
的质量分数是_______ 。
 )为主的某石煤为原料(含有
)为主的某石煤为原料(含有 、
、 等杂质),钙化法焙烧制备
等杂质),钙化法焙烧制备 ,其流程如下:
,其流程如下:
 价钒在溶液中的主要存在形式与溶液pH的关系:
价钒在溶液中的主要存在形式与溶液pH的关系:| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 |  |  |  |  |
 转化为
转化为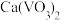 。在该过程中,
。在该过程中, 与
与 的物质量之比为
的物质量之比为(2)酸浸:已知
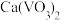 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的
难溶于水,可溶于盐酸。若焙砂酸浸时溶液的 ,此时
,此时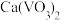 溶于盐酸的离子方程式是
溶于盐酸的离子方程式是(3)转沉:将浸出液中的钒转化为
 固体,其流程如下:
固体,其流程如下:
②向
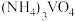 溶液中加入
溶液中加入 溶液,控制溶液的
溶液,控制溶液的 。当
。当 时,
时, 的产量明显降低,原因是
的产量明显降低,原因是(4)煅烧:煅烧时生成
 的化学方程式是
的化学方程式是(5)测定产品中
 的纯度:称取
的纯度:称取 产品,先用硫酸溶解,得到
产品,先用硫酸溶解,得到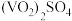 溶液。再加入
溶液。再加入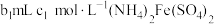 溶液。过量的
溶液。过量的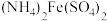 恰好能与
恰好能与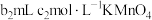 溶液完全反应。
溶液完全反应。已知:ⅰ.
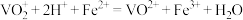 ;
;ⅱ.测定过程中
 被
被 还原为
还原为 。
。假设杂质不参与反应,则产品中
 的质量分数是
的质量分数是
您最近一年使用:0次
3 . 化石燃料的综合利用既能减少污染,又能提高资源利用率。回答下列问题:
(1)煤的气化是将煤转化为气体燃料,其中重要的一步反应是高温下焦炭与水蒸气反应制备水煤气(CO、H2),该反应的化学方程式为___________ 。
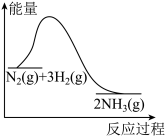
(2)合成氨工业是煤化工产业链中非常重要的一步。合成氨反应过程中的能量变化如图所示,则该反应为___________ (填“吸热”或“放热”)反应。
(3)实验室模拟工业合成氨,向2L恒容密闭容器内充入1molN2反应过程和3molH2,在一定条件下发生反应。若经过5min后,测得容器内NH3的物质的量为1mol,则这段时间内,v(N2)=___________ ,此时容器内H2的物质的量浓度为___________ 。
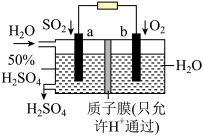
(4)天然气的主要成分是CH4.在酸性介质中,利用反应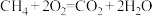 可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示(其中质子交换膜只允许H+通过):
可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示(其中质子交换膜只允许H+通过):
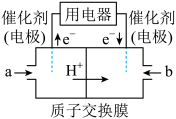
通入b气体的电极名称为___________ ,通入a气体的电极上反应式为___________ 。
(1)煤的气化是将煤转化为气体燃料,其中重要的一步反应是高温下焦炭与水蒸气反应制备水煤气(CO、H2),该反应的化学方程式为
(2)合成氨工业是煤化工产业链中非常重要的一步。合成氨反应过程中的能量变化如图所示,则该反应为

(3)实验室模拟工业合成氨,向2L恒容密闭容器内充入1molN2反应过程和3molH2,在一定条件下发生反应。若经过5min后,测得容器内NH3的物质的量为1mol,则这段时间内,v(N2)=
(4)天然气的主要成分是CH4.在酸性介质中,利用反应
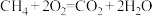 可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示(其中质子交换膜只允许H+通过):
可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示(其中质子交换膜只允许H+通过):
通入b气体的电极名称为
您最近一年使用:0次
2023-07-16更新
|
114次组卷
|
2卷引用:辽宁省鞍山市台安县高级中学2022-2023学年高一下学期期末考试化学试题
解题方法
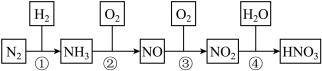
4 . 硝酸是一种具有强氧化性、腐蚀性的一元无机强酸,它也是一种重要的化工原料。氨氧化法生产硝酸是世界上生产硝酸的主要方法,其制备过程如图所示,回答下列问题:
(2)将装有50mLNO2、NO混合气体的量筒倒立在水槽中,反应后气体体积缩小为30mL,则原混合气体中NO2和NO的体积比是_______ 。
(3)热电厂通常用NH3消除燃煤烟气中的NO2,生成两种无污染的产物,写出该反应的化学方程式:_______ 。
(4)制备过程中②是氨的催化氧化反应,化学研究小组将经加热的铂丝插入锥形瓶内(如图所示),此时锥形瓶相当于氧化炉,可观察到铂丝保持红热,瓶口有红棕色气体生成,写出氨的催化氧化反应的化学方程式:_______ ,该反应_______ (填“吸热”或“放热”)。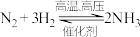 ,恒温下,在2L恒容密闭容器中,通入1molN2和3molH2的混合气体模拟工业上合成氨。
,恒温下,在2L恒容密闭容器中,通入1molN2和3molH2的混合气体模拟工业上合成氨。
①下列情况不能 说明N2与H2反应一定达到化学平衡状态的是_______ (填标号)。
A.NH3的质量不再变化 B.单位时间内消耗1molN2同时生成3molH2
C.容器内的压强不再变化 D.容器内N2、H2和NH3的分子数之比为1:3:2
②若2min末测得容器内NH3的物质的量为0.6mol,则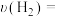
_______ mol·L-1·min-1。
(6)足量的铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、NO2的混合气体,这些气体与1.12LO2(标准状况下)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是_______  。
。
| A. NO2易溶于水生成HNO3,故NO2是酸性氧化物 |
| B.N2与O2反应时,不论O2是否足量,其一步反应都只能得到NO,不能生成NO2 |
| C.常温常压下,无色的NO能与空气中的O2直接化合生成红棕色的NO2 |
| D.在NO2与水的反应中,氧化剂与还原剂的质量之比为2:1 |
(3)热电厂通常用NH3消除燃煤烟气中的NO2,生成两种无污染的产物,写出该反应的化学方程式:
(4)制备过程中②是氨的催化氧化反应,化学研究小组将经加热的铂丝插入锥形瓶内(如图所示),此时锥形瓶相当于氧化炉,可观察到铂丝保持红热,瓶口有红棕色气体生成,写出氨的催化氧化反应的化学方程式:

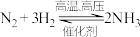 ,恒温下,在2L恒容密闭容器中,通入1molN2和3molH2的混合气体模拟工业上合成氨。
,恒温下,在2L恒容密闭容器中,通入1molN2和3molH2的混合气体模拟工业上合成氨。①下列情况
A.NH3的质量不再变化 B.单位时间内消耗1molN2同时生成3molH2
C.容器内的压强不再变化 D.容器内N2、H2和NH3的分子数之比为1:3:2
②若2min末测得容器内NH3的物质的量为0.6mol,则
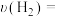
(6)足量的铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、NO2的混合气体,这些气体与1.12LO2(标准状况下)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
 。
。
您最近一年使用:0次
5 . 以黄铁矿(主要成分为 ,其中硫的化合价为-1价)生产硫酸的工艺流程如图所示。下列说法错误的是
,其中硫的化合价为-1价)生产硫酸的工艺流程如图所示。下列说法错误的是
 ,其中硫的化合价为-1价)生产硫酸的工艺流程如图所示。下列说法错误的是
,其中硫的化合价为-1价)生产硫酸的工艺流程如图所示。下列说法错误的是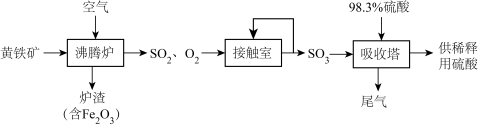
| A.将黄铁矿粉碎,可加快其在沸腾炉中的化学反应速率 |
B.沸腾炉中发生反应的化学方程式为: |
C.接触室中排放出的 、 、 循环利用,可提高原料利用率 循环利用,可提高原料利用率 |
D.依据上述流程,当最终生成 时,共转移 时,共转移 电子 电子 |
您最近一年使用:0次
名校
解题方法
6 . 氮元素与人类的生命、生产等活动息息相关。
(1)亚硝酸钠( )在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
)在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。 ;
;
②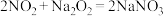
③酸性条件下, 、
、 和
和 都能与
都能与 反应生成
反应生成 和
和
请回答下列问题:
①装置A中发生反应的化学方程式为___________ 。
②装置B中的实验现象为___________ 。
③装置C的作用为___________ 。
④装置F中发生反应的离子方程式为___________ 。
(2)生物脱氮法流程如下: 的消除速率为
的消除速率为 ,则
,则 的消耗速率为
的消耗速率为___________ 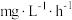 。
。
(3)目前,湿法 和
和 一体化脱除法是解决燃煤烟气领域的途径之一
一体化脱除法是解决燃煤烟气领域的途径之一
已知:两组实验中 溶液浓度均为
溶液浓度均为 ,
, 浓度均为
浓度均为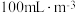
①图1是 、
、 、
、 对
对 的液相吸收。已知
的液相吸收。已知 溶液在脱除
溶液在脱除 时生成一种对空气无污染的气体,请写出该反应化学方程式
时生成一种对空气无污染的气体,请写出该反应化学方程式___________ 。 溶液同时吸收
溶液同时吸收 和
和 ,
, 脱除率在60%左右;单独吸收
脱除率在60%左右;单独吸收 时,
时, 脱除率在33%左右。结合①信息及图像解释原因
脱除率在33%左右。结合①信息及图像解释原因___________ 。
(1)亚硝酸钠(
 )在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
)在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。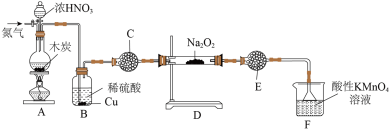
 ;
;②
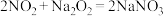
③酸性条件下,
 、
、 和
和 都能与
都能与 反应生成
反应生成 和
和
请回答下列问题:
①装置A中发生反应的化学方程式为
②装置B中的实验现象为
③装置C的作用为
④装置F中发生反应的离子方程式为
(2)生物脱氮法流程如下:
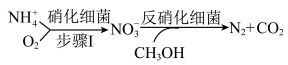
 的消除速率为
的消除速率为 ,则
,则 的消耗速率为
的消耗速率为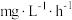 。
。(3)目前,湿法
 和
和 一体化脱除法是解决燃煤烟气领域的途径之一
一体化脱除法是解决燃煤烟气领域的途径之一已知:两组实验中
 溶液浓度均为
溶液浓度均为 ,
, 浓度均为
浓度均为
①图1是
 、
、 、
、 对
对 的液相吸收。已知
的液相吸收。已知 溶液在脱除
溶液在脱除 时生成一种对空气无污染的气体,请写出该反应化学方程式
时生成一种对空气无污染的气体,请写出该反应化学方程式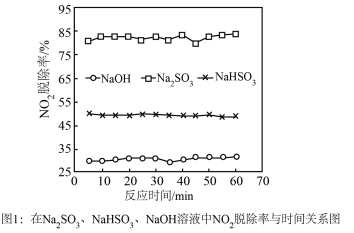
 溶液同时吸收
溶液同时吸收 和
和 ,
, 脱除率在60%左右;单独吸收
脱除率在60%左右;单独吸收 时,
时, 脱除率在33%左右。结合①信息及图像解释原因
脱除率在33%左右。结合①信息及图像解释原因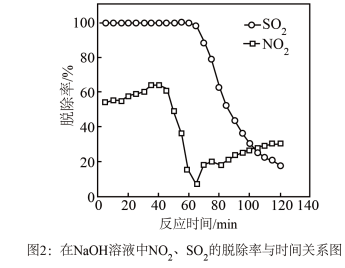
您最近一年使用:0次
2023-07-14更新
|
575次组卷
|
4卷引用:辽宁省辽南协作校2022-2023学年高一下学期期末考试化学试题
辽宁省辽南协作校2022-2023学年高一下学期期末考试化学试题(已下线)综合突破02 期末压轴80题之非选择题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)(已下线)综合02 期末压轴80题之非选择题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)四川省泸州市泸县第五中学2023-2024学年高二上学期开学考试化学试题
解题方法
7 . 海水中蕴藏着大量资源,利用海水可提取溴和镁,主要工业生产流程如下图所示:
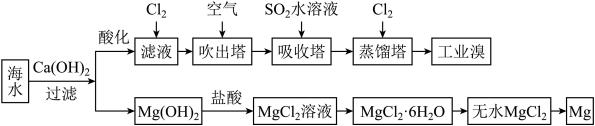
请回答下列问题。
(1)吸收塔中发生的主要反应的离子方程式为___________ 。
(2)提取溴的过程中,经过两次 的转化,其目的是
的转化,其目的是___________ 。
(3)吹出塔吹出的含溴空气经由吸收塔吸收溴后回到吹出塔进行循环利用。吹出塔中 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示。
流量的关系如图所示。
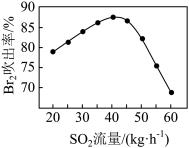
 流量过大,
流量过大, 吹出率反而下降的原因是
吹出率反而下降的原因是___________ 。
(4)工业上也可用 溶液吸收吹出的
溶液吸收吹出的 ,将以下方程式补充完整。
,将以下方程式补充完整。________
___________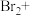 ___________
___________ ___________
___________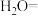 __________
__________
 ___________
___________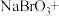 ___________
___________
(5)从 溶液中得到
溶液中得到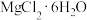 晶体的主要操作为
晶体的主要操作为___________ 、___________ 、过滤、洗涤、干燥(在HCl气流的保护下)。
(6)工业上用无水氯化镁得到金属镁的冶炼方法为___________ 。
(7)请写出上述过程中可以循环利用的一种物质___________ 。(写出化学式)。

请回答下列问题。
(1)吸收塔中发生的主要反应的离子方程式为
(2)提取溴的过程中,经过两次
 的转化,其目的是
的转化,其目的是(3)吹出塔吹出的含溴空气经由吸收塔吸收溴后回到吹出塔进行循环利用。吹出塔中
 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示。
流量的关系如图所示。
 流量过大,
流量过大, 吹出率反而下降的原因是
吹出率反而下降的原因是(4)工业上也可用
 溶液吸收吹出的
溶液吸收吹出的 ,将以下方程式补充完整。
,将以下方程式补充完整。___________
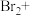 ___________
___________ ___________
___________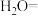 __________
__________
 ___________
___________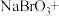 ___________
___________
(5)从
 溶液中得到
溶液中得到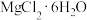 晶体的主要操作为
晶体的主要操作为(6)工业上用无水氯化镁得到金属镁的冶炼方法为
(7)请写出上述过程中可以循环利用的一种物质
您最近一年使用:0次
解题方法
8 . 为治理雾霾天气,可采用多种方法实现工业废气脱硫。
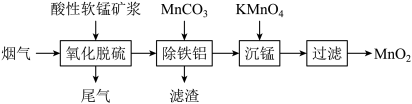
Ⅰ.软锰矿浆(主要成分 ,含有少量铁、铝等氧化物)可脱除燃煤烟气中的
,含有少量铁、铝等氧化物)可脱除燃煤烟气中的 ,又可制得电池材料
,又可制得电池材料 。主要流程如图:
。主要流程如图:
(1)提高烟气吸收效率的可行措施有___________ (写出两点)。
(2)写出“沉锰”步骤发生反应的离子方程式:___________ 。
(3)现将该烟气以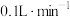 的流量通入到装有
的流量通入到装有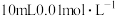 的
的 溶液的装置中,
溶液的装置中, 后,
后, 恰好完全反应。计算该烟气中
恰好完全反应。计算该烟气中 含量:
含量:___________  。
。
II.活性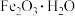 是一种固体脱硫剂(无水
是一种固体脱硫剂(无水 无脱硫作用),其原理是将废气中的含硫化合物化学吸附到脱硫剂的孔隙中,发生反应改变其化学组成。利用活性
无脱硫作用),其原理是将废气中的含硫化合物化学吸附到脱硫剂的孔隙中,发生反应改变其化学组成。利用活性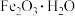 脱除沼气中的
脱除沼气中的 可转化成
可转化成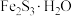 。
。
(4)“脱除沼气中 ”反应的化学方程式为
”反应的化学方程式为___________ 。
(5)工业上要求脱除过程温度不能超过 ,原因是
,原因是___________ 。
Ⅲ.有人设想利用电化学原理除去 ,并将化学能转化为电能。装置图如下。
,并将化学能转化为电能。装置图如下。
(6)电池的正极是___________ 。(填“a”或“b”)
(7)写出a电极的电极反应___________ 。
Ⅰ.软锰矿浆(主要成分
 ,含有少量铁、铝等氧化物)可脱除燃煤烟气中的
,含有少量铁、铝等氧化物)可脱除燃煤烟气中的 ,又可制得电池材料
,又可制得电池材料 。主要流程如图:
。主要流程如图:
(1)提高烟气吸收效率的可行措施有
(2)写出“沉锰”步骤发生反应的离子方程式:
(3)现将该烟气以
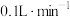 的流量通入到装有
的流量通入到装有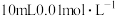 的
的 溶液的装置中,
溶液的装置中, 后,
后, 恰好完全反应。计算该烟气中
恰好完全反应。计算该烟气中 含量:
含量: 。
。II.活性
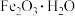 是一种固体脱硫剂(无水
是一种固体脱硫剂(无水 无脱硫作用),其原理是将废气中的含硫化合物化学吸附到脱硫剂的孔隙中,发生反应改变其化学组成。利用活性
无脱硫作用),其原理是将废气中的含硫化合物化学吸附到脱硫剂的孔隙中,发生反应改变其化学组成。利用活性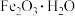 脱除沼气中的
脱除沼气中的 可转化成
可转化成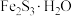 。
。(4)“脱除沼气中
 ”反应的化学方程式为
”反应的化学方程式为(5)工业上要求脱除过程温度不能超过
 ,原因是
,原因是Ⅲ.有人设想利用电化学原理除去
 ,并将化学能转化为电能。装置图如下。
,并将化学能转化为电能。装置图如下。
(6)电池的正极是
(7)写出a电极的电极反应
您最近一年使用:0次
2023-07-13更新
|
418次组卷
|
2卷引用:辽宁省五校(大连二十四中、东北育才等)2022-2023学年高一下学期期末考试化学试题
解题方法
9 . 某含镁废弃物中主要含有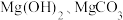 ,还含有少量的
,还含有少量的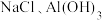 、
、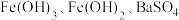 ,以该固体废弃物为原料制备
,以该固体废弃物为原料制备 的流程如下:
的流程如下:

已知:部分离子开始沉淀和完全沉淀的
回答下列问题:
(1)滤渣1的主要成分为_______ (填化学式),其阴离子空间构型为_______ 。
(2)“酸浸”时,发生反应的基本反应类型均为_______ ,所使用的稀盐酸的质量浓度为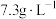 ,则其物质的量浓度为
,则其物质的量浓度为_______  。
。
(3)“氧化”时,反应的离子方程式为_______ 。
(4)“调 ”时,
”时, 的调节范围为
的调节范围为_______ (滤渣2中有两种氢氧化物)。
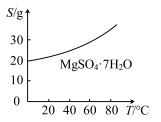
(5)已知 的溶解度曲线如图所示。“操作”应包括
的溶解度曲线如图所示。“操作”应包括_______ 、过滤、洗涤、干燥。
(6)若测定 晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
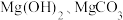 ,还含有少量的
,还含有少量的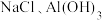 、
、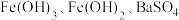 ,以该固体废弃物为原料制备
,以该固体废弃物为原料制备 的流程如下:
的流程如下:
已知:部分离子开始沉淀和完全沉淀的

| 氢氧化物 |  |  |  |
开始沉淀时的 | 4.0 | 8.4 | 1.9 |
完全沉淀时的 | 5.2 | 11.2 | 3.2 |
(1)滤渣1的主要成分为
(2)“酸浸”时,发生反应的基本反应类型均为
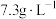 ,则其物质的量浓度为
,则其物质的量浓度为 。
。(3)“氧化”时,反应的离子方程式为
(4)“调
 ”时,
”时, 的调节范围为
的调节范围为(5)已知
 的溶解度曲线如图所示。“操作”应包括
的溶解度曲线如图所示。“操作”应包括
(6)若测定
 晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。
晶体中结晶水的含量,下列仪器一定不需要的是_______(填字母)。| A | B | C | D |
 |  |  |  |
| 天平 | 坩埚 | 马弗炉(一种加热设备) | 分液漏斗 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-12更新
|
106次组卷
|
2卷引用:辽宁省朝阳市2022-2023学年高二下学期期末联考化学试题
10 . 化学是一门实用性很强的科学,请根据题意填空:
(1)铝制餐具不宜长时间存放酸性、碱性食物,但常温下铝制容器可以盛装___________ (填“浓硫酸”或“浓盐酸”)。
(2)我国5G通信技术处于世界领先地位,高速通信离不开光导纤维。用于制造光导纤维的基本原料是___________ (填化学式)。
(3)在汽车排气管上安装催化转化装置,可使尾气中的NO和CO反应转化为无污染的物质,请完成一定条件下该反应的化学方程式:2NO+2CO 2CO2+
2CO2+__________ 。
(4)“厉害了,我的国”,2017年4月:“天舟一号”成功对接,12月:大型客机C919(如下图)第二次在上海浦东机场试飞成功,实现了我国航空领域的新突破。
请回答下列问题:

①铝合金和碳纤维复合材料是飞机、火箭的常用材料,这主要利用了它们具有的共同性能是___________ (填字母序号)。
A.密度小 强度好 B.密度大 硬度大 C.熔点低 硬度小
②铝的金属活动性比铁的___________ (填“强”或“弱”),空气中,铝比铁具有更好的抗腐蚀性,原因是___________ (用化学反应方程式解释)。
③高温结构陶瓷可用于制造汽车发动机,通常所用的材料是氮化硅(Si3N4),该化合物中硅元素的化合价为___________ 。
(1)铝制餐具不宜长时间存放酸性、碱性食物,但常温下铝制容器可以盛装
(2)我国5G通信技术处于世界领先地位,高速通信离不开光导纤维。用于制造光导纤维的基本原料是
(3)在汽车排气管上安装催化转化装置,可使尾气中的NO和CO反应转化为无污染的物质,请完成一定条件下该反应的化学方程式:2NO+2CO
 2CO2+
2CO2+(4)“厉害了,我的国”,2017年4月:“天舟一号”成功对接,12月:大型客机C919(如下图)第二次在上海浦东机场试飞成功,实现了我国航空领域的新突破。
请回答下列问题:

①铝合金和碳纤维复合材料是飞机、火箭的常用材料,这主要利用了它们具有的共同性能是
A.密度小 强度好 B.密度大 硬度大 C.熔点低 硬度小
②铝的金属活动性比铁的
③高温结构陶瓷可用于制造汽车发动机,通常所用的材料是氮化硅(Si3N4),该化合物中硅元素的化合价为
您最近一年使用:0次



