2024·重庆·模拟预测
1 . 叠氮化钠(NaN3)在防腐、有机合成和汽车行业有着广泛的用途。用氨基钠(NaNH2)制取叠氮化钠的方程式为: 实验室用下列装置制取叠氮化钠。
实验室用下列装置制取叠氮化钠。
(1)仪器a的名称是_______ 。
(2)装置B、D的主要作用分别是_______ 。
(3)检查装置A的气密性的操作是_______ 。
(4)装置A中反应除生成装置C中需要的物质外,还生成SnCl4等。其反应的化学方程式为_______ 。
(5)装置C处充分反应后,应先停止加热,再关闭分液漏斗活塞,原因是_______ 。
(6)取mg反应后装置C中所得固体,用下图所示装置测定产品的纯度(原理为:加入ClO将N1氧化成N2,测定N2的体积,从而计算产品纯度)。_______ 。
②若G的初始读数为V1mL、末读数为V2mL,本实验条件下气体摩尔体积为VL·mol-1,则产品中NaN3的质量分数为_______ 。
 实验室用下列装置制取叠氮化钠。
实验室用下列装置制取叠氮化钠。
(1)仪器a的名称是
(2)装置B、D的主要作用分别是
(3)检查装置A的气密性的操作是
(4)装置A中反应除生成装置C中需要的物质外,还生成SnCl4等。其反应的化学方程式为
(5)装置C处充分反应后,应先停止加热,再关闭分液漏斗活塞,原因是
(6)取mg反应后装置C中所得固体,用下图所示装置测定产品的纯度(原理为:加入ClO将N1氧化成N2,测定N2的体积,从而计算产品纯度)。
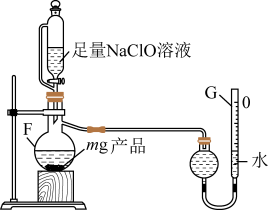
②若G的初始读数为V1mL、末读数为V2mL,本实验条件下气体摩尔体积为VL·mol-1,则产品中NaN3的质量分数为
您最近一年使用:0次
2024·重庆·二模
解题方法
2 . 氮化铬(CrN,黑色粉末)具有优异的力学性能、高温稳定性和耐腐蚀性,在航空航天领域有重要应用。实验室用氨气和无水 (紫色晶体,易潮解)制取CrN的装置如下图所示(夹持仪器略)。
(紫色晶体,易潮解)制取CrN的装置如下图所示(夹持仪器略)。____________ 。
(2)试剂m的名称是______ ,仪器b的名称是______ 。
(3)检查A装置气密性的操作为:将A装置右侧导管连接到盛水的水槽中,____________ ,则气密性良好。
(4)装置E的主要作用是____________ ;制取CrN的反应是非氧化还原反应,则反应过程中D中玻璃管内(小瓷舟外)产生的现象是____________ 。
(5)在制得的CrN中含有少量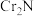 杂质,写出反应生成
杂质,写出反应生成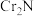 的化学方程式
的化学方程式____________ 。
(6)取样品(只含有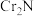 杂质)38.9g在空气中充分加热,得固体残渣(
杂质)38.9g在空气中充分加热,得固体残渣( )的质量为45.6g,则样品中CrN的质量分数为
)的质量为45.6g,则样品中CrN的质量分数为______ %(保留一位小数)。
 (紫色晶体,易潮解)制取CrN的装置如下图所示(夹持仪器略)。
(紫色晶体,易潮解)制取CrN的装置如下图所示(夹持仪器略)。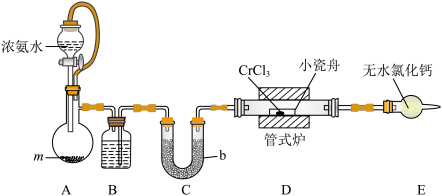
(2)试剂m的名称是
(3)检查A装置气密性的操作为:将A装置右侧导管连接到盛水的水槽中,
(4)装置E的主要作用是
(5)在制得的CrN中含有少量
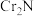 杂质,写出反应生成
杂质,写出反应生成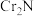 的化学方程式
的化学方程式(6)取样品(只含有
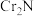 杂质)38.9g在空气中充分加热,得固体残渣(
杂质)38.9g在空气中充分加热,得固体残渣( )的质量为45.6g,则样品中CrN的质量分数为
)的质量为45.6g,则样品中CrN的质量分数为
您最近一年使用:0次
3 . 钡盐沉淀法处理酸性含铬废水(含 、[Ni(CN)4]2-、
、[Ni(CN)4]2-、 等)并回收铬元素的工艺路线如下:
等)并回收铬元素的工艺路线如下: +H2O
+H2O 2
2 +2H+
+2H+
II.室温下相关物质的Ksp如下:
(1)向废水中加入破氰剂NaClO,可以提高镍元素的去除率。①NaClO能氧化CN-,生成无毒无味气体,补全该反应的离子方程式:_____ 。
□CN-+□_____+□_____=□ +□_____+□_____
+□_____+□_____
②结合平衡移动原理解释加入NaClO可提高镍元素的去除率的原因:_____ 。
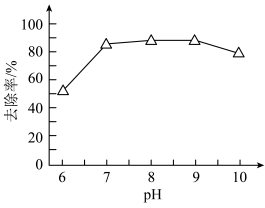
(2)用石灰乳将含铬废水预调至不同pH,经破氰后取等量的溶液1,向其中加入等量的BaCl2·2H2O,搅拌、反应60min,得到Cr(VI)去除率随预调pH变化如图。与预调pH=6相比,pH=7时Cr(VI)的去除率显著提高,可能的原因有_____ (写出两条)。_____ 。
(4)溶液2需处理至Ba2+含量达标后方可排放。可用如下方法测定废水中Ba2+含量。
步骤1:取aL含Ba2+废水,浓缩至100mL后,加入过量的Na2CrO4标准溶液,充分反应后过滤,向滤液中加入指示剂,用0.1mol·L−1HCl标准溶液滴定至CrO 全部转化为Cr2O
全部转化为Cr2O ,消耗HCl标准溶液的体积为bmL。
,消耗HCl标准溶液的体积为bmL。
步骤2:取100mL蒸馏水,加入与步骤1中等量的Na2CrO4标准溶液,加入指示剂,用0.1mol·L−1HCl标准溶液滴定,消耗HCl标准溶液的体积为cmL。
①步骤1中加入的Na2CrO4标准溶液必须过量,目的是_____ 。
②若废水中其他杂质不参与反应,则废水中Ba2+的含量为_____ mg·L−1(写出表达式)。
 、[Ni(CN)4]2-、
、[Ni(CN)4]2-、 等)并回收铬元素的工艺路线如下:
等)并回收铬元素的工艺路线如下:
 +H2O
+H2O 2
2 +2H+
+2H+II.室温下相关物质的Ksp如下:
| 化合物 | CaSO4 | BaSO4 | BaCrO4 |
| Ksp | 4.9×10-5 | 1.1×10-10 | 1.2×10-10 |
(1)向废水中加入破氰剂NaClO,可以提高镍元素的去除率。①NaClO能氧化CN-,生成无毒无味气体,补全该反应的离子方程式:
□CN-+□_____+□_____=□
 +□_____+□_____
+□_____+□_____②结合平衡移动原理解释加入NaClO可提高镍元素的去除率的原因:
(2)用石灰乳将含铬废水预调至不同pH,经破氰后取等量的溶液1,向其中加入等量的BaCl2·2H2O,搅拌、反应60min,得到Cr(VI)去除率随预调pH变化如图。与预调pH=6相比,pH=7时Cr(VI)的去除率显著提高,可能的原因有
(4)溶液2需处理至Ba2+含量达标后方可排放。可用如下方法测定废水中Ba2+含量。
步骤1:取aL含Ba2+废水,浓缩至100mL后,加入过量的Na2CrO4标准溶液,充分反应后过滤,向滤液中加入指示剂,用0.1mol·L−1HCl标准溶液滴定至CrO
 全部转化为Cr2O
全部转化为Cr2O ,消耗HCl标准溶液的体积为bmL。
,消耗HCl标准溶液的体积为bmL。步骤2:取100mL蒸馏水,加入与步骤1中等量的Na2CrO4标准溶液,加入指示剂,用0.1mol·L−1HCl标准溶液滴定,消耗HCl标准溶液的体积为cmL。
①步骤1中加入的Na2CrO4标准溶液必须过量,目的是
②若废水中其他杂质不参与反应,则废水中Ba2+的含量为
您最近一年使用:0次
解题方法
4 . 以方铅矿(主要含 )和废铅膏(主要含
)和废铅膏(主要含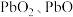 )为原料联合提铅的一种流程示意图如下。
)为原料联合提铅的一种流程示意图如下。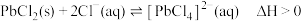
ii.
(1)浸出
 时,加入过量的盐酸和
时,加入过量的盐酸和 溶液的混合液将铅元素全部以
溶液的混合液将铅元素全部以 形式浸出。
形式浸出。
①“浸出”过程中,发生的主要反应有:
I.
II.
III.___________ (浸出 的离子方程式)
的离子方程式)
②I生成的 作II的催化剂使浸出速率增大,其催化过程可表示为:
作II的催化剂使浸出速率增大,其催化过程可表示为:
i.
ii.___________ (离子方程式)
③充分浸出后,分离出含 溶液的方法是
溶液的方法是___________ 。
(2)结晶
向含 的溶液中加入适量的冷水结晶获得
的溶液中加入适量的冷水结晶获得 ,结合浓度商(Q)与平衡常数(K)的影响因素及大小关系,解释加入冷水的作用:
,结合浓度商(Q)与平衡常数(K)的影响因素及大小关系,解释加入冷水的作用:___________ 。
(3)脱氯碳化
室温时,向 溶液中加入少量浓氨水调至
溶液中加入少量浓氨水调至 ,然后加入
,然后加入 固体进行脱氯碳化。
固体进行脱氯碳化。
①随着脱氯碳化反应进行,溶液的
___________ (填“增大”“减小”或“不变”)。
②脱氯碳化过程中,检测到 。
。 浊液转化为
浊液转化为 的最低
的最低
___________ 。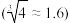
(4)还原
将 溶于
溶于 溶液可制备
溶液可制备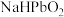 ,反应:
,反应: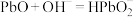 。制备高纯铅的原电池原理示意图如图所示。
。制备高纯铅的原电池原理示意图如图所示。___________ (填“正极”或“负极”)。
②电池的总反应的离子方程式是___________ 。
③从物质和能量利用的角度说明该工艺的优点:___________ 。
 )和废铅膏(主要含
)和废铅膏(主要含 )为原料联合提铅的一种流程示意图如下。
)为原料联合提铅的一种流程示意图如下。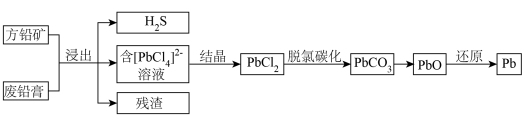
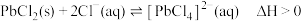
ii.
| 物质 |  |  |  |
 |  | 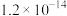 | 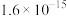 |
(1)浸出
 时,加入过量的盐酸和
时,加入过量的盐酸和 溶液的混合液将铅元素全部以
溶液的混合液将铅元素全部以 形式浸出。
形式浸出。①“浸出”过程中,发生的主要反应有:
I.

II.

III.
 的离子方程式)
的离子方程式)②I生成的
 作II的催化剂使浸出速率增大,其催化过程可表示为:
作II的催化剂使浸出速率增大,其催化过程可表示为:i.

ii.
③充分浸出后,分离出含
 溶液的方法是
溶液的方法是(2)结晶
向含
 的溶液中加入适量的冷水结晶获得
的溶液中加入适量的冷水结晶获得 ,结合浓度商(Q)与平衡常数(K)的影响因素及大小关系,解释加入冷水的作用:
,结合浓度商(Q)与平衡常数(K)的影响因素及大小关系,解释加入冷水的作用:(3)脱氯碳化
室温时,向
 溶液中加入少量浓氨水调至
溶液中加入少量浓氨水调至 ,然后加入
,然后加入 固体进行脱氯碳化。
固体进行脱氯碳化。①随着脱氯碳化反应进行,溶液的

②脱氯碳化过程中,检测到
 。
。 浊液转化为
浊液转化为 的最低
的最低
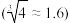
(4)还原
将
 溶于
溶于 溶液可制备
溶液可制备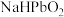 ,反应:
,反应: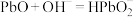 。制备高纯铅的原电池原理示意图如图所示。
。制备高纯铅的原电池原理示意图如图所示。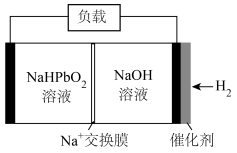
②电池的总反应的离子方程式是
③从物质和能量利用的角度说明该工艺的优点:
您最近一年使用:0次
2024·广东·一模
解题方法
5 .  是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂,木材和皮革的保存剂。由菱锌矿(主要成分为
是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂,木材和皮革的保存剂。由菱锌矿(主要成分为 ,还含有少量:
,还含有少量: 、
、 、
、 、
、 、
、 、PbO,
、PbO, 、CdO和
、CdO和 )制备
)制备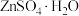 流程如下:
流程如下:
回答下列问题:
(1)加硫酸浸取后再调节pH=5,过滤获得的滤渣①的主要成分为 、
、 、
、 、
、___________ 和___________ 。
(2)加入 溶液后过滤可以得到
溶液后过滤可以得到 和
和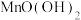 两种沉淀,
两种沉淀, 发生反应的离子方程式为
发生反应的离子方程式为___________ ,常温下,此时溶液pH仍为5,则溶液残留的微量 的浓度约为
的浓度约为___________ mol/L⋅,根据“转化过滤”过程,推测若Zn、稀硫酸、Cd形成原电池,则电势较高的一极为___________ 。
(3)“脱钙镁”后“过滤”所得的滤渣还可以和浓硫酸反应制备HF以循环使用,则该反应可以发生的原因是___________ 。
(4)脱完钙和镁之后的 滤液中含有少量的
滤液中含有少量的 ,
, 的溶解度曲线如图。由滤液④获得
的溶解度曲线如图。由滤液④获得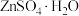 的具体操作为
的具体操作为___________ 。___________ (用含a、b、c的代数式表示)。
 是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂,木材和皮革的保存剂。由菱锌矿(主要成分为
是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂,木材和皮革的保存剂。由菱锌矿(主要成分为 ,还含有少量:
,还含有少量: 、
、 、
、 、
、 、
、 、PbO,
、PbO, 、CdO和
、CdO和 )制备
)制备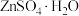 流程如下:
流程如下: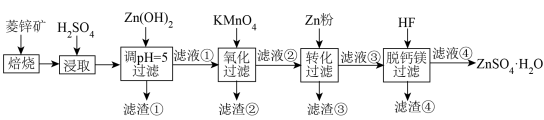
| 金属阳离子 |  |  |  | 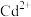 |  |  |  |
| 开始沉淀pH | 6.2 | 7.4 | 2.2 | 7.7 | 9.1 | 8.1 | 3.4 |
| 沉淀完全pH | 8.2 | 8.9 | 3.2 | 9.7 | 11.1 | 10.1 | 4.7 |
(1)加硫酸浸取后再调节pH=5,过滤获得的滤渣①的主要成分为
 、
、 、
、 、
、(2)加入
 溶液后过滤可以得到
溶液后过滤可以得到 和
和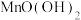 两种沉淀,
两种沉淀, 发生反应的离子方程式为
发生反应的离子方程式为 的浓度约为
的浓度约为(3)“脱钙镁”后“过滤”所得的滤渣还可以和浓硫酸反应制备HF以循环使用,则该反应可以发生的原因是
(4)脱完钙和镁之后的
 滤液中含有少量的
滤液中含有少量的 ,
, 的溶解度曲线如图。由滤液④获得
的溶解度曲线如图。由滤液④获得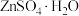 的具体操作为
的具体操作为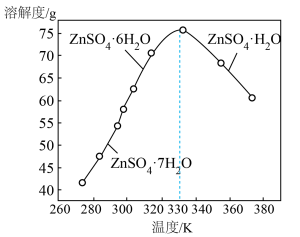
您最近一年使用:0次
2024·湖南·一模
6 . 湿法炼锌具有能耗低,生成产品纯度高等特点,其主要原料为锌精矿(主要成分为硫化锌,还含有铁、钴、铜、镉、铅等元素的杂质),获得较纯锌锭的工艺流程如图: 、
、 、CdO。
、CdO。
(1)铜原子的价层电子排布图为___________ 。
(2)“酸浸”中滤渣主要成分为___________ 。
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:___________ 。
(4)写出“赤铁矿除铁”过程中反应的离子方程式:___________ 。
(5)“ —萘酚净化除钴”先是
—萘酚净化除钴”先是 把
把 氧化成
氧化成 ,并生成NO,
,并生成NO, 与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出
与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出 被氧化的离子方程式:
被氧化的离子方程式:___________ 。
(6)“电解”工艺中,电解液常有较高浓度的 会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和
会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和 ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去 。已知:
。已知: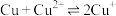
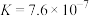 ;
;
 。请通过具体数据说明上述的反应能完全进行的原因:
。请通过具体数据说明上述的反应能完全进行的原因:___________ 。
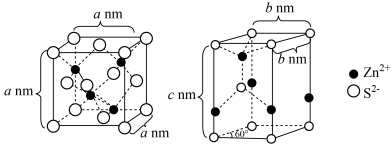
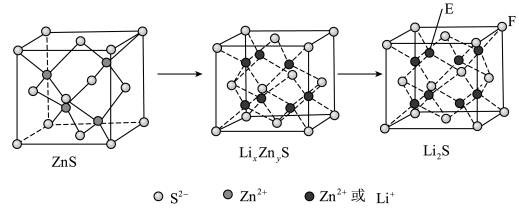
(7)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。 的电极方程式为
的电极方程式为___________ (x和y用具体数字表示)。
②若 的晶胞参数为a nm,则EF间的距离为
的晶胞参数为a nm,则EF间的距离为___________ nm。

 、
、 、CdO。
、CdO。(1)铜原子的价层电子排布图为
(2)“酸浸”中滤渣主要成分为
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:
(4)写出“赤铁矿除铁”过程中反应的离子方程式:
(5)“
 —萘酚净化除钴”先是
—萘酚净化除钴”先是 把
把 氧化成
氧化成 ,并生成NO,
,并生成NO, 与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出
与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出 被氧化的离子方程式:
被氧化的离子方程式:(6)“电解”工艺中,电解液常有较高浓度的
 会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和
会腐蚀阳极而增大电解能耗。可向溶液中同时加入Cu和 ,生成CuCl沉淀从而除去
,生成CuCl沉淀从而除去 。已知:
。已知: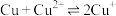
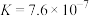 ;
;
 。请通过具体数据说明上述的反应能完全进行的原因:
。请通过具体数据说明上述的反应能完全进行的原因:(7)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。
 的电极方程式为
的电极方程式为②若
 的晶胞参数为a nm,则EF间的距离为
的晶胞参数为a nm,则EF间的距离为
您最近一年使用:0次
7 . 钼是一种重要的过渡元素,钼钢是制火箭发动机的重要材料,钼酸钠晶体 是一种重要的金属缓蚀剂。某工厂利用钼矿粉(主要成分
是一种重要的金属缓蚀剂。某工厂利用钼矿粉(主要成分 ,杂质为
,杂质为 )为原料冶炼金属钼和钼酸钠晶体的主要流程图如下:
)为原料冶炼金属钼和钼酸钠晶体的主要流程图如下:

回答下列问题:
(1) 的价层电子排布式为
的价层电子排布式为___________ 。
(2)“焙烧”中生成 的化学方程式为
的化学方程式为___________ 。
(3)由图中信息可以判断 是
是___________ 氧化物(填“酸性”“碱性”或“两性”)。
(4)废渣成分的化学式为___________ 。
(5)碱浸液结晶前需加入 固体以除去
固体以除去 ,当
,当 开始沉淀时,
开始沉淀时, 的去除率是
的去除率是___________ [已知:碱浸液中 ,
, ,
,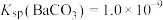 ,
, ,加入
,加入 固体引起的溶液体积变化可忽略]。
固体引起的溶液体积变化可忽略]。
(6)由钼酸钠溶液得到钼酸钠晶体的“操作1”为___________ 。
(7)某工厂用 吨粗钼矿(含
吨粗钼矿(含 )制备钼单质,已知冶炼过程中,钼的损耗率为
)制备钼单质,已知冶炼过程中,钼的损耗率为 ,则最终得到钼单质质量为
,则最终得到钼单质质量为___________ 吨(保留2位小数)。
 是一种重要的金属缓蚀剂。某工厂利用钼矿粉(主要成分
是一种重要的金属缓蚀剂。某工厂利用钼矿粉(主要成分 ,杂质为
,杂质为 )为原料冶炼金属钼和钼酸钠晶体的主要流程图如下:
)为原料冶炼金属钼和钼酸钠晶体的主要流程图如下:
回答下列问题:
(1)
 的价层电子排布式为
的价层电子排布式为(2)“焙烧”中生成
 的化学方程式为
的化学方程式为(3)由图中信息可以判断
 是
是(4)废渣成分的化学式为
(5)碱浸液结晶前需加入
 固体以除去
固体以除去 ,当
,当 开始沉淀时,
开始沉淀时, 的去除率是
的去除率是 ,
, ,
,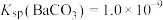 ,
, ,加入
,加入 固体引起的溶液体积变化可忽略]。
固体引起的溶液体积变化可忽略]。(6)由钼酸钠溶液得到钼酸钠晶体的“操作1”为
(7)某工厂用
 吨粗钼矿(含
吨粗钼矿(含 )制备钼单质,已知冶炼过程中,钼的损耗率为
)制备钼单质,已知冶炼过程中,钼的损耗率为 ,则最终得到钼单质质量为
,则最终得到钼单质质量为
您最近一年使用:0次
解题方法
8 . 在中国古代,硫酸被炼丹术士称为“绿矾油”。这是因为生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧后,釜中逸出刺激性气味的气体,同时有油状液体流出,残留固体呈红棕色。

(1)请写出煅烧绿矾过程中发生反应的化学方程式:
①___________ ;
②___________ 。
(2)化学探究小组的同学用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去),其中b为干燥的试管。下列关于该反应说法正确的是___________。

(1)请写出煅烧绿矾过程中发生反应的化学方程式:
①
②
(2)化学探究小组的同学用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去),其中b为干燥的试管。下列关于该反应说法正确的是___________。
A.若将反应后的气体通入 溶液中,产生的沉淀为 溶液中,产生的沉淀为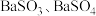 |
B.b中产物用紫色石蕊试液即可检验出其中 和 和 |
C.为检验反应的气态生成物是 ,试管c中应加入的试剂为NaOH溶液 ,试管c中应加入的试剂为NaOH溶液 |
| D.b中所得到的硫酸的质量分数为29.5% |
您最近一年使用:0次
名校
9 . 碘化镍(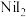 )可用于制陶瓷等。以废镍催化剂(主要成分是Ni,含少量Zn、Fe、CaO、
)可用于制陶瓷等。以废镍催化剂(主要成分是Ni,含少量Zn、Fe、CaO、 等杂质)为原料制备碘化镍的流程如下:
等杂质)为原料制备碘化镍的流程如下: 。
。
回答下列问题:
(1)滤渣1的成分是 、
、__________ (填化学式)。滤渣2经过洗涤、干燥、________ (填操作名称)可制铁红。
(2)“除铁”中可通过先加入 溶液再加入NiO替代NaClO溶液,
溶液再加入NiO替代NaClO溶液, 的作用是
的作用是________________ (用离子方程式表示)。
(3)“除钙”时,为确保滤液中 ,溶液中
,溶液中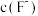 至少为
至少为________  (保留两位有效数字)。
(保留两位有效数字)。
(4)“萃取”过程主要除去的金属杂质离子是________ (填离子符号)。
(5)“分解”过程中通入 的作用是
的作用是________________ 。
(6)在空气中加热一定量的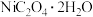 (相对分子质量为183)晶体,测得固体失重率(固体失重率=
(相对分子质量为183)晶体,测得固体失重率(固体失重率= )与温度的关系如图所示,300~400℃时发生反应的化学方程式为
)与温度的关系如图所示,300~400℃时发生反应的化学方程式为________________ 。
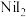 )可用于制陶瓷等。以废镍催化剂(主要成分是Ni,含少量Zn、Fe、CaO、
)可用于制陶瓷等。以废镍催化剂(主要成分是Ni,含少量Zn、Fe、CaO、 等杂质)为原料制备碘化镍的流程如下:
等杂质)为原料制备碘化镍的流程如下: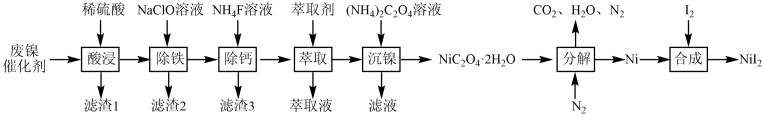
 。
。回答下列问题:
(1)滤渣1的成分是
 、
、(2)“除铁”中可通过先加入
 溶液再加入NiO替代NaClO溶液,
溶液再加入NiO替代NaClO溶液, 的作用是
的作用是(3)“除钙”时,为确保滤液中
 ,溶液中
,溶液中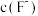 至少为
至少为 (保留两位有效数字)。
(保留两位有效数字)。(4)“萃取”过程主要除去的金属杂质离子是
(5)“分解”过程中通入
 的作用是
的作用是(6)在空气中加热一定量的
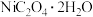 (相对分子质量为183)晶体,测得固体失重率(固体失重率=
(相对分子质量为183)晶体,测得固体失重率(固体失重率= )与温度的关系如图所示,300~400℃时发生反应的化学方程式为
)与温度的关系如图所示,300~400℃时发生反应的化学方程式为
您最近一年使用:0次
2024-04-03更新
|
590次组卷
|
3卷引用:2024届高考专家联测卷(四)理科综合试题-高中化学
2024届高考专家联测卷(四)理科综合试题-高中化学(已下线)题型10 工艺流程题(25题)-2024年高考化学常考点必杀300题(新高考通用)安徽省六安第一中学2024届高三下学期质量检测(一 )化学试题
名校
解题方法
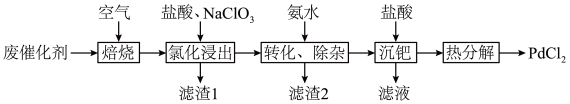
10 . 以Al2O3为载体的钯催化剂常用于石化行业加氢催化裂化过程中,工业上以失活后的废Pd-Al2O3催化剂(主要含有Pd、Al2O3,还有少量PdO、SiO2、C)为原料制备氯化钯的流程如下:
(1)“焙烧”能有效清除废催化剂表面的积碳,打开Al2O3载体对钯的包裹,提高“氯化浸出”率。依据下图可判断“焙烧”的温度和时间应控制在___________ ,若焙烧时间过长,导致“氯化浸出”率下降可能的原因是___________ 。___________ ,通过该工序可将Pd转化为 ,
, 呈平面四边形,则
呈平面四边形,则 的杂化轨道类型为
的杂化轨道类型为___________ (填字母)。
A.sp2杂化 B.sp3杂化 C.dsp2杂化 D.dsp3杂化
(3)滤渣1为___________ ,滤渣2为___________ 。
(4)就“沉钯”中获得的 进行“热分解”,生成的气体可返回
进行“热分解”,生成的气体可返回___________ 工序继续使用。
(5)工业上也可用 还原
还原 制取海绵Pd,且对环境友好,该反应的化学方程式为
制取海绵Pd,且对环境友好,该反应的化学方程式为___________ 。
(1)“焙烧”能有效清除废催化剂表面的积碳,打开Al2O3载体对钯的包裹,提高“氯化浸出”率。依据下图可判断“焙烧”的温度和时间应控制在

 ,
, 呈平面四边形,则
呈平面四边形,则 的杂化轨道类型为
的杂化轨道类型为A.sp2杂化 B.sp3杂化 C.dsp2杂化 D.dsp3杂化
(3)滤渣1为
(4)就“沉钯”中获得的
 进行“热分解”,生成的气体可返回
进行“热分解”,生成的气体可返回(5)工业上也可用
 还原
还原 制取海绵Pd,且对环境友好,该反应的化学方程式为
制取海绵Pd,且对环境友好,该反应的化学方程式为
您最近一年使用:0次
2024-04-02更新
|
516次组卷
|
4卷引用:黑龙江省哈尔滨市三校联考2024届高三二模化学试题



