解题方法
1 . 金属单质钠可经下图所示的过程进行转化。
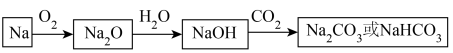
请回答下列问题:
(1)钠燃烧时,火焰呈___________ (选填“黄色”或“紫红色”)。
(2)根据物质的性质进行分类时, 可被称为
可被称为___________ (选填“酸性氧化物”或“碱性氧化物”)。
(3)在反应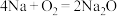 中,
中, 作
作___________ (选填“氧化剂”或“还原剂”)。
(4)钠元素的金属性较强,因此 与
与 反应生成的
反应生成的 是
是___________ (选填“强碱”或“弱碱”)。
(5)下图为 受热分解的实验装置图,图中应改正之处是
受热分解的实验装置图,图中应改正之处是___________ (填写字母)。
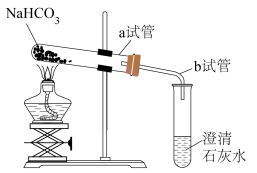
A.a试管口应略向上倾斜 B.b导管应插入液面下
(6)碳酸氢钠不稳定,受热易分解,产生的气体可以使澄清石灰水变浑浊。碳酸氢钠受热分解的化学方程式为:___________ 。
(7)可以利用___________ (选填“加热”或“过滤”)的方法来鉴别 和
和 。
。

请回答下列问题:
(1)钠燃烧时,火焰呈
(2)根据物质的性质进行分类时,
 可被称为
可被称为(3)在反应
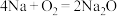 中,
中, 作
作(4)钠元素的金属性较强,因此
 与
与 反应生成的
反应生成的 是
是(5)下图为
 受热分解的实验装置图,图中应改正之处是
受热分解的实验装置图,图中应改正之处是
A.a试管口应略向上倾斜 B.b导管应插入液面下
(6)碳酸氢钠不稳定,受热易分解,产生的气体可以使澄清石灰水变浑浊。碳酸氢钠受热分解的化学方程式为:
(7)可以利用
 和
和 。
。
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
2 . 下列关于Na2CO3和NaHCO3两种物质有关性质,说法正确的是______ 。
A.向Na2CO3和NaHCO3溶液中,滴入酚酞后溶液均变红,NaHCO3的颜色深
B.Na2CO3溶液中含有少量NaHCO3可用加热的方法除去
C.向等质量的Na2CO3和NaHCO3固体中加入足量稀盐酸,Na2CO3产生的气体较多
D.向盛有少量Na2CO3和NaHCO3的两支试管中各滴入几滴水,振荡后用温度计测量Na2CO3温度高于NaHCO3
E.热稳定性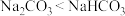
F.常温时水溶性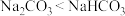
G.等浓度的溶液中滴入稀盐酸,放出气体的快慢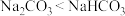
A.向Na2CO3和NaHCO3溶液中,滴入酚酞后溶液均变红,NaHCO3的颜色深
B.Na2CO3溶液中含有少量NaHCO3可用加热的方法除去
C.向等质量的Na2CO3和NaHCO3固体中加入足量稀盐酸,Na2CO3产生的气体较多
D.向盛有少量Na2CO3和NaHCO3的两支试管中各滴入几滴水,振荡后用温度计测量Na2CO3温度高于NaHCO3
E.热稳定性
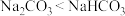
F.常温时水溶性
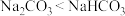
G.等浓度的溶液中滴入稀盐酸,放出气体的快慢
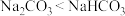
您最近一年使用:0次
3 . 阅读下面一段材料并回答问题。
 俗称纯碱,通常为白色粉末,易溶于水,热稳定性较强,但高温下也可以分解为
俗称纯碱,通常为白色粉末,易溶于水,热稳定性较强,但高温下也可以分解为  和
和  。
。

 有着广泛的用途。高温下可与石英砂
有着广泛的用途。高温下可与石英砂 反应生产玻璃。也可用于烟气脱硫,
反应生产玻璃。也可用于烟气脱硫, 水溶液吸收
水溶液吸收  ,再通入空气,最终可得到
,再通入空气,最终可得到  和
和 。在冶金工业中也可以与
。在冶金工业中也可以与  等金属硫化物反应,生成
等金属硫化物反应,生成 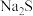 、
、 和
和  等金属氧化物。在食品工业、国防、医药等领域亦有广泛应用。
等金属氧化物。在食品工业、国防、医药等领域亦有广泛应用。
工业上有多种制备 的方法。我国化学家侯德榜先生提出了氨碱法制取
的方法。我国化学家侯德榜先生提出了氨碱法制取  和合成氨联合起来生产的工艺,可同时获得
和合成氨联合起来生产的工艺,可同时获得  和
和 两种物质,再煅烧
两种物质,再煅烧  获得
获得  ,原盐的利用率也得到了提升。侯氏制碱法对我国纯碱工业和国民经济发展做出了巨大贡献。
,原盐的利用率也得到了提升。侯氏制碱法对我国纯碱工业和国民经济发展做出了巨大贡献。
(1)根据 的性质可知它属于
的性质可知它属于___________ 类(填字母)。
a.酸 b.碱 c.盐
(2) 用于烟气脱硫发生反应的离子方程式是
用于烟气脱硫发生反应的离子方程式是___________ 。
(3)判断下列说法是否正确(填“对”或“错”)
a. 和
和  受热均易分解。
受热均易分解。___________
b. 与
与  的反应不是氧化还原反应。
的反应不是氧化还原反应。___________
c.侯氏制碱法除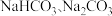 外还能获得
外还能获得  。
。___________
 俗称纯碱,通常为白色粉末,易溶于水,热稳定性较强,但高温下也可以分解为
俗称纯碱,通常为白色粉末,易溶于水,热稳定性较强,但高温下也可以分解为  和
和  。
。
 有着广泛的用途。高温下可与石英砂
有着广泛的用途。高温下可与石英砂 反应生产玻璃。也可用于烟气脱硫,
反应生产玻璃。也可用于烟气脱硫, 水溶液吸收
水溶液吸收  ,再通入空气,最终可得到
,再通入空气,最终可得到  和
和 。在冶金工业中也可以与
。在冶金工业中也可以与  等金属硫化物反应,生成
等金属硫化物反应,生成 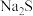 、
、 和
和  等金属氧化物。在食品工业、国防、医药等领域亦有广泛应用。
等金属氧化物。在食品工业、国防、医药等领域亦有广泛应用。工业上有多种制备
 的方法。我国化学家侯德榜先生提出了氨碱法制取
的方法。我国化学家侯德榜先生提出了氨碱法制取  和合成氨联合起来生产的工艺,可同时获得
和合成氨联合起来生产的工艺,可同时获得  和
和 两种物质,再煅烧
两种物质,再煅烧  获得
获得  ,原盐的利用率也得到了提升。侯氏制碱法对我国纯碱工业和国民经济发展做出了巨大贡献。
,原盐的利用率也得到了提升。侯氏制碱法对我国纯碱工业和国民经济发展做出了巨大贡献。(1)根据
 的性质可知它属于
的性质可知它属于a.酸 b.碱 c.盐
(2)
 用于烟气脱硫发生反应的离子方程式是
用于烟气脱硫发生反应的离子方程式是(3)判断下列说法是否正确(填“对”或“错”)
a.
 和
和  受热均易分解。
受热均易分解。b.
 与
与  的反应不是氧化还原反应。
的反应不是氧化还原反应。c.侯氏制碱法除
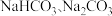 外还能获得
外还能获得  。
。
您最近一年使用:0次
4 . 对牙膏的探究要用到许多化学知识。下表列出了甲、乙、丙、丁四种牙膏中的摩擦剂,按要求填写下列空白。
(1)二氧化硅 中硅元素的化合价为
中硅元素的化合价为_____________ 。请根据用途推测二氧化硅在水中的溶解性_____________ (填“易溶”或“难溶”)。
(2) 既能与酸反应,又能与强碱溶液反应,所以
既能与酸反应,又能与强碱溶液反应,所以 具有
具有_____________ (填“酸性”、“碱性”或“两性”)。写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式_____________ 。
(3)已知反应; 。
。
_____________ 属于(填“一”、“二”或“三”)元酸。 属于
属于_____________ (填“正盐”或“酸式盐”)。
(4)牙膏中的摩擦剂碳酸钙可以用石灰石来制备。
某同学设计了一种实验室制备碳酸钙的实验方案,其流程图如下;
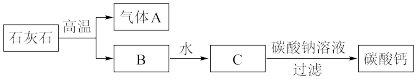
①上述过程中没有涉及的化学反应类型是_____________ (填字母序号)。
a.化合反应 b.分解反应 c.复分解反应 d.置换反应
②从化学反应的角度考虑,你认为可以用碳酸氢钠溶液代替碳酸钠溶液吗?_____________ (填“可以”或“不可以”),原因是_____________ 。
| 甲 | 乙 | 丙 | 丁 | |
| 摩擦剂 | 二氧化硅 | 氢氧化铝 | 磷酸氢钙 | 碳酸钙 |
| 化学式 |  |  |  |  |
(1)二氧化硅
 中硅元素的化合价为
中硅元素的化合价为(2)
 既能与酸反应,又能与强碱溶液反应,所以
既能与酸反应,又能与强碱溶液反应,所以 具有
具有 与
与 溶液反应的离子方程式
溶液反应的离子方程式(3)已知反应;
 。
。
 属于
属于(4)牙膏中的摩擦剂碳酸钙可以用石灰石来制备。
某同学设计了一种实验室制备碳酸钙的实验方案,其流程图如下;

①上述过程中没有涉及的化学反应类型是
a.化合反应 b.分解反应 c.复分解反应 d.置换反应
②从化学反应的角度考虑,你认为可以用碳酸氢钠溶液代替碳酸钠溶液吗?
您最近一年使用:0次
名校
5 . 碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题:
(1)碳酸氢钠俗称___________ ,其水溶液显___________ 性(填“酸”、“碱”或“中”)。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为___________ 。等质量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量:前者___________ (填“>”“<”或“=”)后者。
(3)用加热的方法除去碳酸钠固体中碳酸氢钠的反应的化学方程式为___________ 。
(1)碳酸氢钠俗称
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为
(3)用加热的方法除去碳酸钠固体中碳酸氢钠的反应的化学方程式为
您最近一年使用:0次
名校
6 . 某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
(1)KClO4中氯元素的化合价是___________ 。
(2)Fe2O3可处理产生的Na,反应为6Na+Fe2O3=3Na2O+ 2Fe,反应中Na做___________ (填“还原剂”或“氧化剂”)。
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式是___________ 。
(4)按如图所示装置实验,可得到“Na2CO3的热稳定性比NaHCO3强”的结论,证据是___________ 。
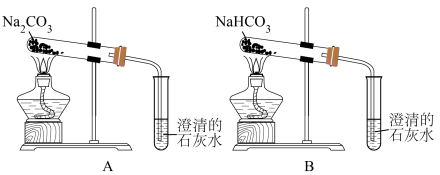
(1)KClO4中氯元素的化合价是
(2)Fe2O3可处理产生的Na,反应为6Na+Fe2O3=3Na2O+ 2Fe,反应中Na做
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式是
(4)按如图所示装置实验,可得到“Na2CO3的热稳定性比NaHCO3强”的结论,证据是

您最近一年使用:0次
7 . 某小组同学对比Na2CO3和NaHCO3的性质,进行了如下实验。
(1)向相同体积、相同浓度的Na2CO3和NaHCO3溶液中分别滴加0.1mol•L-1的盐酸,溶液pH变化如下。
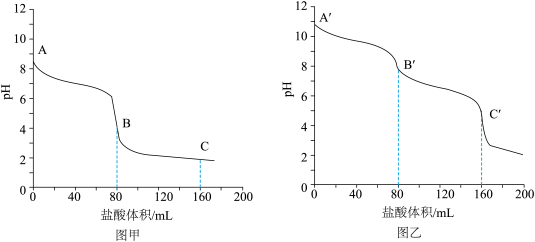
①图____ (填“甲”或“乙”)是NaHCO3的滴定曲线。
②A´—B´发生反应的离子方程式为___________ 。
③下列说法正确的是_________ (填序号)。
a.Na2CO3和NaHCO3溶液中加入饱和石灰水,均有沉淀生成
b.A和A´对应溶液中:c(Na+)+c(H+)=2c( )+c(
)+c( )+c(OH-)
)+c(OH-)
c.B和B´对应溶液中:水的电离程度前者大
d.C和C´对应溶液中:NaCl的物质的量相等
(2)向1mol•L-1的Na2CO3和NaHCO3溶液中分别滴加少量FeCl2溶液,均产生白色沉淀。
查阅资料:i.1mol•L-1的NaHCO3溶液中,c( )=1×10-2mol•L-1,c(OH-)=2×10-6mol•L-1
)=1×10-2mol•L-1,c(OH-)=2×10-6mol•L-1
ii.25℃时,Ksp(FeCO3)=3.2×10-11,Ksp[Fe(OH)2]=5.0×10-17
通过计算判断NaHCO3与FeCl2反应产生的沉淀是FeCO3,还是Fe(OH)2?_______ (要求有计算过程)。
(1)向相同体积、相同浓度的Na2CO3和NaHCO3溶液中分别滴加0.1mol•L-1的盐酸,溶液pH变化如下。

①图
②A´—B´发生反应的离子方程式为
③下列说法正确的是
a.Na2CO3和NaHCO3溶液中加入饱和石灰水,均有沉淀生成
b.A和A´对应溶液中:c(Na+)+c(H+)=2c(
 )+c(
)+c( )+c(OH-)
)+c(OH-)c.B和B´对应溶液中:水的电离程度前者大
d.C和C´对应溶液中:NaCl的物质的量相等
(2)向1mol•L-1的Na2CO3和NaHCO3溶液中分别滴加少量FeCl2溶液,均产生白色沉淀。
查阅资料:i.1mol•L-1的NaHCO3溶液中,c(
 )=1×10-2mol•L-1,c(OH-)=2×10-6mol•L-1
)=1×10-2mol•L-1,c(OH-)=2×10-6mol•L-1ii.25℃时,Ksp(FeCO3)=3.2×10-11,Ksp[Fe(OH)2]=5.0×10-17
通过计算判断NaHCO3与FeCl2反应产生的沉淀是FeCO3,还是Fe(OH)2?
您最近一年使用:0次
8 . 海洋是一个巨大的化学资源宝库,其中钠元素是海洋中含量较高的元素。
(1)已知在太阳光作用下,绿色植物体内的叶绿素能将水、CO2转化为葡萄糖。海水吸收CO2并进行碳循环的原理示意图如下:
(2)某同学欲用碳酸钠晶体(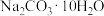 )配制220mL1mol/L的Na2CO3溶液。
)配制220mL1mol/L的Na2CO3溶液。
①所需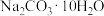 的质量为
的质量为___________ g。
②实验中除需要托盘天平(带砝码)、药匙、量筒、烧杯、玻璃棒、试剂瓶外,还需要的玻璃仪器有___________ 。
③配制溶液时正确的操作顺序是:_________ (填字母,下同)
计算→称量→___________→___________→___________→___________→___________→装瓶贴标签。
a.转移 b.定容 c.摇匀 d.洗涤 e.溶解
④下列实验操作会使配制溶液浓度偏高的是___________ 。
A.容量瓶清洗后,未经过干燥处理
B.定容时,俯视刻度线
C.定容后倒转容量瓶几次,发现液面最低点低于刻度线,再补加几滴水至刻度线
D.所用碳酸钠晶体失去结晶水
(1)已知在太阳光作用下,绿色植物体内的叶绿素能将水、CO2转化为葡萄糖。海水吸收CO2并进行碳循环的原理示意图如下:
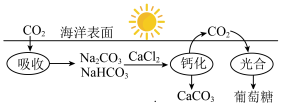
| A.CO2是碱性氧化物 |
| B.等质量的NaHCO3和Na2CO3分别与足量的盐酸反应,前者产生的二氧化碳气体较多 |
C.碳酸氢钠的电离方程式为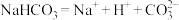 |
| D.该循环过程中未涉及氧化还原反应 |
(2)某同学欲用碳酸钠晶体(
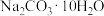 )配制220mL1mol/L的Na2CO3溶液。
)配制220mL1mol/L的Na2CO3溶液。①所需
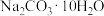 的质量为
的质量为②实验中除需要托盘天平(带砝码)、药匙、量筒、烧杯、玻璃棒、试剂瓶外,还需要的玻璃仪器有
③配制溶液时正确的操作顺序是:
计算→称量→___________→___________→___________→___________→___________→装瓶贴标签。
a.转移 b.定容 c.摇匀 d.洗涤 e.溶解
④下列实验操作会使配制溶液浓度偏高的是
A.容量瓶清洗后,未经过干燥处理
B.定容时,俯视刻度线
C.定容后倒转容量瓶几次,发现液面最低点低于刻度线,再补加几滴水至刻度线
D.所用碳酸钠晶体失去结晶水
您最近一年使用:0次
2024-01-25更新
|
58次组卷
|
2卷引用:陕西省汉中市汉台区2023-2024学年高一上学期1月期末化学试题
名校
9 . NaHCO3溶液不仅在受热时能分解放出CO2,而且在室温时亦能分解。
请回答下列问题:
(1)25℃时,1.0 mol·L-1NaHCO3溶液pH随NaHCO3分解率的变化曲线如图所示。___________ 。
②等物质的量浓度的Na2CO3和NaHCO3溶液相比,前者碱性___________ (填“强”或“弱”)。
③0.5 mol·L-1 Na2CO3溶液的pH=___________ 。
(2)利用如图所示实验装置探究NaHCO3溶液作为植物光合作用的碳源。___________ 。
②一种求NaHCO3的分解率方法如下:将充分反应后C瓶中的沉淀过滤掉,滤液转入锥形瓶中,再滴入2.0 mol·L-1盐酸30 mL,恰好完全反应。则NaHCO3的分解率为___________ 。
③实验结果偏低的原因是___________ 。
请回答下列问题:
(1)25℃时,1.0 mol·L-1NaHCO3溶液pH随NaHCO3分解率的变化曲线如图所示。
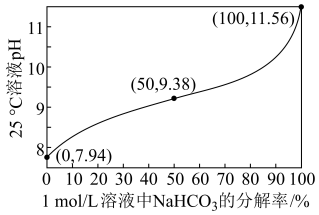
②等物质的量浓度的Na2CO3和NaHCO3溶液相比,前者碱性
③0.5 mol·L-1 Na2CO3溶液的pH=
(2)利用如图所示实验装置探究NaHCO3溶液作为植物光合作用的碳源。

②一种求NaHCO3的分解率方法如下:将充分反应后C瓶中的沉淀过滤掉,滤液转入锥形瓶中,再滴入2.0 mol·L-1盐酸30 mL,恰好完全反应。则NaHCO3的分解率为
③实验结果偏低的原因是
您最近一年使用:0次
2024-01-17更新
|
121次组卷
|
2卷引用:四川省绵阳市东辰学校2022-2023学年高一上学期期末模拟化学试卷
名校
10 . 回答下列问题。
I.纯碱 和小苏打
和小苏打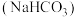 都是白色晶体,在日常生活中都可以找到。
都是白色晶体,在日常生活中都可以找到。
(1)若要在家中将它们区分开来,下列方法中可行的是___________。
(2) 溶液和
溶液和 溶液中都含有
溶液中都含有 、
、 、
、 、
、 、
、 、
、 、
、 写出一个用浓度表示这些微粒之间的电荷守恒的关系式
写出一个用浓度表示这些微粒之间的电荷守恒的关系式___________ 。
II.在两个相同的特制容器中分别加入 和
和 溶液,再分别用
溶液,再分别用 盐酸滴定,利用
盐酸滴定,利用 计和压力传感器检测,得到如下曲线:
计和压力传感器检测,得到如下曲线:
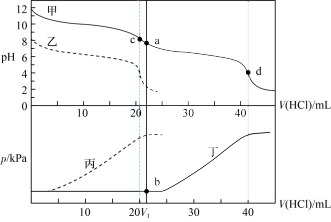
(3)甲、乙两条线中表示向 溶液中滴加盐酸的是
溶液中滴加盐酸的是___________ ,理由是___________ 。丙、丁两条线中表示向 溶液中滴加盐酸的是
溶液中滴加盐酸的是___________ ,理由是___________ 。
(4)当滴加盐酸的体积为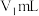 时(a点、b点),所发生的反应用化学方程式表示为
时(a点、b点),所发生的反应用化学方程式表示为___________ 。
(5)根据 图分析:
图分析:
①滴定时c点可用___________ 作指示剂指示滴定终点。
A.甲基橙 B.石蕊 C.酚酞
②滴定时d点可用___________ 作指示剂指示滴定终点。
A.甲基橙 B.石蕊 C.酚酞
I.纯碱
 和小苏打
和小苏打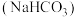 都是白色晶体,在日常生活中都可以找到。
都是白色晶体,在日常生活中都可以找到。(1)若要在家中将它们区分开来,下列方法中可行的是___________。
| A.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度 |
| B.分别用干净铁丝蘸取样品在煤气灶的火焰上灼烧,观察火焰颜色 |
| C.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀 |
| D.分别放在炒锅中加热,观察是否有残留物 |
(2)
 溶液和
溶液和 溶液中都含有
溶液中都含有 、
、 、
、 、
、 、
、 、
、 、
、 写出一个用浓度表示这些微粒之间的电荷守恒的关系式
写出一个用浓度表示这些微粒之间的电荷守恒的关系式II.在两个相同的特制容器中分别加入
 和
和 溶液,再分别用
溶液,再分别用 盐酸滴定,利用
盐酸滴定,利用 计和压力传感器检测,得到如下曲线:
计和压力传感器检测,得到如下曲线:
(3)甲、乙两条线中表示向
 溶液中滴加盐酸的是
溶液中滴加盐酸的是 溶液中滴加盐酸的是
溶液中滴加盐酸的是(4)当滴加盐酸的体积为
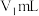 时(a点、b点),所发生的反应用化学方程式表示为
时(a点、b点),所发生的反应用化学方程式表示为(5)根据
 图分析:
图分析:①滴定时c点可用
A.甲基橙 B.石蕊 C.酚酞
②滴定时d点可用
A.甲基橙 B.石蕊 C.酚酞
您最近一年使用:0次



