1 . 铁及其化合物用途非常广泛。
(1)已知赤铁矿还原冶炼时是逐级进行的,已知:
(a) 3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g)
2Fe3O4(s)+CO2(g)  H = a kJ·mol-1
H = a kJ·mol-1
(b) Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)  H =b kJ·mol-1
H =b kJ·mol-1
(c) Fe3O4(s)+CO(g) 3FeO(s)+CO2 (g)
3FeO(s)+CO2 (g)  H = c kJ·mol-1
H = c kJ·mol-1
①上述反应(a)平衡常数表达式为K=___________________ 。
②反应FeO(s)+CO(g) Fe(s)+CO2(g)
Fe(s)+CO2(g)  H =
H =__________ kJ·mol-1(用含a、b、c的代数式表示)。
(2)用类似冶炼铝的方法, 在600~1000℃时电解熔融的Fe2O3冶炼铁(装置示意图如图),该法除消耗能量较少外,另一最突出的优点是__________________________________ ;电解时阳极发生的电极反应为____________ 。
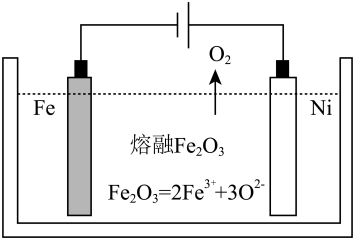
(3)生铁在自然界中可发生析氢腐蚀和吸氧腐蚀,析氢腐蚀的负极的电极反应式为_________ ;如图所示,纯铁处于a、b、c三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填字母)_____________ 。

(1)已知赤铁矿还原冶炼时是逐级进行的,已知:
(a) 3Fe2O3(s)+CO(g)
 2Fe3O4(s)+CO2(g)
2Fe3O4(s)+CO2(g)  H = a kJ·mol-1
H = a kJ·mol-1(b) Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)  H =b kJ·mol-1
H =b kJ·mol-1(c) Fe3O4(s)+CO(g)
 3FeO(s)+CO2 (g)
3FeO(s)+CO2 (g)  H = c kJ·mol-1
H = c kJ·mol-1①上述反应(a)平衡常数表达式为K=
②反应FeO(s)+CO(g)
 Fe(s)+CO2(g)
Fe(s)+CO2(g)  H =
H =(2)用类似冶炼铝的方法, 在600~1000℃时电解熔融的Fe2O3冶炼铁(装置示意图如图),该法除消耗能量较少外,另一最突出的优点是

(3)生铁在自然界中可发生析氢腐蚀和吸氧腐蚀,析氢腐蚀的负极的电极反应式为

您最近一年使用:0次
2 . 天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)①已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ∆H1;
CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2;
2CO(g)+O2(g)=2CO2(g) ∆H3;
则CO2(g)+CH4(g)=2CO(g)+2H2(g)的∆H=___________ 。
②天然气中的少量H2S杂质常用氨水吸收,产物为NH4HS。向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式___________ 。
(2)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g) 2CO(g)+2H2(g)。该反应的平衡常数表达式为
2CO(g)+2H2(g)。该反应的平衡常数表达式为___________ ;在密闭容器中通入物质的量浓度均为0.1 mol/L的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图20-1所示。则压强P1___________ P2(填“大于”或“小于");压强为P2时,在Y点:v(正)___________ v(逆)(填“大于”“小于”或“等于”)。
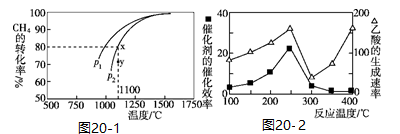
(3)CH4和CO2合成乙酸,某工业生产中以CuAlO2为合成的催化剂,在不同温度下催化剂的催化效率与乙酸的生成速率如图20-2所示。250℃~300℃时,温度升高而乙酸的生成速率降低的原因是___________ ,将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为___________ 。
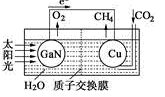
(4)科学家用氮化镓材料与铜组装如下图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式___________ 。
(1)①已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ∆H1;
CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2;
2CO(g)+O2(g)=2CO2(g) ∆H3;
则CO2(g)+CH4(g)=2CO(g)+2H2(g)的∆H=
②天然气中的少量H2S杂质常用氨水吸收,产物为NH4HS。向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式
(2)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)
 2CO(g)+2H2(g)。该反应的平衡常数表达式为
2CO(g)+2H2(g)。该反应的平衡常数表达式为
(3)CH4和CO2合成乙酸,某工业生产中以CuAlO2为合成的催化剂,在不同温度下催化剂的催化效率与乙酸的生成速率如图20-2所示。250℃~300℃时,温度升高而乙酸的生成速率降低的原因是
(4)科学家用氮化镓材料与铜组装如下图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式

您最近一年使用:0次
解题方法
3 . 金属镁是一种活泼的常见金属,用途广泛。在25℃,101kPa条件下。有关物质的能量如下表所示(X2表示任意卤素单质):
回答下列问题:
(1)镁与卤素单质的反应属于_______ (“放热”或“吸热”)反应。
(2)镁与卤素单质反应的生成物中,热稳定性最差的是_________ 。
(3)镁与液溴反应的热化学方程式为________ 。
(4)反应F2(g)+MgCl2(s)=MgF2(s)+Cl2(g)的△H=_______ kJ·mol-1。
物质 | Mg | X2 | MgF2 | MgCl2 | MgBr2 | MgI2 |
能量/kJ‧mol-1 | 0 | 0 | -1124 | -641.3 | -524 | -364 |
回答下列问题:
(1)镁与卤素单质的反应属于
(2)镁与卤素单质反应的生成物中,热稳定性最差的是
(3)镁与液溴反应的热化学方程式为
(4)反应F2(g)+MgCl2(s)=MgF2(s)+Cl2(g)的△H=
您最近一年使用:0次
2020-07-31更新
|
65次组卷
|
2卷引用:江苏省南通市海安县2020-2021学年高二上学期第一次月考化学试题
4 . 氮和氮的化合物在工农业生产、国防和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题:
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂,可由Cl2和NO在一定条件下通过以下反应制得:2NO+Cl2=2ClNO,已知几种化学键的键能数据如下表所示:
请根据表中数据计算:2NO(g)+Cl2(g)=2ClNO(g)△H=___ kJ•mol-1。
(2)温度一定时,在一个体积为1L的密闭容器中通入2molNO和1molCl2,10min时ClNO体积占气体总体积40%(气体的“体积分数”即“物质的量分数”),则反应开始到10min内NO的平均反应速率:v(NO)=___ mol·L-1·min-1
(3)以NH3为还原剂在脱硝装置中消除烟气中的氮氧化物,
主反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) △H1
副反应:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1267.1kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-907.3kJ/mol
①△H1=___ 。
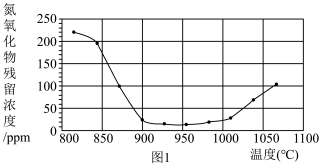
②将烟气按一定的流速通过脱硝装置,测得出口NO的浓度与温度的关系如图1,试分析脱硝的适宜温度是___ (填序号)
a.<850℃ b.900~1000℃ c.>1050 ℃
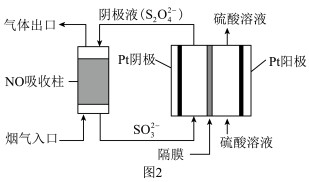
(4)以连二亚硫酸盐(S2O42-)为还原剂脱除烟气中的NO,并通过电解再生,装置如图2。阴极的电极反应式为___ 。
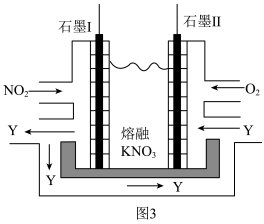
(5)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,装置如图3所示,电池工作时,NO2转变成绿色硝化剂Y(N2O5),可循环使用,则石墨Ⅰ附近发生的电极反应式为:___ 。
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂,可由Cl2和NO在一定条件下通过以下反应制得:2NO+Cl2=2ClNO,已知几种化学键的键能数据如下表所示:
| 化学键 | Cl-Cl | Cl-N | N=O | N=O(NO) |
| 键能(kJ·mol-1) | 243 | a | 607 | 630 |
(2)温度一定时,在一个体积为1L的密闭容器中通入2molNO和1molCl2,10min时ClNO体积占气体总体积40%(气体的“体积分数”即“物质的量分数”),则反应开始到10min内NO的平均反应速率:v(NO)=
(3)以NH3为还原剂在脱硝装置中消除烟气中的氮氧化物,
主反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) △H1
副反应:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H2=-1267.1kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-907.3kJ/mol
①△H1=
②将烟气按一定的流速通过脱硝装置,测得出口NO的浓度与温度的关系如图1,试分析脱硝的适宜温度是
a.<850℃ b.900~1000℃ c.>1050 ℃

(4)以连二亚硫酸盐(S2O42-)为还原剂脱除烟气中的NO,并通过电解再生,装置如图2。阴极的电极反应式为

(5)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,装置如图3所示,电池工作时,NO2转变成绿色硝化剂Y(N2O5),可循环使用,则石墨Ⅰ附近发生的电极反应式为:

您最近一年使用:0次
5 . 天然气既是高效洁净的能源,又是重要的化工原料,在生产、生活中用途广泛。
(1)已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则该条件下反应2CH4(g)+3O2(g)=2CO(g)+4H2O(l)的ΔH=___ kJ·mol-1。
(2)甲烷可以消除氮氧化物污染。如:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)。下列措施能够使该反应速率加快的是
N2(g)+CO2(g)+2H2O(g)。下列措施能够使该反应速率加快的是___ 。
a.使用催化剂 b.降低温度 c.及时分离水
(3)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:
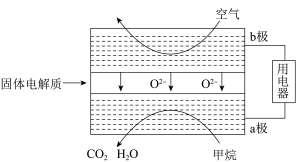
①外电路电子移动方向:___ 。(填“a极到b极”或“b极到a极”)。
②a极电极反应式为___ 。
③若燃料电池消耗的空气在标准状况下的体积是22.4L(假设空气中O2体积分数为20%),则理论上消耗甲烷___ mol。
(1)已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则该条件下反应2CH4(g)+3O2(g)=2CO(g)+4H2O(l)的ΔH=
(2)甲烷可以消除氮氧化物污染。如:CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g)。下列措施能够使该反应速率加快的是
N2(g)+CO2(g)+2H2O(g)。下列措施能够使该反应速率加快的是a.使用催化剂 b.降低温度 c.及时分离水
(3)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:

①外电路电子移动方向:
②a极电极反应式为
③若燃料电池消耗的空气在标准状况下的体积是22.4L(假设空气中O2体积分数为20%),则理论上消耗甲烷
您最近一年使用:0次
6 . 锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:①2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g)△H1=﹣930kJ•mol-1
②2C(s)+O2(g)=2CO(g)△H2=﹣221kJ•mol-1
③ZnO(s)+CO(g)=Zn(g)+CO2(g)△H3=+198kJ•mol-1
(1)反应ZnS(s)+C(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g)的△H4=____ kJ•mol-1。
反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是
CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是___ 。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正=v(H2O)逆d.容器中混合气体的密度不再改变
(2)亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g) 2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
①图中T1、T2的关系为:T1___ T2(填“>”、“<”或“=”);
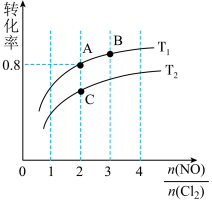
②图中纵坐标为物质___ 的转化率;
③图中A、B、C三点对应的NOCl体积分数最大的是____ (填“A”、“B”、或“C”);
④若容器容积为2L,则B点的平衡常数的值为____ 。
②2C(s)+O2(g)=2CO(g)△H2=﹣221kJ•mol-1
③ZnO(s)+CO(g)=Zn(g)+CO2(g)△H3=+198kJ•mol-1
(1)反应ZnS(s)+C(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g)的△H4=
反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是
CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正=v(H2O)逆d.容器中混合气体的密度不再改变
(2)亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g)
 2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:①图中T1、T2的关系为:T1

②图中纵坐标为物质
③图中A、B、C三点对应的NOCl体积分数最大的是
④若容器容积为2L,则B点的平衡常数的值为
您最近一年使用:0次
名校
7 . 锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) H1=-930 kJ·mol-1
H1=-930 kJ·mol-1
2C(s) + O2(g) = 2CO(g) H2=-221 kJ·mol-1
H2=-221 kJ·mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) H3=198 kJ·mol-1
H3=198 kJ·mol-1
(1)反应ZnS(s) + C(s) + 2O2(g) = Zn(g) + CO2(g) + SO2(g)的 H4=
H4=________ kJ·mol-1。反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:
该反应在一定条件下能自发进行的原因是_______ ;若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是________ 。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正 = v(H2O)逆 d.容器中混合气体的密度不再改变
(2)硫酸锌可广泛用作印染媒染剂和木材防腐剂。ZnSO4受热分解过程中各物质物质的量随温度变化关系如图所示。

①写出700℃~980℃时发生反应的化学方程式:______________________________________________ , 物质B的化学式是________________ 。
② 硫酸锌分解生成的SO2经下图中的两个循环可分别得到S和H2SO4。写出循环I中反应2的化学方程式:_____________________________________________ ;循环II中电解过程阳极反应式是_________________________________________ 。

2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g)
 H1=-930 kJ·mol-1
H1=-930 kJ·mol-12C(s) + O2(g) = 2CO(g)
 H2=-221 kJ·mol-1
H2=-221 kJ·mol-1ZnO(s) + CO(g) = Zn(g) + CO2(g)
 H3=198 kJ·mol-1
H3=198 kJ·mol-1(1)反应ZnS(s) + C(s) + 2O2(g) = Zn(g) + CO2(g) + SO2(g)的
 H4=
H4=
该反应在一定条件下能自发进行的原因是
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正 = v(H2O)逆 d.容器中混合气体的密度不再改变
(2)硫酸锌可广泛用作印染媒染剂和木材防腐剂。ZnSO4受热分解过程中各物质物质的量随温度变化关系如图所示。

①写出700℃~980℃时发生反应的化学方程式:
② 硫酸锌分解生成的SO2经下图中的两个循环可分别得到S和H2SO4。写出循环I中反应2的化学方程式:

您最近一年使用:0次
2018-01-15更新
|
232次组卷
|
2卷引用:2016届江苏省南通市高三下学期第一次调研测试化学试卷
解题方法
8 . 金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在Z-X-X-K]密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3 (s) + 3H2 (g)  W (s) + 3H2O (g)
W (s) + 3H2O (g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为___________________________ 。
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为____________ 。
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:

第一阶段反应的化学方程式为___________________________ ;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为____________________________________ 。
(4)已知:温度过高时,WO2 (s)转变为WO2 (g);
WO2 (s) + 2H2 (g) W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
WO2 (g) + 2H2 W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
则WO2 (s) WO2 (g) 的ΔH =
WO2 (g) 的ΔH = ______________________ 。
 W (s) + 3H2O (g)
W (s) + 3H2O (g) 请回答下列问题:
(1)上述反应的化学平衡常数表达式为
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:

第一阶段反应的化学方程式为
(4)已知:温度过高时,WO2 (s)转变为WO2 (g);
WO2 (s) + 2H2 (g)
 W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1 WO2 (g) + 2H2
 W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1 则WO2 (s)
 WO2 (g) 的ΔH =
WO2 (g) 的ΔH =
您最近一年使用:0次
9 . I.还原剂还原法、光催化氧化法、电化学吸收法是减少氮氧化物排放的有效措施。
(1)利用炭粉可以将氮氧化物还原。
已知:N2(g)+O2(g)=2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
反应:C(s)+2NO(g)=CO2(g)+N2(g) ΔH=_____ kJ·mol-1。
(2)TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,OH能将NO、NO2氧化,如下图所示,OH与NO2的反应为NO2+OH=HNO3。
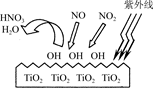
写出OH与NO反应的化学方程式:_____________ 。
Ⅱ.甲醇、乙醇是重要的有机化工原料,有着重要的用途和应用前景。
(3)若在恒温恒容的容器内进行反应CO(g)+2H2(g) CH3OH(g),则可用来判断该反应达到平衡状态的标志有
CH3OH(g),则可用来判断该反应达到平衡状态的标志有___ (填字母)。
A.H2百分含量保持不变
B.容器中气体的压强保持不变
C.容器中混合气体的密度保持不变
D.2v(H2)正= v(CH3OH )逆
(4)CO(g)+2H2(g) CH3OH(g) 其平衡常数表达式为K=
CH3OH(g) 其平衡常数表达式为K=___________ 。该反应的平衡常数K 随温度T 的变化如图所示,

则该反应的 △H___ 0。(填“>”、“<”或“=”)。已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将___ (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
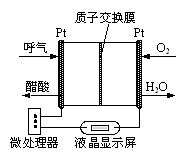
(5)下图所示是一种酸性燃料电池乙醇检测仪,具有自动吹气流量侦测与控制的功能,适合进行现场乙醇检测。负极反应式为_________ 。
(1)利用炭粉可以将氮氧化物还原。
已知:N2(g)+O2(g)=2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
反应:C(s)+2NO(g)=CO2(g)+N2(g) ΔH=
(2)TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,OH能将NO、NO2氧化,如下图所示,OH与NO2的反应为NO2+OH=HNO3。

写出OH与NO反应的化学方程式:
Ⅱ.甲醇、乙醇是重要的有机化工原料,有着重要的用途和应用前景。
(3)若在恒温恒容的容器内进行反应CO(g)+2H2(g)
 CH3OH(g),则可用来判断该反应达到平衡状态的标志有
CH3OH(g),则可用来判断该反应达到平衡状态的标志有A.H2百分含量保持不变
B.容器中气体的压强保持不变
C.容器中混合气体的密度保持不变
D.2v(H2)正= v(CH3OH )逆
(4)CO(g)+2H2(g)
 CH3OH(g) 其平衡常数表达式为K=
CH3OH(g) 其平衡常数表达式为K=
则该反应的 △H
(5)下图所示是一种酸性燃料电池乙醇检测仪,具有自动吹气流量侦测与控制的功能,适合进行现场乙醇检测。负极反应式为

您最近一年使用:0次
解题方法
10 . 利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:
SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) △H1=a kJ·mol-1
NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) △H2=b kJ·mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) △H3=c kJ·mol-1
⑴反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的 △H=_____ kJ·mol-1。
⑵空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是_______ 。
⑶以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用。反应的离子方程式为CaSO4(s)+CO32—(aq)SO42—(aq)+CaCO3(s),该反应的平衡常数 K=____ 。 [已知Ksp(CaCO3)=2.9×10-9,Ksp(CaSO4)=9.1×10-6 ]
⑷(NH4)2SO4在工农业生产中有多种用途。
①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气。该反应的化学方程式为________ 。
②研究硫酸铵的分解机理有利于对磷石膏的开发。在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示。写出该条件下硫酸铵分解的化学方程式,并用单线桥标出电子转移的方向及数目:_____________ 。
③(NH4)2SO4是工业制备K2SO4的重要原料。根据图乙中相关物质的溶解度曲线,简述工业上制备K2SO4晶体的设计思路:___________ 。
SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) △H1=a kJ·mol-1
NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) △H2=b kJ·mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) △H3=c kJ·mol-1
⑴反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的 △H=
⑵空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是

⑶以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用。反应的离子方程式为CaSO4(s)+CO32—(aq)SO42—(aq)+CaCO3(s),该反应的平衡常数 K=
⑷(NH4)2SO4在工农业生产中有多种用途。
①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气。该反应的化学方程式为

②研究硫酸铵的分解机理有利于对磷石膏的开发。在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示。写出该条件下硫酸铵分解的化学方程式,并用单线桥标出电子转移的方向及数目:
③(NH4)2SO4是工业制备K2SO4的重要原料。根据图乙中相关物质的溶解度曲线,简述工业上制备K2SO4晶体的设计思路:
您最近一年使用:0次
2017-03-28更新
|
156次组卷
|
3卷引用:2016届江苏省苏中三市高三第二次调研测试化学试卷



