解题方法
1 .  的氯化、溴化反应势能图及产物选择性如下图,下列叙述错误的是
的氯化、溴化反应势能图及产物选择性如下图,下列叙述错误的是
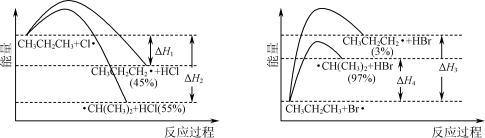
 的氯化、溴化反应势能图及产物选择性如下图,下列叙述错误的是
的氯化、溴化反应势能图及产物选择性如下图,下列叙述错误的是
A.丙烷中仲氢 比伯氢 比伯氢 活性强 活性强 |
B.升高温度 与 与 反应速率加快、与 反应速率加快、与 反应速率减慢 反应速率减慢 |
C.以 为原料合成2-丙醇时,溴化反应比氯化反应产率更高 为原料合成2-丙醇时,溴化反应比氯化反应产率更高 |
D. 和 和 的键能差=△H1-△H3 的键能差=△H1-△H3 |
您最近一年使用:0次
2 . 化学反应既有物质变化,又有能量变化。能量变化通常以热、电、光等形式表现出来。
(1)相同温度下,相同质量的单质硫分别在足量空气中和足量纯氧中燃烧,放出的热量分别为a kJ和b kJ,则a_______ b(填“>”、“=”或“<”)。
(2)为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:
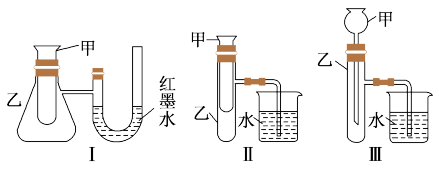
①上述装置中,不能证明“锌和稀硫酸反应是吸热反应还是放热反应”的是_______ (填序号)。
②某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡晶体与氯化铵固体搅拌反应,U形管中可观察到的现象是_______ ,化学反应方程式为_______ 。
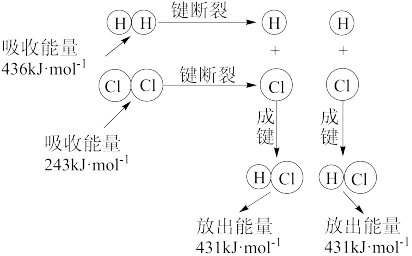
(3)在25℃、101kPa的条件下,断裂1mol H-H键吸收436 kJ能量,断裂1 mol Cl-Cl键吸收243 kJ能量,形成1mol H-Cl键放出431 kJ能量。该条件下反应H2+Cl2=2HCl中的能量变化可用下图表示,则对应的热化学方程式为_______ 。
(4)已知:CH4、H2的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1,则CO2和H2反应生成CH4和液态H2O的热化学方程式是_______ 。
(5)铅酸蓄电池是典型的可充电电池,它的正、负极格板是惰性材料,电池总反应式为:2PbSO4+2H2O Pb+PbO2+2H2SO4。放电时正极的电极反应式为
Pb+PbO2+2H2SO4。放电时正极的电极反应式为_______ ;室温下,若将铅酸电池作为电解饱和食盐水装置的电源,假设饱和食盐水体积为500mL且电解过程中溶液体积不变,当溶液pH=13时,铅酸电池负极质量将增加_______ g。
(1)相同温度下,相同质量的单质硫分别在足量空气中和足量纯氧中燃烧,放出的热量分别为a kJ和b kJ,则a
(2)为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:

①上述装置中,不能证明“锌和稀硫酸反应是吸热反应还是放热反应”的是
②某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡晶体与氯化铵固体搅拌反应,U形管中可观察到的现象是
(3)在25℃、101kPa的条件下,断裂1mol H-H键吸收436 kJ能量,断裂1 mol Cl-Cl键吸收243 kJ能量,形成1mol H-Cl键放出431 kJ能量。该条件下反应H2+Cl2=2HCl中的能量变化可用下图表示,则对应的热化学方程式为

(4)已知:CH4、H2的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1,则CO2和H2反应生成CH4和液态H2O的热化学方程式是
(5)铅酸蓄电池是典型的可充电电池,它的正、负极格板是惰性材料,电池总反应式为:2PbSO4+2H2O
 Pb+PbO2+2H2SO4。放电时正极的电极反应式为
Pb+PbO2+2H2SO4。放电时正极的电极反应式为
您最近一年使用:0次
名校
3 . 研究高效催化剂是解决汽车尾气中的 NO和 CO 对大气污染的重要途径。
(1)已知:C(s)+O2(g)=CO2(g)ΔH1=-393.0kJ/mol C(s)+ O2(g)=CO(g)ΔH2=-110.0kJ/mol N2(g)+O2(g)=2NO(g)ΔH3=+180.0kJ/mol则汽车尾气的催化转化反应 2NO(g)+2CO(g)=N2(g)+2CO2(g)的ΔH=
O2(g)=CO(g)ΔH2=-110.0kJ/mol N2(g)+O2(g)=2NO(g)ΔH3=+180.0kJ/mol则汽车尾气的催化转化反应 2NO(g)+2CO(g)=N2(g)+2CO2(g)的ΔH=___________ kJ/mol。
(2)400℃时,在分别装有催化剂A 和B 的两个容积为 2L 的刚性密闭容器中,各充入物质的量均为 n mol的NO和CO发生上述反应。通过测定容器内总压强随时间变化来探究催化剂对反应速率的影响,数据如表:
①由表可以判断催化剂___________ (填“A”或“B”)的效果更好。
②容器中 CO 的平衡转化率为___________ 。400℃时,用压强表示的平衡常数 Kp=___________ (kPa-1)
③汽车尾气排气管中使用催化剂可以提高污染物转化率,其原因是___________ 。
(3)为研究气缸中 NO 的生成,在体积可变的恒压密闭容器中,高温下充入物质的量均为 1mol 的氮气和氧气,发生反应N2(g)+O2(g)⇌2NO(g)。
①下列说法能表明该反应已经达到平衡状态的是___________ (填序号)。
A.2v正(O2)=v逆(NO) B.混合气体的平均相对分子质量不变
C.c(N2):c(O2)=1 D.容器内气体的密度不再发生变化
②为减小平衡混合气中 NO 的体积分数,可采取的措施是___________ 。(填升高温度或降低温度)
(4)对于气缸中 NO 的生成,化学家提出了如下反应历程:第一步O2⇌2O慢反应,第 二 步O+N2⇌NO+N 较快平衡,第三步N+O2⇌NO+O快速平衡;下列说法正确的是___________ (填标号)。
A.N、O原子均为该反应的催化剂 B.第一步反应不从 N2 分解开始,是因为N2比O2稳定
C.三步反应中第一步反应活化能最小 D.三步反应的速率都随温度升高而增大
(1)已知:C(s)+O2(g)=CO2(g)ΔH1=-393.0kJ/mol C(s)+
 O2(g)=CO(g)ΔH2=-110.0kJ/mol N2(g)+O2(g)=2NO(g)ΔH3=+180.0kJ/mol则汽车尾气的催化转化反应 2NO(g)+2CO(g)=N2(g)+2CO2(g)的ΔH=
O2(g)=CO(g)ΔH2=-110.0kJ/mol N2(g)+O2(g)=2NO(g)ΔH3=+180.0kJ/mol则汽车尾气的催化转化反应 2NO(g)+2CO(g)=N2(g)+2CO2(g)的ΔH=(2)400℃时,在分别装有催化剂A 和B 的两个容积为 2L 的刚性密闭容器中,各充入物质的量均为 n mol的NO和CO发生上述反应。通过测定容器内总压强随时间变化来探究催化剂对反应速率的影响,数据如表:
| 时间/min | 0 | 10 | 20 | 30 | ∞ |
| A 容器内压强/kPa | 100.0 | 90.0 | 85.0 | 80.0 | 80.0 |
| B 容器内压强/kPa | 100.0 | 95.0 | 90.0 | 85.0 | 80.0 |
①由表可以判断催化剂
②容器中 CO 的平衡转化率为
③汽车尾气排气管中使用催化剂可以提高污染物转化率,其原因是
(3)为研究气缸中 NO 的生成,在体积可变的恒压密闭容器中,高温下充入物质的量均为 1mol 的氮气和氧气,发生反应N2(g)+O2(g)⇌2NO(g)。
①下列说法能表明该反应已经达到平衡状态的是
A.2v正(O2)=v逆(NO) B.混合气体的平均相对分子质量不变
C.c(N2):c(O2)=1 D.容器内气体的密度不再发生变化
②为减小平衡混合气中 NO 的体积分数,可采取的措施是
(4)对于气缸中 NO 的生成,化学家提出了如下反应历程:第一步O2⇌2O慢反应,第 二 步O+N2⇌NO+N 较快平衡,第三步N+O2⇌NO+O快速平衡;下列说法正确的是
A.N、O原子均为该反应的催化剂 B.第一步反应不从 N2 分解开始,是因为N2比O2稳定
C.三步反应中第一步反应活化能最小 D.三步反应的速率都随温度升高而增大
您最近一年使用:0次
2020-12-27更新
|
109次组卷
|
2卷引用:江苏省泰州中学2021-2022学年高二下学期期初质量检测化学试卷
名校
4 . 设NA为阿伏加德罗常数的值。已知反应:
(1)CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=akJ/mol
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=bkJ/mol。其他数据如表:
下列说法正确的是( )
(1)CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=akJ/mol
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=bkJ/mol。其他数据如表:
| 化学键 | C‒O | O‒O | C‒H | O‒H |
| 键能/(kJ•mol‒1) | 798 | x | 413 | 463 |
A.上表中x=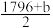 |
| B.H2O(g)=H2O(l)的△S<0,△H=(a-b)kJ/mol |
| C.当有4NA个C‒H键断裂时,反应放出的热量一定为akJ |
| D.a>b且甲烷燃烧热为bkJ/mol |
您最近一年使用:0次
2020-12-08更新
|
275次组卷
|
9卷引用:江苏省泰州中学2021-2022学年高二上学期期中检测化学试题
江苏省泰州中学2021-2022学年高二上学期期中检测化学试题山西省晋中市祁县中学校2019-2020学年高二上学期10月月考化学试题江西省上饶市横峰中学2020-2021学年高二上学期开学考试化学(统招班)试题山西省运城市景胜中学2020-2021学年高二10月月考化学试题山东省德州市10校联考2020—2021学年高二上学期期中模块检测(人教版) 化学试题(已下线)【南昌新东方】9.2020年11月江西南昌三中高三上学期期中化学河北省沧州市黄骅中学2020-2021学年高二上学期第三次月考化学试题甘肃省张掖市高台县第一中学2022-2023学年高三上学期10月月考化学试题甘肃省庆阳市等3地2022-2023学年高二上学期12月期中化学试题
5 . 合理利用或转化NO2、NO、CO等污染性气体是人们共同关注的课题。
(1) 实验证明汽车尾气中的NO与CO反应生成无污染气体而除去。
已知:i.N2(g)和O2(g)生成NO(g)过程中的能量变化如下:
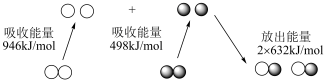
ii.NO2(g)+CO(g) CO2(g)+NO(g) ΔH=-234 kJ·mol-1
CO2(g)+NO(g) ΔH=-234 kJ·mol-1
iii.1 mol NO(g)被O2(g)氧化时放出的热量为56.15 kJ
①反应2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH=
2CO2(g)+N2(g) ΔH=________ kJ·mol-1。
②工业上常用醋酸亚铜氨溶液来吸收CO,反应的化学方程式如下:CH3COOCu(NH3)2(aq)+CO(g) CH3COOCu(NH3)2·CO(aq) ΔH<0。吸收CO后的溶液经过适当处理又可以重新生成醋酸亚铜氨,可采取的处理措施有
CH3COOCu(NH3)2·CO(aq) ΔH<0。吸收CO后的溶液经过适当处理又可以重新生成醋酸亚铜氨,可采取的处理措施有________ (选填序号)。
a. 适当升高温度 b. 适当降低温度
c. 适当增大压强 d. 适当减小压强
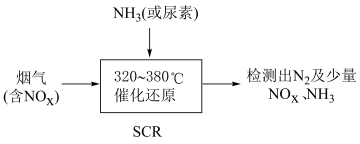
(2) 选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,一般采用 NH3或尿素[CO(NH2)2]作还原剂,基本流程如图所示:
①SCR脱硝技术中用NH3作还原剂还原NO的主要反应为4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) ΔH<0,1 mol O2能氧化NH3的物质的量是
4N2(g)+6H2O(g) ΔH<0,1 mol O2能氧化NH3的物质的量是________ 。若用CO(NH2)2作还原剂,还原NO2的化学方程式为________ 。
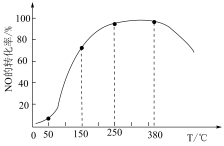
②其他条件不变,在相同时间内,NO转化为N2的转化率随温度的变化如图所示。反应温度在50℃~150℃范围内,NO转化为N2的转化率迅速上升,原因有________ 。
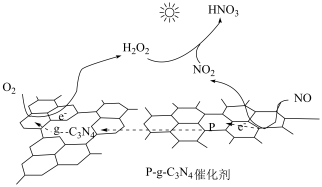
(3)用P—g-C3N4光催化氧化法脱除NO的过程如图所示。在酸性水溶液中,光催化脱除原理和电化学反应原理类似,此时g-C3N4端的反应为________ 。
(1) 实验证明汽车尾气中的NO与CO反应生成无污染气体而除去。
已知:i.N2(g)和O2(g)生成NO(g)过程中的能量变化如下:

ii.NO2(g)+CO(g)
 CO2(g)+NO(g) ΔH=-234 kJ·mol-1
CO2(g)+NO(g) ΔH=-234 kJ·mol-1iii.1 mol NO(g)被O2(g)氧化时放出的热量为56.15 kJ
①反应2NO(g)+2CO(g)
 2CO2(g)+N2(g) ΔH=
2CO2(g)+N2(g) ΔH=②工业上常用醋酸亚铜氨溶液来吸收CO,反应的化学方程式如下:CH3COOCu(NH3)2(aq)+CO(g)
 CH3COOCu(NH3)2·CO(aq) ΔH<0。吸收CO后的溶液经过适当处理又可以重新生成醋酸亚铜氨,可采取的处理措施有
CH3COOCu(NH3)2·CO(aq) ΔH<0。吸收CO后的溶液经过适当处理又可以重新生成醋酸亚铜氨,可采取的处理措施有a. 适当升高温度 b. 适当降低温度
c. 适当增大压强 d. 适当减小压强
(2) 选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,一般采用 NH3或尿素[CO(NH2)2]作还原剂,基本流程如图所示:

①SCR脱硝技术中用NH3作还原剂还原NO的主要反应为4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O(g) ΔH<0,1 mol O2能氧化NH3的物质的量是
4N2(g)+6H2O(g) ΔH<0,1 mol O2能氧化NH3的物质的量是②其他条件不变,在相同时间内,NO转化为N2的转化率随温度的变化如图所示。反应温度在50℃~150℃范围内,NO转化为N2的转化率迅速上升,原因有

(3)用P—g-C3N4光催化氧化法脱除NO的过程如图所示。在酸性水溶液中,光催化脱除原理和电化学反应原理类似,此时g-C3N4端的反应为

您最近一年使用:0次
6 . 天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)①已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ∆H1;
CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2;
2CO(g)+O2(g)=2CO2(g) ∆H3;
则CO2(g)+CH4(g)=2CO(g)+2H2(g)的∆H=___________ 。
②天然气中的少量H2S杂质常用氨水吸收,产物为NH4HS。向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式___________ 。
(2)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g) 2CO(g)+2H2(g)。该反应的平衡常数表达式为
2CO(g)+2H2(g)。该反应的平衡常数表达式为___________ ;在密闭容器中通入物质的量浓度均为0.1 mol/L的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图20-1所示。则压强P1___________ P2(填“大于”或“小于");压强为P2时,在Y点:v(正)___________ v(逆)(填“大于”“小于”或“等于”)。
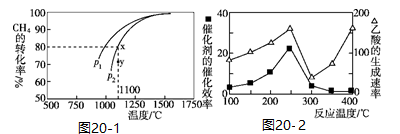
(3)CH4和CO2合成乙酸,某工业生产中以CuAlO2为合成的催化剂,在不同温度下催化剂的催化效率与乙酸的生成速率如图20-2所示。250℃~300℃时,温度升高而乙酸的生成速率降低的原因是___________ ,将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为___________ 。
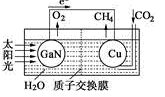
(4)科学家用氮化镓材料与铜组装如下图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式___________ 。
(1)①已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ∆H1;
CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2;
2CO(g)+O2(g)=2CO2(g) ∆H3;
则CO2(g)+CH4(g)=2CO(g)+2H2(g)的∆H=
②天然气中的少量H2S杂质常用氨水吸收,产物为NH4HS。向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式
(2)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)
 2CO(g)+2H2(g)。该反应的平衡常数表达式为
2CO(g)+2H2(g)。该反应的平衡常数表达式为
(3)CH4和CO2合成乙酸,某工业生产中以CuAlO2为合成的催化剂,在不同温度下催化剂的催化效率与乙酸的生成速率如图20-2所示。250℃~300℃时,温度升高而乙酸的生成速率降低的原因是
(4)科学家用氮化镓材料与铜组装如下图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式

您最近一年使用:0次
名校
解题方法
7 . 研究和深度开发CO、CO2和H2的应用对构建生态文明社会具有重要的意义,已知工业生产中有如下反应:
①CO(g)+2H2(g) CH3OH(g);△H= -99 kJ/mol
CH3OH(g);△H= -99 kJ/mol
②CO2(g)+3H2(g) CH3OH(g)+H2O(g);△H= -58 kJ/mol
CH3OH(g)+H2O(g);△H= -58 kJ/mol
③CO2(g)+H2(g) CO(g)+H2O(g);△H
CO(g)+H2O(g);△H
(1)反应①的化学平衡常数K的表达式为_________________ ;反应③的△H=_________ kJ/mol。
(2)合成气的组成 =2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图1所示。
=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图1所示。

图中的压强P1、P2、 P3由大到小顺序为___________ ;a(CO)值随 温度升高而减小,其原因是_____________ 。
(3)工业生产中需对空气中的CO进行监测。使用电化学一氧化碳气体传感器定量检测空气中CO含量,其模型如图2所示。这种传感器利用了原电池原理,则该电池的负极反应式为______________ 。


(4)某催化剂可将CO2和CH4转化成乙酸。催化剂的催化效率和乙酸的生成速率随温度的变化关系如图3所示。乙酸的生成速率主要取决于温度影响的范围是_________ 。
(5)常温下,将一定量的CO2通入石灰乳中充分反应,达平衡后,溶液的pH为11,则c( )=
)=___________ 。 (已知:Ksp[Ca(OH)2]=5.6×10-6,Ksp(CaCO3) =2.8×10-9)。
①CO(g)+2H2(g)
 CH3OH(g);△H= -99 kJ/mol
CH3OH(g);△H= -99 kJ/mol②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g);△H= -58 kJ/mol
CH3OH(g)+H2O(g);△H= -58 kJ/mol③CO2(g)+H2(g)
 CO(g)+H2O(g);△H
CO(g)+H2O(g);△H(1)反应①的化学平衡常数K的表达式为
(2)合成气的组成
 =2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图1所示。
=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图1所示。
图中的压强P1、P2、 P3由大到小顺序为
(3)工业生产中需对空气中的CO进行监测。使用电化学一氧化碳气体传感器定量检测空气中CO含量,其模型如图2所示。这种传感器利用了原电池原理,则该电池的负极反应式为


(4)某催化剂可将CO2和CH4转化成乙酸。催化剂的催化效率和乙酸的生成速率随温度的变化关系如图3所示。乙酸的生成速率主要取决于温度影响的范围是
(5)常温下,将一定量的CO2通入石灰乳中充分反应,达平衡后,溶液的pH为11,则c(
 )=
)=
您最近一年使用:0次
名校
8 . 由合成气制备二甲醚的主要原理如下。下列有关说法正确的是
①CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-90.7kJ·mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1
①CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-90.7kJ·mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1
| A.将1molCO(g)和2molH2(g)充分反应,反应会放出90.7kJ能量 |
| B.反应CO(g)+2H2(g)⇌CH3OH(l) ΔH>-90.7kJ·mol-1 |
| C.反应③使用催化剂,ΔH3减少 |
| D.反应3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)的ΔH=-246.1kJ·mol-1 |
您最近一年使用:0次
2020-09-14更新
|
374次组卷
|
4卷引用:江苏省泰州中学2020-2021学年高二上学期期初检测化学试题
解题方法
9 . 研究氮氧化物等大气污染物的处理对建设美丽家乡、打造宜居环境具有重要意义。
(1)Pb(NO3)2受热分解后能得到PbO、NO2和另一种气体,该气体为_______ (写分子式)。
(2)现有以下反应:2H2(g)+O2(g)=2H2O(l)∆H1
N2(g)+O2(g)=2NO(g)∆H2
2H2(g)+2NO(g) =2H2O(l)+ N2(g) ∆H3
查阅资料获得部分化学键的键能E数据如下表:
已知∆H1=-572kJ/mol,则∆H3=________ 。
(3)O3-石灰乳联合处理NO的方法是先将NO经O3氧化,再用石灰乳吸收氮的氧化物,发生的主要化学反应有:NO+O3=NO2+O2,2NO+O2=2NO2,NO2+NO+Ca(OH)2= Ca(NO2)2+H2O,4NO2+2Ca(OH)2=Ca(NO3)2+Ca(NO2)2+2H2O,
①为保证NO被充分吸收,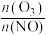 至少为
至少为_______ (填字母)。
A.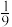 B.
B. C.
C. D.1
D.1
②其他条件相同时,石灰乳浆液中分别加入等物质的量的不同亚硫酸盐对NOx去除效率的影响如图所示。0~25min内,Na2SO3对NOx的去除效率明显高于CaSO3的原因是_______ 。

③下图是环保工业中利用催化反硝化电解法降解水中 的示意图,写出阴极的电极反应式
的示意图,写出阴极的电极反应式_______ 。

(4)对于反应2NO(g)+O2(g)⇌2NO2(g),有学者认为分两步完成,其反应历程如图所示。已知第1步反应2NO(g)⇌N2O2(g)(是快反应,会快速建立平衡状态,第2步反应N2O2(g)+O2(g)⇌2NO2(g)是慢反应。研究发现,在未使用催化剂的条件下,升高温度,总反应速率减慢,其原因可能是_______ 。

(1)Pb(NO3)2受热分解后能得到PbO、NO2和另一种气体,该气体为
(2)现有以下反应:2H2(g)+O2(g)=2H2O(l)∆H1
N2(g)+O2(g)=2NO(g)∆H2
2H2(g)+2NO(g) =2H2O(l)+ N2(g) ∆H3
查阅资料获得部分化学键的键能E数据如下表:
化学键 |
|
|
|
|
| E/(kJ∙mol-1) | 946 | 436 | 497 | 632 |
已知∆H1=-572kJ/mol,则∆H3=
(3)O3-石灰乳联合处理NO的方法是先将NO经O3氧化,再用石灰乳吸收氮的氧化物,发生的主要化学反应有:NO+O3=NO2+O2,2NO+O2=2NO2,NO2+NO+Ca(OH)2= Ca(NO2)2+H2O,4NO2+2Ca(OH)2=Ca(NO3)2+Ca(NO2)2+2H2O,
①为保证NO被充分吸收,
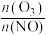 至少为
至少为A.
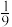 B.
B. C.
C. D.1
D.1②其他条件相同时,石灰乳浆液中分别加入等物质的量的不同亚硫酸盐对NOx去除效率的影响如图所示。0~25min内,Na2SO3对NOx的去除效率明显高于CaSO3的原因是

③下图是环保工业中利用催化反硝化电解法降解水中
 的示意图,写出阴极的电极反应式
的示意图,写出阴极的电极反应式
(4)对于反应2NO(g)+O2(g)⇌2NO2(g),有学者认为分两步完成,其反应历程如图所示。已知第1步反应2NO(g)⇌N2O2(g)(是快反应,会快速建立平衡状态,第2步反应N2O2(g)+O2(g)⇌2NO2(g)是慢反应。研究发现,在未使用催化剂的条件下,升高温度,总反应速率减慢,其原因可能是

您最近一年使用:0次
解题方法
10 . 电化学法还原二氧化碳,不仅能缓解温室效应还能得到乙烯。回答下列问题:
(1)已知:C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=-45.8kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH2=-1277.0kJ·mol-1
则2CO2(g)+2H2O(g)=C2H4(g)+3O2(g)ΔH3=____ 。
(2)电化学法还原二氧化碳为乙烯原理如图所示。

A为电源的___ 极(填“正”或“负”),阴极电极反应式为___ 。电路中转移0.2mol电子,理论上产生氧气___ L(标准状况)。
(3)铜作阴极能提高还原产物乙烯的选择性,水溶液中二氧化碳在铜表面还原为乙烯的机理如图所示(参与反应的水分子及其它生成微粒未画出)。下列有关说法不正确的是___ (填标号)。
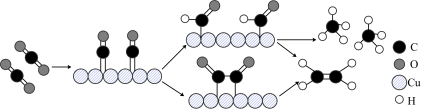
A.铜是二氧化碳转化为乙烯的催化剂
B.二氧化碳还原产物有甲烷和乙烯
C.两个反应历程都是先加氢再除氧
D.两个反应历程都出现碳氧键的断裂与碳碳键的形成
(1)已知:C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=-45.8kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH2=-1277.0kJ·mol-1
则2CO2(g)+2H2O(g)=C2H4(g)+3O2(g)ΔH3=
(2)电化学法还原二氧化碳为乙烯原理如图所示。

A为电源的
(3)铜作阴极能提高还原产物乙烯的选择性,水溶液中二氧化碳在铜表面还原为乙烯的机理如图所示(参与反应的水分子及其它生成微粒未画出)。下列有关说法不正确的是

A.铜是二氧化碳转化为乙烯的催化剂
B.二氧化碳还原产物有甲烷和乙烯
C.两个反应历程都是先加氢再除氧
D.两个反应历程都出现碳氧键的断裂与碳碳键的形成
您最近一年使用:0次
2020-05-16更新
|
233次组卷
|
2卷引用:江苏省泰州市兴化市2022-2023学年高二下学期4月期中考试化学试题







