名校
解题方法
1 . 白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成 P4O6,空气充足时生成 P4O10。
(1)已知 298K 时白磷、红磷完全燃烧的热化学方程式分别为
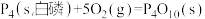 △H1 =-2983.2kJ/mol
△H1 =-2983.2kJ/mol
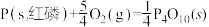 △H2 =-738.5kJ/mol
△H2 =-738.5kJ/mol
则该温度下白磷转化为红磷的热化学方程式为________________________ .
(2)已知 298K 时白磷不完全燃烧的热化学方程式为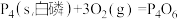 △H =-1638kJ/mol。在某密闭容器中加入 62g 白磷和50.4L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O6 与P4O10 的物质的量之比为
△H =-1638kJ/mol。在某密闭容器中加入 62g 白磷和50.4L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O6 与P4O10 的物质的量之比为________________ ,反应过程中放出的热为_________________
(3)已知白磷和 PCl3 的分子结构如图所示,现提供以下化学键的键能(KJ/mol):P-P:198, Cl-Cl:243, P-Cl :331 .
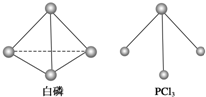
则反应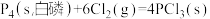 的反应热 △H2 =
的反应热 △H2 =__________ .
(1)已知 298K 时白磷、红磷完全燃烧的热化学方程式分别为
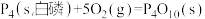 △H1 =-2983.2kJ/mol
△H1 =-2983.2kJ/mol 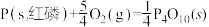 △H2 =-738.5kJ/mol
△H2 =-738.5kJ/mol 则该温度下白磷转化为红磷的热化学方程式为
(2)已知 298K 时白磷不完全燃烧的热化学方程式为
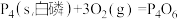 △H =-1638kJ/mol。在某密闭容器中加入 62g 白磷和50.4L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O6 与P4O10 的物质的量之比为
△H =-1638kJ/mol。在某密闭容器中加入 62g 白磷和50.4L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O6 与P4O10 的物质的量之比为(3)已知白磷和 PCl3 的分子结构如图所示,现提供以下化学键的键能(KJ/mol):P-P:198, Cl-Cl:243, P-Cl :331 .

则反应
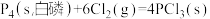 的反应热 △H2 =
的反应热 △H2 =
您最近一年使用:0次
2019-11-21更新
|
346次组卷
|
12卷引用:2016-2017学年江苏省泰州中学高二上月考一化学试卷
2016-2017学年江苏省泰州中学高二上月考一化学试卷(已下线)2012-2013学年江西省南昌市第二中学高二第一次月考化学试卷(已下线)2014高考名师推荐化学盖斯定律及其应用河南省鹤壁市淇滨高级中学2017-2018学年高二上学期第二次月考化学试题山西省朔州市平鲁区李林中学2018-2019学年高二上学期第一次月考化学试题【校级联考】福建省平和一中、南靖一中等五校2018-2019学年高二上学期第一次联考化学试题四川省遂宁市第二中学2019-2020学年高二上学期期中考试化学试题(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)专题1 化学反应与能量(章末培优)-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)黑龙江省宾县第一中学校2021-2022学年高三上学期第一次月考化学试题黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题
名校
2 . 燃煤烟气中含有大量的二氧化硫,进行脱硫处理可以减少环境污染,变废为宝。
(1)H2还原法是处理燃煤烟气中SO2的方法之一。已知:2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol-1;H2S(g)=H2(g)+S(s) ΔH=b kJ·mol-1;H2O(l)=H2O(g) ΔH=c kJ·mol-1;写出SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式:_______ 。
(2)新型纳米材料氧缺位铁酸盐(ZnFe2Ox)能使工业废气中酸性氧化物分解除去,若2 mol ZnFe2Ox与足量SO2可生成2 mol ZnFe2O4和1.0 mol S,则x=_______ 。
(3)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2n Cu+(n+1)O2+(2-2 n)H2O=2n CuSO4+(2-2n) H2SO4,吸收标准状况下11.2L SO2,被SO2还原的O2的质量为______ g。
②利用如所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式______ ;若用甲烷燃料电池作电源(电解质溶液呈碱性),负极的反应式为_______ 。

(1)H2还原法是处理燃煤烟气中SO2的方法之一。已知:2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol-1;H2S(g)=H2(g)+S(s) ΔH=b kJ·mol-1;H2O(l)=H2O(g) ΔH=c kJ·mol-1;写出SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式:
(2)新型纳米材料氧缺位铁酸盐(ZnFe2Ox)能使工业废气中酸性氧化物分解除去,若2 mol ZnFe2Ox与足量SO2可生成2 mol ZnFe2O4和1.0 mol S,则x=
(3)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2n Cu+(n+1)O2+(2-2 n)H2O=2n CuSO4+(2-2n) H2SO4,吸收标准状况下11.2L SO2,被SO2还原的O2的质量为
②利用如所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式

您最近一年使用:0次
2019-11-20更新
|
122次组卷
|
3卷引用:江苏省泰州中学2020-2021学年高二上学期期初检测化学试题
名校
解题方法
3 . 氮氧化物(NO2)是一种主要的大气污染物,必须进行处理。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其反应过程中的能量变化如下:
①△H1___ 0,△H3____ 0。(填“>”或“<”)
②N2(g)+O2(g)=2NO(g)△H=____ kJ·mol-1。
(2)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-l
CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g)AH=-1160 kJ·mol-l
H2O(l)=H2O(g)△H=+44kJ·mol-l
CH4与NO2反应生成N2和H2O(l)的热化学方程式为_______ 。
(3)潜艇中使用的液氮-液氧燃料电池工作原理如图所示:
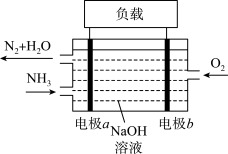
①电极a名称是______ 。
②电解质溶液中OH-离子向_____ 移动(填“电极a”或“电极b”)。
③电极b的电极反应式为_____ 。
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是_____ 。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其反应过程中的能量变化如下:
| 反应 | N2(g)→2N(g) | O2(g)→2O(g) | N(g)+O(g)→NO(g) |
| 反应热 | △H1 | △H2 | △H3 |
| 热量值kJ/mol | 945 | 498 | 630 |
①△H1
②N2(g)+O2(g)=2NO(g)△H=
(2)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-l
CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g)AH=-1160 kJ·mol-l
H2O(l)=H2O(g)△H=+44kJ·mol-l
CH4与NO2反应生成N2和H2O(l)的热化学方程式为
(3)潜艇中使用的液氮-液氧燃料电池工作原理如图所示:

①电极a名称是
②电解质溶液中OH-离子向
③电极b的电极反应式为
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是
您最近一年使用:0次
4 . 下列说法正确的是
| A.任何中和反应生成1molH2O,能量变化均相同 |
| B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同 |
| C.已知:①2H2(g)+O2(g)=2H2O(g)△H=-akJ·mol-l,②2H2(g)+O2(g)=2H2O(1)△H=-b kJ·mol-1,则a>b. |
| D.已知:①C(s,石墨)+O2(g)=CO2(g)△H=-393.5kJ·mol-1,②C(s,金刚石)+O2(g)=CO2(g)△H=-395.0kJ·mol-1.则C(s,石墨)=C(s,金刚石)△H=+1.5kJ·mol-1。 |
您最近一年使用:0次
名校
解题方法
5 . 高炉废渣在循环利用前.需要脱硫(硫元素主要存在形式为S2-,少量为SO32-和SO42-)处理。
(1)高温“两段法”氧化脱硫。第一阶段在空气中相关热化学方程式如下:
CaS(s)+2O2(g)= CaS04(s) △H=-907.1kJmol-1
CaS(s)+3/2O2(g)= CaO(s)+SO2(g) △H=-454.3kJmol-1
①第二阶段在惰性气体中,反应CaS(s)+3CaS04(s)=4CaO(s)+4SO2(g)的△H=________ kJmol-1。
②整个过程中,CaS完全转化生成1molS02,转移的电子数为_________ mol。
③生成的S02用硫酸铜溶液吸收电解氧化,总反应为CuS04+S02+2H20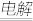 Cu+2H2S04。写出电解时阳极的电极反应式
Cu+2H2S04。写出电解时阳极的电极反应式__________ 。
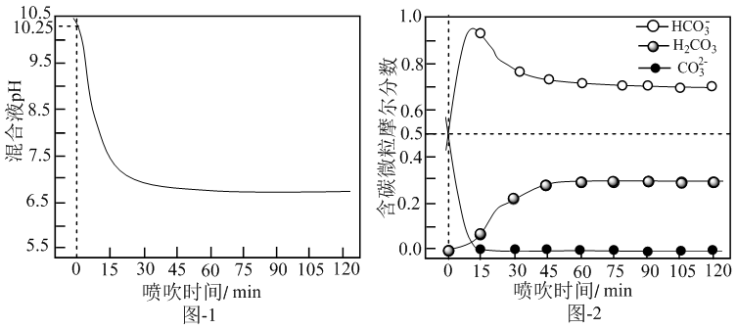
(2)喷吹C02脱硫。用水浸取炉渣,通入适量的C02,将硫元素以含硫气体形式脱去。当 C02的流量、温度一定时,渣-水混合液的pH、含碳元素各种微粒(H2C03、HCO3-、 CO32-)的分布随喷吹时间变化如图-1和图-2所示。_____________ (填字母)。
a.H2O2 b.BaCl2 c.CdCO3
②H2CO3第二步电离的电离常数为Ka2,则pKa2=_____________ (填数值,已知pKa2=—lgKa2)。
③通入CO215〜30min时,混合液中发生的主要脱硫反应离子方程式为_____________ 。
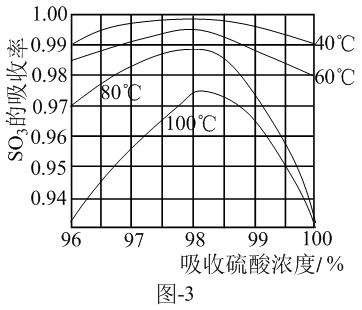
(3)硫酸工业生产中SO3吸收率与进入吸收塔的硫酸浓度和温度关系如图-3,由图可知吸收SO3所用硫酸的适宜浓度为98.3%,温度_____________ ,而工业生产中一般采用60℃的可能原因是_____________ 。
(1)高温“两段法”氧化脱硫。第一阶段在空气中相关热化学方程式如下:
CaS(s)+2O2(g)= CaS04(s) △H=-907.1kJmol-1
CaS(s)+3/2O2(g)= CaO(s)+SO2(g) △H=-454.3kJmol-1
①第二阶段在惰性气体中,反应CaS(s)+3CaS04(s)=4CaO(s)+4SO2(g)的△H=
②整个过程中,CaS完全转化生成1molS02,转移的电子数为
③生成的S02用硫酸铜溶液吸收电解氧化,总反应为CuS04+S02+2H20
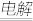 Cu+2H2S04。写出电解时阳极的电极反应式
Cu+2H2S04。写出电解时阳极的电极反应式(2)喷吹C02脱硫。用水浸取炉渣,通入适量的C02,将硫元素以含硫气体形式脱去。当 C02的流量、温度一定时,渣-水混合液的pH、含碳元素各种微粒(H2C03、HCO3-、 CO32-)的分布随喷吹时间变化如图-1和图-2所示。
a.H2O2 b.BaCl2 c.CdCO3
②H2CO3第二步电离的电离常数为Ka2,则pKa2=
③通入CO215〜30min时,混合液中发生的主要脱硫反应离子方程式为
(3)硫酸工业生产中SO3吸收率与进入吸收塔的硫酸浓度和温度关系如图-3,由图可知吸收SO3所用硫酸的适宜浓度为98.3%,温度
您最近一年使用:0次
2019-05-06更新
|
290次组卷
|
2卷引用:【校级联考】江苏省四校(姜堰中学、前中、淮阴中学、溧阳中学)2019届高三下学期第二学期联考化学试题
名校
解题方法
6 . 汽车尾气和燃煤尾气是造成空气污染的重要原因之一,治理汽车尾气和燃煤尾气是环境保护的重要课题。回答下列问题:
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NO2可消除氮氧化物的污染。已知:①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;②N2(g)+2O2(g)= 2NO2(g) △H=+67.8 kJ/mol;③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol则CH4催化还原NO的热化学方程式为___________________ 。
(2)在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g) 2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
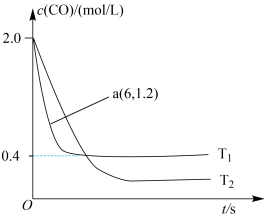
①据此判断该反应的正反应为__________ (填“放热”或“吸热”)反应。
②温度T1时,该反应的平衡常数K=___________ ;反应速率v=v正-v逆=k正c2(NO)c2(CO)-k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,计算a处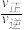 =
=______________ 。
(3)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素作还原剂,其基本流程如图:

①SNCR-SCR脱硝技术中用NH3作还原剂还原NO的主要反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0,则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为_________________ 。
②体系温度直接影响SNCR技术的脱硝效率,如图所示:
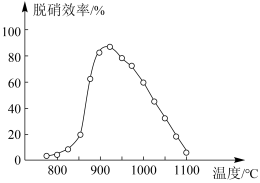
SNCR与SCR技术相比,SCR技术的反应温度不能太高,其原因是_________________ ;当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是_____________________ 。
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NO2可消除氮氧化物的污染。已知:①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;②N2(g)+2O2(g)= 2NO2(g) △H=+67.8 kJ/mol;③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol则CH4催化还原NO的热化学方程式为
(2)在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g)
 2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在某密闭刚性容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示。
①据此判断该反应的正反应为
②温度T1时,该反应的平衡常数K=
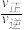 =
=(3)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素作还原剂,其基本流程如图:

①SNCR-SCR脱硝技术中用NH3作还原剂还原NO的主要反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0,则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为
②体系温度直接影响SNCR技术的脱硝效率,如图所示:

SNCR与SCR技术相比,SCR技术的反应温度不能太高,其原因是
您最近一年使用:0次
2019-03-16更新
|
761次组卷
|
3卷引用:江苏省泰兴市第一高级中学2021-2022学年高二下学期第一次阶段测试化学试题
7 . 将甘油(C3H8O3)转化成高附加值产品是当前热点研究方向,甘油和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ: C3H8O3(l)+3H2O(g) 3CO2(g)+7H2(g) ΔH1
3CO2(g)+7H2(g) ΔH1
反应Ⅱ: 2C3H8O3(l)+3O2(g)⇌6CO2(g)+8H2(g) ΔH2=a kJ·mol-1
反应Ⅲ: 2H2(g)+O2(g)⇌2H2O(g) ΔH3=b kJ·mol-1
(1)ΔH1=__________ 。
(2)酸性条件下,甘油可在纳米TiO2Pt复合膜阳极上转化为甘油醛(C3H6O3),该电极方程式为________________________________ 。
(3)硝化甘油(C3H5O9N3)是治疗心绞痛的速效药,也可用作开采矿物的炸药。
①硝化甘油能治疗心绞痛的原理是在人体中释放NO,实验室中也可通过干法制备NO,方程式为3KNO2+KNO3+Cr2O3 2K2CrO4+4NO↑。若有1 mol NO生成,则被KNO3氧化的Cr2O3的物质的量为
2K2CrO4+4NO↑。若有1 mol NO生成,则被KNO3氧化的Cr2O3的物质的量为________ mol。
②硝化甘油爆炸时会彻底分解为N2、O2、CO2和H2O,反应的化学方程式为__________________________________________ 。
(4)①反应Ⅰ制备H2时的副产物很多,主要有CH4、C2H4等,生产过程中必须采取措施抑制副产物产生,目的是__________________________________________________________ 。
②为了有效提高反应Ⅰ氢气的产率,研究人员还采用CaO吸附增强制氢的方法。如图1所示,请分析加入CaO提高氢气产率的原因_________________________________________ 。
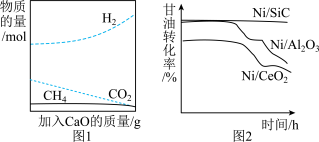
(5)高效的催化剂是这种制氢方法能大规模应用的重要因素。图2为三种不同催化剂在一段时间内与甘油转化率的关系,则Ni/SiC催化剂的优点是________________________________________________________________________ 。
反应Ⅰ: C3H8O3(l)+3H2O(g)
 3CO2(g)+7H2(g) ΔH1
3CO2(g)+7H2(g) ΔH1反应Ⅱ: 2C3H8O3(l)+3O2(g)⇌6CO2(g)+8H2(g) ΔH2=a kJ·mol-1
反应Ⅲ: 2H2(g)+O2(g)⇌2H2O(g) ΔH3=b kJ·mol-1
(1)ΔH1=
(2)酸性条件下,甘油可在纳米TiO2Pt复合膜阳极上转化为甘油醛(C3H6O3),该电极方程式为
(3)硝化甘油(C3H5O9N3)是治疗心绞痛的速效药,也可用作开采矿物的炸药。
①硝化甘油能治疗心绞痛的原理是在人体中释放NO,实验室中也可通过干法制备NO,方程式为3KNO2+KNO3+Cr2O3
 2K2CrO4+4NO↑。若有1 mol NO生成,则被KNO3氧化的Cr2O3的物质的量为
2K2CrO4+4NO↑。若有1 mol NO生成,则被KNO3氧化的Cr2O3的物质的量为②硝化甘油爆炸时会彻底分解为N2、O2、CO2和H2O,反应的化学方程式为
(4)①反应Ⅰ制备H2时的副产物很多,主要有CH4、C2H4等,生产过程中必须采取措施抑制副产物产生,目的是
②为了有效提高反应Ⅰ氢气的产率,研究人员还采用CaO吸附增强制氢的方法。如图1所示,请分析加入CaO提高氢气产率的原因

(5)高效的催化剂是这种制氢方法能大规模应用的重要因素。图2为三种不同催化剂在一段时间内与甘油转化率的关系,则Ni/SiC催化剂的优点是
您最近一年使用:0次
2011·广东·高考真题
真题
名校
8 . 利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I,II,III)作用下,CH4产量随光照时间的变化如图所示。
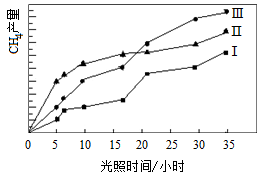
(1)在0-30小时内,CH4的平均生成速率vI、vII和vIII从大到小的顺序为___________ ;反应开始后的12小时内,在第___________ 种催化剂的作用下,收集的CH4最多。
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),该反应的
CO(g)+3H2(g),该反应的 。
。
①在下面坐标图中,画出反应过程中体系的能量变化图___________ (进行必要的标注)。
②将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.10mol,求CH4的平衡转化率__________ (计算结果保留两位有效数字)。
(3)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g)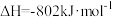 ,写出由CO2生成CO的热化学方程式
,写出由CO2生成CO的热化学方程式___________ 。

(1)在0-30小时内,CH4的平均生成速率vI、vII和vIII从大到小的顺序为
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)
 CO(g)+3H2(g),该反应的
CO(g)+3H2(g),该反应的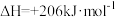 。
。①在下面坐标图中,画出反应过程中体系的能量变化图

②将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.10mol,求CH4的平衡转化率
(3)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g)
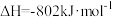 ,写出由CO2生成CO的热化学方程式
,写出由CO2生成CO的热化学方程式
您最近一年使用:0次
2019-01-30更新
|
1255次组卷
|
6卷引用:2012-2013学年江苏泰州二中高二上学期期中考试化学(选修)试卷
(已下线)2012-2013学年江苏泰州二中高二上学期期中考试化学(选修)试卷2011年普通高等学校招生全国统一考试化学卷(广东)(已下线)2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷安徽省青阳县第一中学2019-2020学年高二10月月考化学试题广东省江门市第二中学2020-2021学年高二上学期第二次考试(期中)化学试题(已下线)专题2 综合评价(2)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)
9 . 室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s) CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是
CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是
 CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是
CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是| A.△H2>△H3 | B.△H1<△H3 |
| C.△H1+△H3=△H2 | D.△H1+△H2>△H3 |
您最近一年使用:0次
2019-01-30更新
|
4620次组卷
|
83卷引用:2015届江苏省泰州市姜堰区高三下学期期初联考化学试卷
2015届江苏省泰州市姜堰区高三下学期期初联考化学试卷2014年全国普通高等学校招生统一考试理科综合能力测试化学(新课标Ⅱ卷)(已下线)2013-2014黑龙江省鹤岗一中高一下学期期末考试化学试卷(已下线)2015届浙江省“温州八校”高三返校联考化学试卷(已下线)2014-2015学年云南省玉溪市第一中学高二上学期期中考试化学试卷2015届江西省南昌二中高三上学期第五次考试化学试卷2014-2015学年云南省蒙自市蒙自一中高二上学期期中化学试卷2015届河北省衡水冀州中学高三12月月考化学试卷2014-2015浙江省严州中学高二下学期4月阶段性测试化学试卷2014-2015广东省深圳市高级中学高一下学期期中化学试卷2014-2015学年吉林省长春市十一中高一下期中化学试卷2014-2015学年吉林省实验中学高一下学期期末化学试卷2016届四川省雅安中学高三9月月考化学试卷2015-2016学年河北省行唐启明中学高二上学期第一次月考化学试卷2015-2016学年河南洛阳高级中学高二上9月月考化学试卷2015-2016学年甘肃兰州一中高二上期中测试理科化学试卷2015-2016学年宁夏育才中学高二上学期期中测试化学试卷2016届江苏省清江中学高三第四次(12月)月考化学试卷2016届黑龙江省哈尔滨三十二中高三上学期期末考试化学试卷辽宁省葫芦岛高级中学2015-2016学年高一下第一次月考化学卷2016-2017学年河北冀州市中学高二上开学调研化学卷2017届四川省龙泉中学、温江中学等五校高三上第一次联考化学卷2016-2017学年陕西省西安中学高二上10月月考化学试卷2016-2017学年安徽师大附中高二上10月月考化学卷2017届湖北省荆州中学高三上第四次质检化学试卷2016-2017学年江西省樟树中学高二上第二次月考化学试卷2017届新疆哈密地区第二中学高三上月考二化学卷2016-2017学年江西省樟树中学高二上月考二化学试卷安徽省师范大学附属中学2016-2017学年高一下学期期末考试化学试题2018版化学(苏教版)高考总复习专题六对接高考精练--化学反应的热效应湖北省荆州中学2018届高三第二次月考化学试题河北省大名县第一中学2017-2018学年高二上学期第一次月考化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题A内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题B四川省成都外国语学校2017-2018学年高二上学期期中考试化学试题湖南省长沙市长郡中学2017-2018学年度高二第一学期期末考试化学试题(已下线)2018年9月15日 《每日一题》一轮复习- 周末培优四川省成都市七中实验学校2019届高三上学期10月月考化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二上学期期末考试化学试题四川省成都市实验中学2018-2019学年高二上学期期末考试模拟(二)化学试题(已下线)2019年9月14日 《每日一题》2020年一轮复习 —— 周末培优河南省南阳市第一中学2020届高三上学期第三次月考化学试题河北省鹿泉第一中学2019-2020学年高二9月月考化学试题安徽省青阳县第一中学2019-2020学年高二9月月考化学试题四川省武胜烈面中学2019-2020学年高二10月月考化学试题湖北省荆州中学、宜昌一中两校2019-2020学年高二上学期期末考试化学试题(已下线)【新东方】 2020-3湖北省鄂州高中2019-2020学年高一下学期4月月考化学试题河南省郑州市第一中学2019-2020学年高二上学期入学测试化学试题(已下线)1.1.3 反应焓变的计算 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1河南省林州市第一中学2020-2021学年高二上学期开学考试化学试题吉林省长春市普通高中2021届高三第一次质量检测化学试题广东省汕头市澄海中学2020-2021学年高二上学期期中考试化学(选考)试题天津市滨海新区大港油田第三中学2020-2021学年高二上学期期中考试化学试题(已下线)1.2.2 反应热的计算 (练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)浙江省台州市七校联盟2019-2020学年高二上学期期中联考化学试题广西贺州市中学2020-2021学年高二上学期第三次月考化学试题江西省高安中学2020-2021学年高一上学期第一次月考(A)化学试题四川省汉源县第二中学2019-2020学年高二下学期第二次月考化学试题江西省九江一中2020-2021学年高二上学期月考化学试题广西浦北中学2021-2022学年高二上学期第一次月考化学试题北京市昌平区新学道临川学校2021-2022学年高二上学期第一次月考化学试题新疆哈密市第十五中学2021-2022学年高二上学期第一次月考化学试题青海省西宁市北外附属新华联国际学校2021-2022学年高二上学期第一次月考化学(理)试题四川省成都部分重点中学2021-2022年高二上学期期中测试化学试题辽宁省六校2021-2022学年高二上学期期中考试化学试题陕西省西安市第一中学2021-2022学年高二上学期期中考试化学试题(已下线)专题10 化学反应与能量-2022年高考化学二轮复习重点专题常考点突破练河南省温县第一高级中学2021-2022学年高二上学期12月月考化学试题(已下线)1.2.2 化学反应焓变的计算-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)四川省遂宁中学校2021-2022学年高二下学期开学考试化学试题陕西省西安市西航一中2021-2022学年高二下学期第一次月考试题云南省富源县第一中学2020-2021学年高二上学期第一次统测化学试题河南省南阳市2022-2023学年高二上学期10月期中考试化学试题黑龙江省双鸭山市第一中学2022-2023学年高二上学期期中考试化学试题广西钟山县钟山中学2021-2022学年高二上学期第三次(12月)月考化学(理科)试题吉林省吉林市永吉县第四中学2022-2023学年高三上学期期末考试化学试题(已下线)第六章 化学反应与能量 第34讲 反应热的计算陕西省西安市长安区第一中学2022-2023学年高一下学期期中考试(选择性考试)化学试题作业(三) 反应焓变的计算(已下线)第2讲 盖斯定律 反应热的计算河南省南阳市方城县第一高级中学2022-2023学年高二上学期11月期中考试化学试题(已下线)专题01 化学反应的热效应-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)
名校
解题方法
10 . 为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量.
(1)用CH4催化还原煤燃烧产生的氮氧化物,可以消除污染.
已知:CH4(g)+2NO2(g)═ N2(g)+CO2(g)+2H2O(g)△H=﹣867.0kJ/mol;NO2(g)═1/2N2O4(g)△H=﹣28.5kJ/mol
写出CH4催化还原N2O4(g)生成CO2、N2和H2O(g)的热化学方程式_____ .
(2)一定条件下,将2mol NO2与4molSO2置于恒温体积为2L的恒容密闭容器中,发生:
NO2(g)+SO2(g)═SO3(g)+NO(g),10s时反应达到平衡,测得平衡时c(NO2)=0.25mol/L,则10s内反应的平均速率v(SO2)=_____ ;达到平衡时SO2转化率=_____ ;计算该温度下该反应的化学平衡常数K=_____ (填数值).
(3)将CO2与NH3混合,在一定条件下反应合成尿素,可以保护环境、变废为宝,反应原理为:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g),该反应在一定条件下能自发进行的原因是
CO(NH2)2(s)+H2O(g),该反应在一定条件下能自发进行的原因是_____ ;若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是_____ (填序号).
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正=v(H2O)逆 d.容器中混合气体的密度不再改变
(1)用CH4催化还原煤燃烧产生的氮氧化物,可以消除污染.
已知:CH4(g)+2NO2(g)═ N2(g)+CO2(g)+2H2O(g)△H=﹣867.0kJ/mol;NO2(g)═1/2N2O4(g)△H=﹣28.5kJ/mol
写出CH4催化还原N2O4(g)生成CO2、N2和H2O(g)的热化学方程式
(2)一定条件下,将2mol NO2与4molSO2置于恒温体积为2L的恒容密闭容器中,发生:
NO2(g)+SO2(g)═SO3(g)+NO(g),10s时反应达到平衡,测得平衡时c(NO2)=0.25mol/L,则10s内反应的平均速率v(SO2)=
(3)将CO2与NH3混合,在一定条件下反应合成尿素,可以保护环境、变废为宝,反应原理为:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g),该反应在一定条件下能自发进行的原因是
CO(NH2)2(s)+H2O(g),该反应在一定条件下能自发进行的原因是a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正=v(H2O)逆 d.容器中混合气体的密度不再改变
您最近一年使用:0次



