1 . 室温下,CuSO4·5H2O(s)、CuSO4(s)与其水溶液之间转化的焓变关系如图:
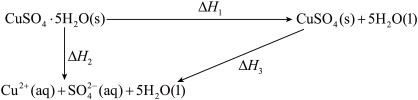
已知CuSO4·5H2O(s)溶于水,溶液温度降低;CuSO4(s)溶于水,溶液温度升高。
下列有关说法不正确的是

已知CuSO4·5H2O(s)溶于水,溶液温度降低;CuSO4(s)溶于水,溶液温度升高。
下列有关说法不正确的是
| A.△H2=△H1+△H3 |
| B.1mol CuSO4(s)的总能量大于1mol Cu2+(aq)与1mol SO42-(aq)的总能量 |
| C.△H2<△H1 |
| D.从硫酸铜溶液中析出CuSO4·5H2O(s)的反应焓变△H>0 |
您最近一年使用:0次
2019-12-25更新
|
100次组卷
|
2卷引用:福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(2卷)试题
解题方法
2 . (一)镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为
①Ni(s)+4CO(g) Ni(CO)4(g) ΔH<0
Ni(CO)4(g) ΔH<0
②Ni(CO)4(g) Ni(s)+4CO(g) ΔH>0
Ni(s)+4CO(g) ΔH>0
完成下列填空:
(1)在温度不变的情况下,要提高反应①中Ni(CO)4的产率,可采取的措施有____ 、____ 。
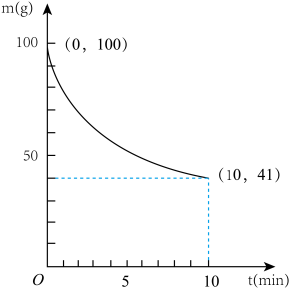
(2)已知在一定条件下2L密闭容器中制备Ni(CO)4,粗镍(纯度98.5%,所含杂质不与CO反应)剩余质量和反应时间的关系如图所示。Ni(CO)4在0~10min的平均反应速率为_____ 。
(3)若反应②达到平衡后,保持其他条件不变,降低温度,重新达到平衡时___ 。
a.平衡常数K增大 b.CO的浓度减小
c.Ni的质量减小 d.υ逆[Ni(CO)4]增大
(二)已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) ΔH=-57kJ·mol-1,一定温度下,将1molN2O4充入一恒压密闭容器中。
N2O4(g) ΔH=-57kJ·mol-1,一定温度下,将1molN2O4充入一恒压密闭容器中。
(1)下列示意图正确且能说明反应达到平衡状态的是___ 。
(2)若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数____ (填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率υ(N2O4)=___ mol·L-1·s-1。
(3)达到平衡后,若向该恒压容器中再充入0.5molHe,则平衡将__ (填“向左移动”“向右移动”或“不移动”)。
(4)该反应在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是___ (填字母序号)。
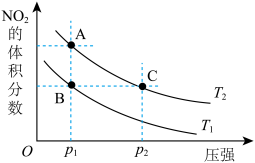
a.A、C两点气体的颜色:A深,C浅
b.A、C两点NO2的转化率:A<C
c.B、C两点的气体的平均相对分子质量:B<C
d.由状态B到状态A,可以用加热的方法
(三)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1丁烯(C4H8)的热化学方程式如下:
已知:
①C4H10(g) C4H8(g)+H2(g) ΔH1
C4H8(g)+H2(g) ΔH1
②C4H10(g)+ O2(g)=C4H8(g)+H2O(g) ΔH2=-119kJ·mol-1
O2(g)=C4H8(g)+H2O(g) ΔH2=-119kJ·mol-1
③H2(g)+ O2(g)=H2O(g) ΔH3=-242kJ·mol-1
O2(g)=H2O(g) ΔH3=-242kJ·mol-1
反应①的ΔH1为____ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x___ 0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是___ (填标号)。
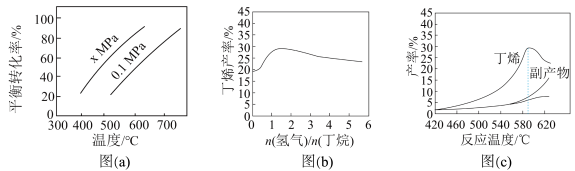
A.升高温度 B.降低温度
C.增大压强 D.降低压强
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是__ 。
①Ni(s)+4CO(g)
 Ni(CO)4(g) ΔH<0
Ni(CO)4(g) ΔH<0②Ni(CO)4(g)
 Ni(s)+4CO(g) ΔH>0
Ni(s)+4CO(g) ΔH>0完成下列填空:
(1)在温度不变的情况下,要提高反应①中Ni(CO)4的产率,可采取的措施有
(2)已知在一定条件下2L密闭容器中制备Ni(CO)4,粗镍(纯度98.5%,所含杂质不与CO反应)剩余质量和反应时间的关系如图所示。Ni(CO)4在0~10min的平均反应速率为

(3)若反应②达到平衡后,保持其他条件不变,降低温度,重新达到平衡时
a.平衡常数K增大 b.CO的浓度减小
c.Ni的质量减小 d.υ逆[Ni(CO)4]增大
(二)已知NO2和N2O4可以相互转化:2NO2(g)
 N2O4(g) ΔH=-57kJ·mol-1,一定温度下,将1molN2O4充入一恒压密闭容器中。
N2O4(g) ΔH=-57kJ·mol-1,一定温度下,将1molN2O4充入一恒压密闭容器中。(1)下列示意图正确且能说明反应达到平衡状态的是

(2)若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数
(3)达到平衡后,若向该恒压容器中再充入0.5molHe,则平衡将
(4)该反应在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是

a.A、C两点气体的颜色:A深,C浅
b.A、C两点NO2的转化率:A<C
c.B、C两点的气体的平均相对分子质量:B<C
d.由状态B到状态A,可以用加热的方法
(三)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1丁烯(C4H8)的热化学方程式如下:
已知:
①C4H10(g)
 C4H8(g)+H2(g) ΔH1
C4H8(g)+H2(g) ΔH1②C4H10(g)+
 O2(g)=C4H8(g)+H2O(g) ΔH2=-119kJ·mol-1
O2(g)=C4H8(g)+H2O(g) ΔH2=-119kJ·mol-1③H2(g)+
 O2(g)=H2O(g) ΔH3=-242kJ·mol-1
O2(g)=H2O(g) ΔH3=-242kJ·mol-1反应①的ΔH1为

A.升高温度 B.降低温度
C.增大压强 D.降低压强
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是
您最近一年使用:0次
解题方法
3 . 减少污染、保护环境是当前全世界最热门的课题,习近平主席在中共中央政治局第六次集体学习时强调,要清醒认识保护生态环境、治理环境污染的紧迫性和艰巨性。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1;C(s)+1/2O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1则焦炭与水蒸气反应生成CO的热化学方程式为__________ 。
②可以用含下列那些物质的洗涤剂来洗涤含SO2的烟气_________ (填序号):
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g) CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
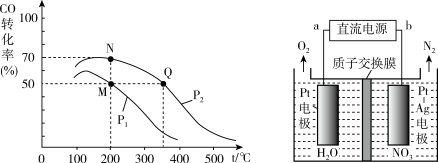
① M、N两点平衡状态下,容器中所有物质的总的物质的量之比为:n(M)总:n(N)总=____ 。
②若M、N、Q三点的平衡常数为KM、KN、KQ,则三者大小关系为_________ 。(用>,=,<表示)
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为________________ 。
②电化学降解NO3-的原理如前图所示,若总反应为4NO3-+4H+=5O2↑+2N2↑+2H2O,则阴极反应式为___________________ 。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1;C(s)+1/2O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1则焦炭与水蒸气反应生成CO的热化学方程式为
②可以用含下列那些物质的洗涤剂来洗涤含SO2的烟气
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)
 CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
① M、N两点平衡状态下,容器中所有物质的总的物质的量之比为:n(M)总:n(N)总=
②若M、N、Q三点的平衡常数为KM、KN、KQ,则三者大小关系为
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为
②电化学降解NO3-的原理如前图所示,若总反应为4NO3-+4H+=5O2↑+2N2↑+2H2O,则阴极反应式为
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1;②CO(g)+2H2(g)
CH3OH(g)+H2O(g) △H1;②CO(g)+2H2(g) CH3OH(g) △H2 ③CO2(g)+H2(g)
CH3OH(g) △H2 ③CO2(g)+H2(g) CO(g)+H2O(g) △H3;
CO(g)+H2O(g) △H3;
回答下列问题:
(1)已知△H2=-99 kJ·mol-1,则根据上表相关的化学键键能(“C O”表示CO的化学键)计算X=
O”表示CO的化学键)计算X=_______ kJ·mol-1。
(2)反应①、②、③对应的平衡常数K1、K2、K3之间的关系式为___________ 。
(3)根据化学反应原理,分析增大压强对反应③的影响为_______________ 。(提示:从对反应速率、平衡状态、转化率角度回答)
Ⅱ.清洁能源具有广阔的开发和应用前景,可减小污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g) CH3OH(g)△H=-99kJ•mol-1。向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g)△H=-99kJ•mol-1。向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:

①Ⅱ和Ⅰ相比,改变的反应条件是_________ ;
②反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)=_________ ;
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)=_________ ;
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1_____ T3(填“>”“<”“=”),判断的理由是_________ 。
 CH3OH(g)+H2O(g) △H1;②CO(g)+2H2(g)
CH3OH(g)+H2O(g) △H1;②CO(g)+2H2(g) CH3OH(g) △H2 ③CO2(g)+H2(g)
CH3OH(g) △H2 ③CO2(g)+H2(g) CO(g)+H2O(g) △H3;
CO(g)+H2O(g) △H3;| 化学键 | H-H | C-O | C O O | H-O | C-H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | X |
回答下列问题:
(1)已知△H2=-99 kJ·mol-1,则根据上表相关的化学键键能(“C
 O”表示CO的化学键)计算X=
O”表示CO的化学键)计算X=(2)反应①、②、③对应的平衡常数K1、K2、K3之间的关系式为
(3)根据化学反应原理,分析增大压强对反应③的影响为
Ⅱ.清洁能源具有广阔的开发和应用前景,可减小污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)
 CH3OH(g)△H=-99kJ•mol-1。向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g)△H=-99kJ•mol-1。向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
①Ⅱ和Ⅰ相比,改变的反应条件是
②反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)=
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)=
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1
您最近一年使用:0次
名校
5 . 联氨(N2H4)常温下为无色液体,可用作火箭燃料。下列说法不正确的是
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)= N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=−1048.9 kJ·mol-1
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)= N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=−1048.9 kJ·mol-1
| A.ΔH4﹦2ΔH3−2ΔH2−ΔH1 |
B.O2(g)+2H2(g) 2H2O(l) ΔH5,ΔH5>ΔH3 2H2O(l) ΔH5,ΔH5>ΔH3 |
| C.1 mol O2(g)和 2 mol H2(g)具有的总能量高于 2 mol H2O(g) |
| D.联氨和 N2O4 作火箭推进剂的原因之一是反应放出大量的热且产物无污染 |
您最近一年使用:0次
2019-10-20更新
|
289次组卷
|
20卷引用:【全国百强校】福建省莆田市第一中学2018-2019学年高二上学期第一次月考化学试题
【全国百强校】福建省莆田市第一中学2018-2019学年高二上学期第一次月考化学试题甘肃省师范大学附属中学2018-2019学年高二上学期第一次月考化学试题浙江省杭州市富阳区新登中学2018-2019学年高二上学期期末模拟化学试题福建省三明市第一中学2019-2020学年高二上学期第一次月考化学试题吉林省靖宇县一中2019-2020学年上学期高二9月月考化学试题河北省沧州市肃宁县第一中学2019-2020学年高二上学期第三次月考化学试题福建省三明第一中学2020-2021学年高二上学期第一次月考化学试题河北省沧州市肃宁县第一中学2020-2021学年高二上学期第一次月考化学试题江西省赣州市会昌县会昌中学2020-2021学年高二上学期第一次月考化学试题重庆市铁路中学校2020-2021学年高二上学期11月月考化学试题福建省武平县第一中学2021-2022学年高二上学期第一次月考化学试题安徽省合肥市合肥九中2020-2021学年高二上学期10月摸底考化学试题福建省将乐县第一中学2021-2022学年高二上学期第一次月考化学试题江苏省宿迁市北大附属宿迁实验学校2022-2023学年高二上学期开学考试化学试题福建省宁德市第一中学2021-2022学年高二上学期9月月考化学试题江苏省苏州市实验中学2023-2024学年高二上学期10月月考化学试题江苏省徐州市2018届高三考前模拟检测化学试题(已下线)2018年高考题及模拟题汇编 专题07 化学反应中的能量变化(已下线)2018年11月浙江省普通高校招生选考科目考试化学仿真模拟试卷03(已下线)2019年1月浙江省普通高中学业水平考试化学仿真模拟试题03
名校
6 . 下列四幅图示所表示的信息与对应的叙述相符的是
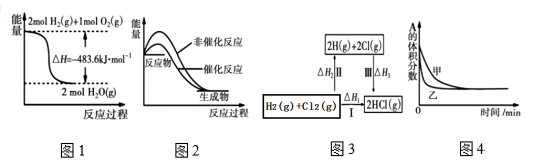

| A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ·mol−1 |
| B.图2表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| C.图3表示一定条件下H2和Cl2生成HCl的反应热与途径无关,则 △H1=△H2+△H3 |
D.图4表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
您最近一年使用:0次
2019-05-10更新
|
1834次组卷
|
22卷引用:福建省莆田四中2019-2020学年高二上学期期中考试化学试题
福建省莆田四中2019-2020学年高二上学期期中考试化学试题山西省晋中市祁县中学校2019-2020学年高二11月月考化学试题江西省上饶市横峰中学、铅山一中、弋阳一中2020-2021学年高二上学期开学联考化学试题(课改班)安徽省合肥市第十一中学2020-2021学年高二上学期第一次月考化学试题湖南省常德市石门县第六中学2020-2021学年高二上学期期末考试(合格考)化学试题黑龙江省绥化市第一中学2021-2022学年高二上学期期中考试化学试卷广东省佛山市第二中学2020-2021学年高二上学期期中考试化学试题内蒙古赤峰市第四中学分校2021-2022学年高二上学期9月月考化学试题【市级联考】安徽省蚌埠市2019届高三下学期第一次质量监测考试化学试题(已下线)专题07 化学反应中的能量变化——2019年高考真题和模拟题化学分项汇编陕西省西安中学2020届高三上学期第三次月考化学试题2020届高三《新题速递·化学》1月第01期(考点01-06)湖南省衡阳市常宁五中2020届高三11月月考化学试题安徽省亳州市2019-2020学年高三上学期期末教学质量检测化学试题江西省宜春市奉新县第一中学2020届高三上学期第四次月考化学试题(已下线)专题6.1 化学能与热能(练)——2020年高考化学一轮复习讲练测北京五中2021届高三上学期第二次月考化学试题福建省建瓯市芝华中学2021届高三上学期第二次阶段考(期中)化学试题新疆北屯高级中学2021届高三上学期10月月考化学试题陕西省西安市长安区第一中学2021届高三上学期第三次月考化学试题黑龙江省大庆中学2022届高三上学期第一次月考化学试题贵州省贵阳市普通中学2021-2022学年高三上学期期末考试化学试题
2019高三·全国·专题练习
名校
7 . 甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g)ΔH1
CH3OH(g)ΔH1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g) CO(g)+H2O(g)ΔH3
CO(g)+H2O(g)ΔH3
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
由此计算ΔH1=____ kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=______ kJ·mol-1。
①CO(g)+2H2(g)
 CH3OH(g)ΔH1
CH3OH(g)ΔH1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2③CO2(g)+H2(g)
 CO(g)+H2O(g)ΔH3
CO(g)+H2O(g)ΔH3回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
| 化学键 | H—H | C—O |  | H—O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
您最近一年使用:0次
2019-03-12更新
|
309次组卷
|
4卷引用:福建省莆田第七中学2021-2022学年高二上学期期末考试化学试题
福建省莆田第七中学2021-2022学年高二上学期期末考试化学试题(已下线)2019年高考总复习巅峰冲刺-专题05 化学反应中的能量变化应试策略(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训甘肃省白银市靖远县第四中学2021届高三上学期10月月考化学试题
8 . 工业上制备BaCl2的工艺流程图如下:
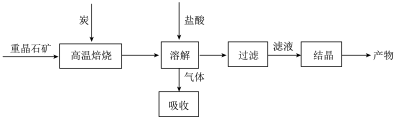
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) + BaS(s) △H1 =571.2kJ·mol-1①
4CO(g) + BaS(s) △H1 =571.2kJ·mol-1①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2=226.2kJ·mol-1②
2CO2(g) + BaS(s) △H2=226.2kJ·mol-1②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为____________ 。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,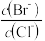 =
=__________ 。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g) 2CO(g)的 △H=
2CO(g)的 △H=________ kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是_______________________________________ ,_____________________________________________ 。

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s)
 4CO(g) + BaS(s) △H1 =571.2kJ·mol-1①
4CO(g) + BaS(s) △H1 =571.2kJ·mol-1①BaSO4(s) + 2C(s)
 2CO2(g) + BaS(s) △H2=226.2kJ·mol-1②
2CO2(g) + BaS(s) △H2=226.2kJ·mol-1②(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
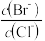 =
=[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g)
 2CO(g)的 △H=
2CO(g)的 △H=(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是
您最近一年使用:0次
2019-01-30更新
|
957次组卷
|
7卷引用:福建省莆田第七中学2021-2022学年高二下学期期中考试化学试题
福建省莆田第七中学2021-2022学年高二下学期期中考试化学试题(已下线)2013-2014学年吉林省白山市第一中学高二上学期期末考试化学试卷(已下线)2014届海南省海南中学高二下学期期中考试化学试题试卷2016-2017学年河北省涿鹿县涿鹿中学高二上调研三化学卷湖南省长沙市第一中学2017-2018学年高二上学期期中考试化学试题内蒙古阿拉善盟第一中学2020-2021学年高二上学期第一次段考化学试题2008年普通高等学校招生统一考试化学试题(江苏卷)
真题
名校
9 . 下列与化学反应能量变化相关的叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
您最近一年使用:0次
2019-01-30更新
|
1171次组卷
|
83卷引用:福建省莆田第七中学2020-2021学年高二上学期期末考试化学试题
福建省莆田第七中学2020-2021学年高二上学期期末考试化学试题(已下线)2010年辽宁省沈阳四校联合体高二上学期期中考试化学卷(已下线)2010-2011学年江苏省扬州中学高二上学期期末考试化学试题(选修)(已下线)2010—2011学年辽宁省沈阳二中高二下学期期末考试化学试卷(已下线)2011-2012学年山东省宁阳四中高二上学期期中学分认定化学试卷(已下线)2011-2012学年湖南省望城一中高二上学期期中考试化学试卷(已下线)2011-2012学年山东省日照一中高二上学期期中考试化学(理)试卷(已下线)2011-2012学年河北省涿州二中高二上学期期中考试化学试卷(已下线)2011-2012学年黑龙江省牡丹江一中高二上学期期末考试化学试卷(已下线)2011-2012学年福建省南安市侨光中学高二上学期期末考试化学试卷(已下线)2011-2012学年山东省济宁市曲阜一中高二上学期期末模拟化学试卷(已下线)2011-2012学年云南蒙自高中高二上学期期中考试化学试卷(已下线)2011-2012学年湖北省武汉市五校高二上学期期中统考化学试卷(已下线)2011-2012学年河南省平顶山市高二上学期期末考试化学试卷(已下线)2011-2012学年河北省迁安市高二第一学期期中考试化学试卷(已下线)2011-2012学年河北省元氏一中高二上学期期中考试化学试卷(已下线)2013-2014学年江西省赣州市十二县高二上学期期中考试化学试卷(已下线)2013-2014学年湖北省荆州中学高二上学期期中考试化学试卷(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(B)卷(已下线)2014秋河北省成安一中、临漳一中、永年二中高二上学期期中联考化学试卷2014-2015学年山东省济南一中高二上学期期中化学试卷2013-2014山东省菏泽市高二上学期期末13校联考化学B试卷2014-2015学年云南省曲靖市陆良县二中高二下期中化学试卷2015-2016学年河北省定兴第三中学高二上学期第一次月考化学试卷2015-2016学年山东寿光中学高二上10月月考化学试卷2015-2016学年山西省太原五中高二上第一次月考化学试卷2015-2016学年安徽省舒城晓天中学高二上学期期中测试化学试卷2015-2016学年广东省湛江市高二上学期期末质检化学试卷2015-2016学年云南省开远四中高二下学期期中化学试卷2016-2017学年湖北省武钢三中高二上月考一化学卷2016-2017学年宁夏育才中学高二上学期期中化学卷2016-2017学年新疆兵团第二师华山中学高二下学期学前考试化学试卷2016-2017学年黑龙江省牡丹江市第一高级中学高二上学期开学检测化学试卷山东省济宁市微山县第二中学2017-2018学年高二上学期第一次月考化学试题湖南省长沙市第一中学2017-2018学年高二上学期期中考试化学试题福建省东山第二中学2017-2018学年高二上学期期中考试化学试题福建省诗山县2017-2018学年高二上学期期中化学试题北京师大附中2017-2018学年上学期高二年级期中考试化学试卷山东省枣庄市第三中学2017-2018学年高二第六学段学情调查(1月)化学试题【全国百强校】河北省石家庄市辛集中学2018-2019学年高二上学期第一次月考化学试题新疆疏勒县八一中学2018-2019学年高二上学期期末化学试题浙江省宁波诺丁汉大学附属中学2017-2018学年高二上学期期中考试化学试题山东省寿光市第一中学2018-2019学年高二上学期第一次月考化学试题天津市静海区四校2019-2020学年高二上学期9月联考化学试题山东省济宁市微山县第二中学2019-2020学年高二10月月考化学试题江西省南昌市第二中学2019-2020学年高二上学期第一次月考化学试题福建省晋江市南侨中学2019-2020学年高二上学期第一阶段考试化学试题步步为赢 高二化学寒假作业:作业一 化学反应中的能量变化西藏自治区日喀则市南木林高级中学2019-2020学年高二上学期期中化学试题山东省德州市陵城区第一中学2019-2020学年高二上学期期中考试化学试题江西省南昌市进贤一中2019-2020学年高二上学期期末考试化学试题甘肃省甘南藏族自治州合作第一中学2019-2020学年高二上学期期末考试化学试题云南省昆明市寻甸县民族中学2019-2020学年高二下学期第一次月考化学试题宁夏银川市宁夏大学附属中学2019-2020学年高二下学期期末考试化学试题人教版(2019)高二选择性必修第一册 第一章 化学反应的热效应 第二节 反应热的计算贵州省毕节市实验高级中学2020-2021学年高二上学期第一次月考化学试题广东省佛山市萌茵实验学校2019-2020学年高二上学期第一次月考化学(理)试题宁夏长庆高级中学2020-2021学年高二上学期第一次月考化学试题西藏林芝市第二高级中学2020-2021学年高二上学期期中考试理综化学试题福建省永安市第一中学2020-2021学年高二上学期第一次月考化学试题黑龙江漠河市高级中学2020-2021学年高二上学期期末考试化学试题浙江省诸暨市2019-2020学年高二上学期期末考试化学试题青海省海南州贵德高级中学2020-2021学年高二下学期期中化学试题河南省正阳高中2020-2021学年高二下学期第三次素质检测化学试题辽宁省阜新市第二高级中学2021-2022学年高二上学期第一阶段考试化学试题吉林省通化县综合高级中学2021-2022学年高二上学期期中考试化学试题山东省淄博市第七中学2019-2020学年高二上学期第一次月考化学试题北京三中2021-2022学年高二上学期期中考试化学试题安徽省六安市第一中学2021-2022学年高二下学期开学考试化学试题西藏拉萨那曲高级中学2021-2022学年高二上学期期中考试化学试题湖南省怀化市雅礼实验学校2022-2023学年高二上学期第一次月考化学试题黑龙江省齐齐哈尔市第八中学校2023-2024学年高二上学期期中考试化学试题2010年普通高等学校招生全国统一考试理综化学部分(山东卷)2010年高考化学试题分项专题七 化学反应中的能量变化(已下线)2012届山东省淄博市第一中学高三上学期期中模块考试化学试卷(已下线)2011-2012学年度江西省临川十中上学期高三期末考试化学试卷(已下线)2013学年海南省琼海市嘉积中学高一下学期教学质量监测(二)理科化学卷2017届山东省枣庄三中高三上学期9月质检化学试卷2015-2016学年广东省湛江一中高一下期末化学试卷2017届河北省沧州一中高三上学期9.22周测化学卷高中化学人教版 选修四 第一章 化学反应与能量 第三节 化学反应热的计算 化学反应热的计算第一课时(盖斯定律)2020届高三化学二轮复习—— 化学能与热能【精编选择25题】内蒙古通辽市奈曼旗实验中学2018-2019学年高一下学期期末考试化学试题
10 . 在298K、100kPa时,已知:
2H2O(g)=2H2(g)+O2(g) △H1
H2(g)+Cl2(g)=2HCl(g) △H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) △H3
则△H3与△H1和△H2间的关系正确的是:
2H2O(g)=2H2(g)+O2(g) △H1
H2(g)+Cl2(g)=2HCl(g) △H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) △H3
则△H3与△H1和△H2间的关系正确的是:
| A.△H3=△H1+2△H2 | B.△H3=△H1+△H2 |
| C.△H3=△H1-2△H2 | D.△H3=△H1-△H2 |
您最近一年使用:0次
2019-01-30更新
|
4322次组卷
|
151卷引用:福建省莆田第七中学2020-2021学年高二上学期期末考试化学试题
福建省莆田第七中学2020-2021学年高二上学期期末考试化学试题(已下线)2010年6月浙江省金温七校高二化学期末卷(已下线)2011-2012学年福建省安溪、惠安、养正中学高二上学期期中联考化学试卷(已下线)2011-2012学年福建南平政和一中高二期末考试化学试卷(已下线)2013-2014学年吉林省长春外国语学校高二上学期期末理科化学试卷(已下线)2013-2014吉林省白城市高二上学期期末考试化学(B卷)试卷2014-2015河南省濮阳市一中高二上学期第三次质量检测化学试卷2014-2015学年广东省东莞市三校高二上学期期中联考化学试卷2014-2015重庆市巫山中学高二上学期第二次月考化学试卷2014-2015河南省濮阳市一中高二上学期第三次月考化学试卷2014-2015湖南省娄底市高二上学期期末考试化学(理)试卷2014-2015四川省攀枝花市高二上学期期末考试化学试卷2015-2016学年北大附中河南分校高二上9月考化学试卷2015-2016学年吉林省汪清县第六中学高二上学期9月月考化学试卷2015-2016学年辽宁省育才学校高二上第一阶段测化学试卷2015-2016学年湖北省荆州中学高二上第一次月考化学试卷2015-2016学年湖南省衡阳市衡东二中高二上学期第二次月考化学试卷2016-2017学年宁夏育才中学高二上学期期中化学卷2016-2017学年河南省郏县一高、叶县二高等五校高二上期中化学卷陕西省咸阳市西藏民族学院附中2016-2017学年高二12月月考化学卷福建省华安一中2016-2017学年高二上学期期末考化学试卷西藏自治区拉萨中学2017-2018学年高二上学期第一次月考理综化学试题山东省济南市外国语学校2017-2018学年高二10月月考(理)化学试题天津市杨柳青一中2017-2018第一学期高二第一次化学月考河南省安阳市第三十六中学2017-2018学年高二上学期期中考试化学试题贵州省遵义航天高级中学2017-2018学年高二上学期第三次月考理综(理)化学试题安徽省淮北实验高级中学2017-2018学年高二上学期期中考试化学试题广西桂林市第十八中学2017-2018学年高二下学期开学考试化学试题广东省红岭中学2017-2018学年高二下学期第二学段考试化学试题人教版高二化学选修四专题:化学反应热的计算同步练习卷山西省运城市河津二中2018-2019学年高二上学期9月月考化学试题山西省汾阳市第二高级中学2018-2019学年高二上学期第二次半月考化学试题新疆自治区北京大学附属中学新疆分校2018-2019学年高二上学期10月月考化学试题湖南省娄底市第四中学2018-2019学年高二上学期10月月考化学试题河北省邢台市第八中学2018-2019学年高二上学期期中考试化学试题【市级联考】湖南省娄底市2018-2019学年高二上学期期中考试化学试题【全国百强校】山西省太原市第五中学2018-2019学年高二(理)上学期12月月考化学试题【全国百强校】湖北省黄冈市黄冈中学2018-2019高二上学期期中模考化学试题河北省邢台市第八中学2018-2019学年高二下学期第一次月考化学试题新疆自治区阿克苏地区库车县乌尊镇中学2018-2019学年高二上学期期中考试化学试题山西运城盐湖五中2018-2019学年高二第一学期9月月考化学试题甘肃省兰州市第一中学2019-2020学年高二9月月考化学试题贵州省凯里市第一中学2019-2020学年高二上学期期中考试化学(理)试题河北省迁西县第一中学2019-2020学年高二10月月考化学试题宁夏长庆高级中学2019-2020学年高二上学期期中考试化学试题吉林省长春市第151中学2019-2020学年高二上学期期中考试化学试题广东省深圳市人大附中2019-2020学年高二上学期期中考试化学试题(已下线)2019年12月18日 《每日一题》化学人教版(选修4)——盖斯定律吉林省大安市第一中学2019-2020学年高二上学期第一次月考化学试题四川省遂宁市2019-2020学年高二上学期期末教学水平监测化学试题湖南省邵东县创新实验学校2019-2020学年高二上学期期末考试(高考)化学试题四川广元市剑门关高级中学2019-2020学年高二上学期期末考试化学试题安徽省宿州市十三所省重点中学2019-2020学年高二上学期期末考试化学试题(理科)江苏省常州市田家炳高级中学 2019-2020学年高二上学期12月份阶段调研考试化学试题甘肃省甘南藏族自治州合作第一中学2019-2020学年高二上学期期末考试化学试题甘肃省甘南藏族自治州合作第一中学2019-2020学年高二上学期9月月考化学试题安徽省黄山市屯溪第一中学2019-2020学年高二下学期入学考试化学试题云南省曲靖市罗平县第三中学2020届高二下学期开学考试化学试题内蒙古自治区呼和浩特市内蒙古师范大学附属中学2019-2020学年高二上学期期中考试化学试题(已下线)第一章 化学反应与能量(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版选修4)陕西省商洛市洛南中学2020-2021学年高二上学期第一次月考化学试题(已下线)1.3.1+盖斯定律-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)河南省驻马店市正阳县高级中学2020-2021学年高二上学期第一次月考化学试题江西省南昌市第十中学2020-2021学年高二上学期第一次月考化学试题安徽省安庆市宜秀区白泽湖中学2020-2021学年高二上学期第一次月考化学试题广东省深圳实验学校2020-2021学年高二上学期第一阶段考试化学试题广东省江门市第二中学2020-2021学年高二上学期第一次月考化学试题福建省福州市福清西山学校高中部2019-2020学年高二上学期期中考试化学试题陕西省延安市第一中学2020-2021学年高二上学期第一次月考化学试题(已下线)【南昌新东方】7. 南昌十中 徐钢 刘惠文.吉林公主岭范家屯一中2020-2021学年高二上学期期中考试化学试题内蒙古自治区巴彦淖尔市临河区第三中学2019-2020学年高二上学期期末考试化学试题吉林省长白朝鲜族自治县实验中学2020-2021学年高二上学期第二次月考化学试题鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 过综合 章末素养综合检测宁夏青铜峡市高级中学2020-2021学年高二上学期期中考试化学试题人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 过综合 章末素养综合检测河北省沧州市任丘市第一中学2020-2021学年高二上学期第一次阶段考试化学试题湖南省湘阴县知源学校2020-2021学年高二上学期9月月考化学试题广东省珠海市北京师范大学珠海分校附属外国语学校2020-2021学年高二上学期期中考试化学试题(A卷)(已下线)1.2.2 反应热的计算 (练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)河南省郑州市第一〇六高级中学2020-2021学年高二上学期11月考试化学试题宁夏海原第一中学2020-2021学年高二上学期第二次月考化学试题(已下线)练习3 化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版)甘肃省庆阳市镇原县第二中学2020-2021学年高二上学期期末考试化学试题湖南省常德市石门县第六中学2020-2021学年高二上学期期末考试(合格考)化学试题广东省广州市越秀区2020-2021学年高二上学期期末考试化学试题黑龙江省鹤岗市绥滨县第一中学2020-2021学年高二上学期期中考试化学(理)试题(已下线)【浙江新东方】高中化学20210304-002辽宁省盘锦市育才学校2020-2021学年高二下学期期初考试化学试题河北省唐山市丰润区第二中学2020-2021学年高二上学期1月月考化学试题广东广州市执信中学2020-2021学年高二下学期3月月考化学科(选择考)试题四川省成都市实验外国语学校(西区)2019-2020 学年高二上学期期中考试化学试题选择性必修1(SJ)专题1专题综合检测河南省原阳县2020-2021学年高二上学期期末考试化学试题江西省抚州市崇仁第二中学2021-2022学年高二上学期第一次月考化学试题吉林省长春市第二十九中学2021-2022学年高二上学期第一学程考试化学试题新疆新和县实验中学2021-2022学年高二上学期第一次月考化学试题甘肃省张掖市第二中学2021-2022学年高二上学期10月月考(B班)化学试题甘肃省张掖市第二中学2021-2022学年高二上学期10月月考(A班)化学试题贵州省凯里市第一中学2021-2022学年高二上学期期中考试化学(理科)试题黑龙江省齐齐哈尔市第十六中学2021-2022学年高二上学期期中考试化学(理)试题安徽省灵璧县第一中学2021-2022学年高二上学期第二次月考化学试题新疆乌鲁木齐市第八中学2021-2022学年高二上学期第三次月考化学试题广东省潮州市2021-2022学年高二上学期期末考试化学试题湖北省十堰市区县普通高中联合体2021-2022学年高二上学期期中联考化学试题甘肃省镇原县第二中学2021-2022学年高二上学期第一次月考化学试题新疆塔城市第三中学2022-2023学年高二上学期第一次月考化学试题黑龙江省饶河县高级中学2022-2023学年高二上学期第一次月考化学试题北京市丰台区2022-2023高二上学期期中考试化学(B卷)试题广东省江门市新会区陈经纶中学2022-2023学年高二上学期第5段月考化学试题甘肃省酒泉市玉门油田第一中学2022-2023学年高二上学期10月月考化学试题广东省中山大学附属中学2022-2023学年高二上学期期中考试化学试题新疆霍城县第二中学2022-2023学年高二上学期(线上)期中考试化学试题新疆哈密市第八中学2022-2023学年高二上学期期中考试化学试题陕西省西安市周至县第四中学2021-2022学年高二上学期期中考试化学(理科)试题广东省江门市第二中学2022-2023学年高二上学期期中考试化学试题(已下线)第02讲 反应热的计算-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)作业(三) 反应焓变的计算(已下线)专题02 盖斯定律、反应热的计算【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)新疆喀什地区巴楚县2023-2024学年高二上学期10月期中考试化学试题广东省广州市白云中学2023-2024学年高二上学期期中考试化学试题福建省泉州市永春第一中学2023-2024学年高二上学期11月期中考试化学(选择性考试)试题西藏林芝市2023-2024学年高二上学期期末考试理科综合试题四川省达州市宣汉县第二中学2023-2024学年高二上学期中期考试化学试题2010年普通高等学校招生统一考试理综试题化学部分(广东卷)2010年高考化学试题分项专题七 化学反应中的能量变化(已下线)2010年黑龙江省双鸭山一中高三上学期期中考试(化学)(已下线)2011-2012学年陕西省宝鸡中学高一下学期期末考试化学试卷2016届广东省粤西“四校”高三上学期第一次联考化学试卷2016届新疆乌鲁木齐十一中高三上学期模拟考试化学试卷2015-2016学年广东省实验中学高一下期末化学试卷2017届河北省沧州一中高三上学期9.22周测化学卷2017届黑龙江哈尔滨三中高三上期中化学试卷湖北省部分重点中学2016-2017学年高一下学期期末考试化学试题河北省张家口市第一中学2016-2017学年高一(衔接班)下学期期末考试(理)化学试题陕西省黄陵中学高新部2016-2017学年高一下学期期末考试化学试题2018版化学(苏教版)高考总复习专题六课时跟踪训练--化学反应的热效应黑龙江省哈尔滨市第三中学2018届高三上学期第一次验收考试化学试题高中化学人教版 选修四 第一章 化学反应与能量 第三节 化学反应热的计算 化学反应热的计算第一课时(盖斯定律)(已下线)2018年9月16日 《每日一题》一轮复习- 每周一测(已下线)2019年9月15日 《每日一题》2020年一轮复习 —— 每周一测山东省潍坊市五县市2019-2020学年高一下学期期中考试化学试题甘肃省武威市第十八中学2020届高三上学期期末考试化学试题河南省平顶山市鲁山县第一高级中学2019-2020学年高一6月月考化学试题安徽省安庆市怀宁县第二中学2021届高三上学期第一次月考化学试题(已下线)【全国百强校】内蒙古集宁一中(西校区)2018-2019学年高一6月月考理综-化学试题安徽省六安市城南中学2021届高三上学期第三次月考化学试题山东省临朐县实验中学2020-2021学年高一下学期4月月考化学试题黑龙江省哈尔滨市第三十二中学2021-2022学年高三上学期期末考试化学试题陕西省富平县蓝光中学2021-2022学年高三上学期期末教学检测化学试题山东省烟台市莱阳市第一中学2023-2024学年高一下学期3月月考化学试题



