名校
1 . 可逆反应mA(g)+nB(g)  pC(g)+qD(g)的v-t图象如下图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下图:
pC(g)+qD(g)的v-t图象如下图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下图:
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是
 pC(g)+qD(g)的v-t图象如下图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下图:
pC(g)+qD(g)的v-t图象如下图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下图: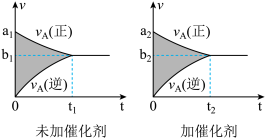
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是
| A.②④⑤⑦ | B.①④⑥⑧ | C.②③⑤⑧ | D.①③⑥⑦ |
您最近半年使用:0次
2019-10-15更新
|
202次组卷
|
13卷引用:【全国百强校】海南省海南中学2018届高三第五次月考化学试题
【全国百强校】海南省海南中学2018届高三第五次月考化学试题(已下线)2012-2013学年河南省安阳一中高二第二次阶段考试化学试卷(已下线)2013-2014学年江苏省无锡江阴市高二下学期期中考试化学试卷2015-2016学年湖南省衡阳八中高二上第二次月考化学试卷黑龙江省双鸭山市第一中学2017-2018学年高二9月月考化学试题湖北省襄阳市第四中学2017-2018学年高二10月月考化学试题【全国百强校】河北省武邑中学2019届高三上学期第一次调研考试化学试题湖南辰溪博雅实验学校2018-2019学年高二8月月考化学试题辽宁省普兰店市第一中学2018-2019学年高二(理)上学期期中考试化学试题山西省运城市河津中学2019-2020学年高二9月月考化学试题吉林省白山市抚松县第六中学2019-2020学年高二上学期期中考试化学试题黑龙江省哈尔滨市第一中学2021届高三上学期期中考试化学试题湖北省孝感市普通高中协作体2022-2023学年高二上学期期中联合考试化学试题
名校
2 . (1)甲元素位于元素周期表的第3周期Ⅱ A族,乙元素的原子结构示意图为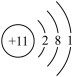
①写乙元素的元素符号:___________ 。
②甲元素原子核外有_________ 个电子层。
③甲元素的金属性(即原子失电子的能力)比乙元素_________ (填“强”或“弱”)。
(2)过氧化氢在适当条件下能发生分解反应:2H2O2=2H2O+O2↑,现进行如下实验探究:在甲、乙两支大小相同的试管中各装入3mL 5%的过氧化氢溶液,再向其中的甲试管中加入少量MnO2粉末。请给合实验现象填写下列空白。
①实验目的:研究催化剂对过氧化氢分解反应速率的影响。
②实验现象:___________ (选填“甲”或“乙”)试管中反应更剧烈,迅速放出无色气体。
③实验结论____________________________________________________ 。

①写乙元素的元素符号:
②甲元素原子核外有
③甲元素的金属性(即原子失电子的能力)比乙元素
(2)过氧化氢在适当条件下能发生分解反应:2H2O2=2H2O+O2↑,现进行如下实验探究:在甲、乙两支大小相同的试管中各装入3mL 5%的过氧化氢溶液,再向其中的甲试管中加入少量MnO2粉末。请给合实验现象填写下列空白。
①实验目的:研究催化剂对过氧化氢分解反应速率的影响。
②实验现象:
③实验结论
您最近半年使用:0次
名校
3 . 某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=_________ ,T1=_______ ;通过实验___________ 可探究出温度变化对化学反应速率的影响。
(2)C组实验中溶液褪色时间t1______ (填“>”或“<”)8s,C组实验的反应速率v(KMnO4) = _________________ 。(用含有t1的式子表示)
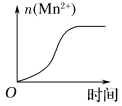
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并以此分析造成n(Mn2+)突变的可能的原因是:______________ 。
| 实验 序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
| KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
| B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t1 |
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=
(2)C组实验中溶液褪色时间t1
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并以此分析造成n(Mn2+)突变的可能的原因是:

您最近半年使用:0次
2019-06-06更新
|
805次组卷
|
7卷引用:海南省海口市第四中学2020-2021学年高二上学期第一次月考化学试题
名校
4 . 汽车尾气无害化处理反应为2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH<0。下列说法正确的是
N2(g)+2CO2(g) ΔH<0。下列说法正确的是
 N2(g)+2CO2(g) ΔH<0。下列说法正确的是
N2(g)+2CO2(g) ΔH<0。下列说法正确的是| A.升高温度可使该反应的正反应速率增大,逆反应速率减小 |
| B.增大压强,可以使NO和CO完全转为为无污染的N2和CO2,而消除污染 |
| C.该反应反应物总能量小于生成物总能量 |
| D.使用高效催化剂可降低反应的活化能,增大活化分子百分数,反应速率增大 |
您最近半年使用:0次
2019-05-09更新
|
942次组卷
|
7卷引用:海南省海口市海南中学2020届高三下学期第七次月考化学试题
海南省海口市海南中学2020届高三下学期第七次月考化学试题海南省海南中学2020届高三下学期第七次月考化学试题【区级联考】天津市部分区2019届高三下学期质量调查试题(二)化学试题(已下线)专题07 化学反应中的能量变化——2019年高考真题和模拟题化学分项汇编福建省泉州市泉港区第一中学2020届高三上学期第一次月考化学试题(已下线)课时35 化学反应速率及影响因素-2022年高考化学一轮复习小题多维练(全国通用)新疆维吾尔自治区喀什市第十四中学2023-2024学年高二上学期1月期末质量检测化学试题
名校
5 . 某化学反应的能量变化如下图所示。下列有关叙述正确的是
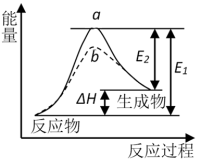

| A.该反应的焓变ΔH=E2-E1 |
| B.a、b分别对应有催化剂和无催化剂的能量变化 |
| C.催化剂能改变反应的焓变 |
| D.催化剂能降低反应的活化能 |
您最近半年使用:0次
2019-03-03更新
|
304次组卷
|
12卷引用:海南省农垦中学2023-2024学年高二上学期期末考试化学试题(B卷)
海南省农垦中学2023-2024学年高二上学期期末考试化学试题(B卷)(已下线)2013届河南省郑州市高三第一次模拟考试化学试卷(已下线)2015届浙江省柯桥中学高三月考(10月)化学试卷2015届北京市第66中学高三上学期期中考试化学试卷2015-2016学年贵州遵义航天中学高二上第三次月考化学卷湖北省宜昌市葛洲坝中学2017-2018学年高二上学期期中考试化学试题新疆维吾尔自治区伊宁市生产建设兵团四师一中2018-2019学年高二上学期期中考试化学试题山东省菏泽市第一中学老校区2018-2019学年高二上学期期末模拟化学试题云南省曲靖市沾益区四中2018-2019学年高二上学期期末考试化学试题【全国百强校】山东省潍坊第一中学2018-2019学年高二下学期开学(2月)考试化学试题广东省揭阳市惠来县第一中学2019-2020学年高二上学期期中考试化学试题河南省安阳市第一中学2023届高三第四次全真模拟化学试题
真题
名校
6 . 反应A(g)+B(g)  C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
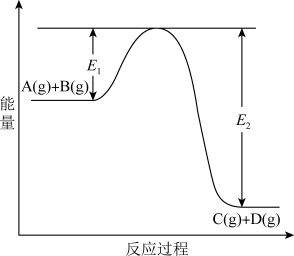
(1)该反应是____________________ 反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______ (填“增大”“减小”“不变”),原因是_______________________________ ;
(3)反应体系中加入催化剂对反应热是否有影响?________ ,原因是_________ :
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________ ,E2________ (填“增大”“减小、”“不变”)。
 C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是
(2)当反应达到平衡时,升高温度,A的转化率
(3)反应体系中加入催化剂对反应热是否有影响?
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1
您最近半年使用:0次
2019-01-30更新
|
1402次组卷
|
19卷引用:2008年普通高等学校招生统一考试化学试题(海南卷)
2008年普通高等学校招生统一考试化学试题(海南卷)(已下线)2011-2012学年海南省洋浦中学高二下学期期中考试化学试卷2015-2016学年海南文昌中学高一下期末考化学(理)试题(已下线)2010年河南省长葛三高高二上学期第一次考试化学试题(已下线)2010年山西省山西大学附中高二上学期10月考化学(已下线)2011-2012学年山西省汾阳市高二10月月考化学试卷(已下线)2011-2012学年辽宁省沈阳同泽女中高二上学期期中考试化学试卷(已下线)2011-2012学年山西省汾阳中学高二第二次月考化学试卷(已下线)2014-2015学年山西省太原第五中学高二10月月考化学试卷2015-2016学年山东省临沂市第十九中学高二上10月月考化学试卷2015-2016学年四川阆中中学校高二下第一次段考化学试卷2015-2016学年青海省西宁市第五中学高一下学期期末(理)化学试卷山西省怀仁县第八中学2016-2017学年高一(普通班)下学期期末考试化学试题黑龙江省双鸭山市第一中学2017-2018学年高二9月月考化学试题宁夏育才中学学益校区2017-2018学年高二下学开学考试化学试题【全国百强校】宁夏回族自治区育才中学2018-2019学年高二上学期第一次(9月)月考化学试题山西省运城市稷山中学2019-2020学年高二上学期第一次月考化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP415(2)】【化学】四川省广安代市中学校2021-2022学年高二上学期第一次月考化学试题
名校
7 . 下列图中的实验方案,能达到实验目的的是
| A | B | C | D | |
| 实验方案 | 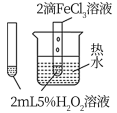 | 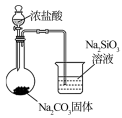 | 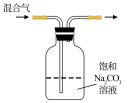 | 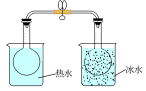 将NO2球浸泡在冰水和热水中 |
| 实验 目的 | 验证FeCl3对H2O2分解反应有催化作用 | 比较HCl、H2CO3和H2SiO3的酸性强弱 | 除去CO2气体中混有的SO2 | 探究温度对平衡 2NO2  N2O4的影响 N2O4的影响 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2019-01-30更新
|
1047次组卷
|
17卷引用:2017届海南省农垦中学高三上学期期末化学试卷
2017届海南省农垦中学高三上学期期末化学试卷(已下线)2014届北京市海淀区高三上学期期中考试化学试卷(已下线)2014届山西省四校高三第二次联考化学试卷2015届云南省红河州高三统一检测理综化学试卷2015届湖南省岳阳市高三教学质量检测化学试卷2015届甘肃省部分普高高三2月联考化学试卷2016届河南省洛阳市高三上学期12月统考化学试卷2016届福建省厦门一中高三下周考(三)理综化学试卷2015-2016学年湖南省洞口县高二下学期期末化学试卷河北省邯郸市(大名县、永年区、磁县、邯山区)四县2016-2017学年高二下学期期中联考化学试题福建省三明市第一中学2016-2017学年高二下学期第二次月考化学试题山西省运城市2018届高三上学期期中考试化学试题内蒙古巴彦淖尔市第一中学2018届高三12月月考理科综合化学试题2019年高考化学一轮复习《化学实验方案的设计与评价》专题同步练习卷北京市第十二中学2019届高三第一学期期中考试化学试题河北省保定市唐县第一中学2021-2022学年高二10月月考化学试题福建省连城县第一中学2022-2023学年高二上学期第一次月考化学试题
真题
8 . 炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化SO2。下列说法正确的是
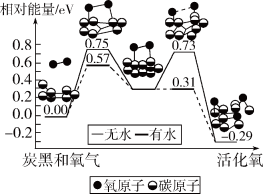

| A.每活化一个氧分子吸收0.29eV能量 |
| B.水可使氧分子活化反应的活化能降低0.42eV |
| C.氧分子的活化是O-O的断裂与C-O键的生成过程 |
| D.炭黑颗粒是大气中SO2转化为SO3的催化剂 |
您最近半年使用:0次
2018-11-28更新
|
3758次组卷
|
5卷引用:2018年普通高等学校招生全国统一考试化学(海南卷)
2018年普通高等学校招生全国统一考试化学(海南卷)山东省日照青山学校2019届高三上学期第三次月考化学试题山西省临汾市2020届高三上学期第二次月考化学试题重庆市2021届高三上学期第一次预测性考试化学试题(已下线)小题必刷23 焓变与热化学方程式——2021年高考化学一轮复习小题必刷(通用版)
名校
9 . (1)为准确测定中和热,除了提供的酸和碱溶液的浓度与体积必须准确外,在实验过程中的另外两个重要措施是:_______________ 、 _________________
(1)在草酸溶液中加入酸性高锰酸钾溶液,发生如下反应。请配平:____________
 MnO4- +
MnO4- + H+ +
H+ + C2O42-=
C2O42-=  Mn2+ +
Mn2+ + CO2 ↑+
CO2 ↑+ H2O
H2O
该反应开始时速率较慢,但一段时间后,紫色突然褪去,其主要原因是:_______________________________________________________________
(3)反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)△H>0 在一容积可变的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g)△H>0 在一容积可变的密闭容器中进行,试回答:
①此反应的平衡常数表达式为___________________ 。若使平衡常数增大,可采取的措施是____________________ 。
②保持压强不变,充入N2,其正反应速率_________ ,(填“增大”、“不变”、“减小”)逆反应速率___________ 。(填“增大”、“不变”、“减小”)
(1)在草酸溶液中加入酸性高锰酸钾溶液,发生如下反应。请配平:
 MnO4- +
MnO4- + H+ +
H+ + C2O42-=
C2O42-=  Mn2+ +
Mn2+ + CO2 ↑+
CO2 ↑+ H2O
H2O 该反应开始时速率较慢,但一段时间后,紫色突然褪去,其主要原因是:
(3)反应3Fe(s)+4H2O(g)
 Fe3O4(s)+4H2(g)△H>0 在一容积可变的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g)△H>0 在一容积可变的密闭容器中进行,试回答:①此反应的平衡常数表达式为
②保持压强不变,充入N2,其正反应速率
您最近半年使用:0次
名校
10 . 对于反应2H2O2=2H2O+O2↑,能加快其反应速率的措施是
| A.减小压强 | B.降低温度 |
| C.加水稀释 | D.使用催化剂 |
您最近半年使用:0次
2017-08-22更新
|
169次组卷
|
4卷引用:海南省三亚华侨学校(南新校区)2020-2021学年高二下学期开学考试化学试题



