1 . 下列实验操作能达到相应实验目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 在两份体积、浓度均相同的 溶液中,分别滴加3滴等浓度的 溶液中,分别滴加3滴等浓度的 溶液、 溶液、 溶液 溶液 | 探究 、 、 对 对 分解反应的催化效率 分解反应的催化效率 |
| B | 测定 溶液、 溶液、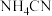 溶液的 溶液的 | 比较 、 、 的酸性强弱 的酸性强弱 |
| C | 将含酚酞的 溶液分成两份,加热其中一份,观察现象 溶液分成两份,加热其中一份,观察现象 | 探究温度对水解平衡的影响 |
| D | 在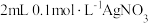 溶液中先滴几滴 溶液中先滴几滴 溶液,产生砖红色沉淀,然后滴几滴 溶液,产生砖红色沉淀,然后滴几滴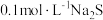 溶液,产生黑色沉淀 溶液,产生黑色沉淀 | 证明溶度积: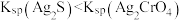 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
2 . 下列方案设计、现象和结论都正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 检验某无色溶液中是否含有 | 取少量该溶液于试管中,加稀硝酸酸化,再加入硝酸钡溶液 | 若有白色沉淀生成,则该溶液中一定含有 |
| B | 探究X是否属于醛类物质 | 向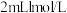 的 的 溶液,加入5滴 溶液,加入5滴 的 的 溶液,振荡后再加入 溶液,振荡后再加入 有机物X,加热 有机物X,加热 | 出现砖红色沉淀,则X可能是醛类物质 |
| C | 探究 和 和 的溶解度大小 的溶解度大小 | 向 溶液中加入一定量的 溶液中加入一定量的 溶液,充分反应后再加少量的 溶液,充分反应后再加少量的 溶液 溶液 | 若先生成白色沉淀,后产生蓝色沉淀,则证明 比 比 溶解度小 溶解度小 |
| D | 探究不同金属离于对 分解速率的影响 分解速率的影响 | 取2支试管,向2支试管中各加入 溶液,分别向试管中各加入 溶液,分别向试管中各加入 溶液和 溶液和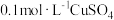 溶液 溶液 | 相同时间内产生气泡多的,则催化效果好 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
3 . 某兴趣小组在利用图所示装置做铜与稀硝酸反应的实验中,发现开始时气泡产生速率非常慢,一段时间后速率明显加快,烧瓶内溶液呈浅蓝色并不断加深,液面上方的气体颜色也在不断加深。该小组同学拟通过实验探究反应速率变化的原因。
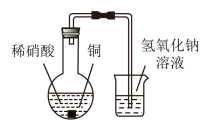
(1)图中铜与稀硝酸反应的离子方程式为___________ 。
(2)图中NaOH溶液能够吸收的有害气体是___________ 。
(3)小组同学提出了如下假设并设计实验探究:
I.甲同学认为反应速率变化的原因可能是反应放热导致溶液温度升高所致,故测定反应过程中溶液不同时间的温度,结果如下表:
结合实验目的和表中数据,你得出的结论是___________ 。
II.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的___________ (填序号)。
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。故得出结论:Cu2+并不是反应的催化剂
III.丙同学根据现象推测反应过程中还有少量______ 生成,进而认为该物质对反应有催化作用,如图所示,丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管。小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用。
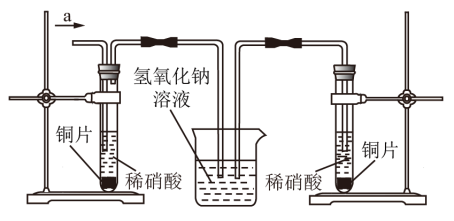
(4)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中Cu2+的浓度较高所致,另一部分同学认为是该溶液中溶解了通入的物质。丁同学设计了一个实验方案证明后者的推测更为合理。(在表格中写出该同学可能的实验操作和实验现象)

(1)图中铜与稀硝酸反应的离子方程式为
(2)图中NaOH溶液能够吸收的有害气体是
(3)小组同学提出了如下假设并设计实验探究:
I.甲同学认为反应速率变化的原因可能是反应放热导致溶液温度升高所致,故测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
II.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。故得出结论:Cu2+并不是反应的催化剂
III.丙同学根据现象推测反应过程中还有少量

(4)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中Cu2+的浓度较高所致,另一部分同学认为是该溶液中溶解了通入的物质。丁同学设计了一个实验方案证明后者的推测更为合理。(在表格中写出该同学可能的实验操作和实验现象)
| 操作 | 现象 |
您最近一年使用:0次
名校
4 . 下列操作能达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 探究温度对2NO2(g) ⇌N2O4(g)平衡有影响 | 将充满NO2的密闭玻璃球浸泡在热水中气体红棕色加深 |
| B | 探究催化剂对H2O2分解速率的影响 | 在相同条件下,向一支试管中加入2mL 5%的H2O2溶液和1mL H2O,向另一支试管中加入2mL 10%的H2O2溶液和1mL FeCl3溶液,观察实验现象 |
| C | 证明增大反应物浓度,能加快化学反应速率 | 将两块表面积相同的鋅粒分别放入稀硫酸和浓硫酸 |
| D | 证明KCl中存在离子键 | KCl溶于水是否导电 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
5 . 下列实验操作和现象与预期实验目的或所得结论不一致的是
| 选项 | 实验操作和现象 | 预期实验目的或所得结论 |
| A | 将酸性KMnO4溶液滴入丙烯醛中,溶液的紫红色褪去 | 不能说明丙烯醛中含有碳碳双键 |
| B | 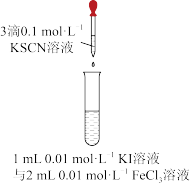 现象为溶液变红 | 证明化学反应存在一定的限度 |
| C | 相同条件下,在两支试管中各加入3mL6%的H2O2溶液,再向H2O2溶液中分别滴入1mLH2O和1mLFeCl3溶液,观察并比较H2O2的分解速率 | 探究催化剂对H2O2分解速率的影响 |
| D | 向2mL甲苯中加入3滴酸性KMnO4溶液,振荡,紫色褪去;向2mL苯中加入3滴酸性KMnO4溶液,振荡,紫色没有褪去 | 证明与苯环相连的甲基易被氧化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
6 . 影响化学反应速率的因素有很多,化学小组的同学用以下实验进行探究。
(1)实验一:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验(其他实验条件相同)。
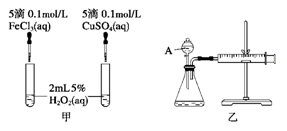
① 定性分析:如图甲可通过观察产生气泡的快慢来比较反应速率的大小,定性比较得出结论。若图甲所示的实验中反应速率为左边>右边,能否一定说明Fe3+比Cu2+对H2O2分解的催化效果更好___________ (填“能”或“否”),其理由是___________ (若能说明催化效果,此空不填)。
② 定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。用简单的方法检验该装置的气密性___________ 。实验中需要测量的数据是___________ 。
(2)实验二:KMnO4酸性溶液(含H2SO4)和H2C2O4(草酸,又叫做乙二酸)溶液反应时,发现开始一段时间溶液褪色不明显,但不久后溶液突然褪色。
① 写出KMnO4酸性溶液和H2C2O4发生反应的离子方程式:___________ 。
② 针对上述实验现象,某同学认为KMnO4与H2C2O4的反应是放热反应,导致溶液温度快速升高反应速率快速增大。从影响化学反应速率的因素看,猜想使反应速率快速增大的原因还可能是___________ 的影响。
③ 若用实验证明上述猜想,除酸性KMnO4溶液、H2C2O4溶液外,还需要选择的试剂最合理的是___________ 。
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰
(1)实验一:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验(其他实验条件相同)。

① 定性分析:如图甲可通过观察产生气泡的快慢来比较反应速率的大小,定性比较得出结论。若图甲所示的实验中反应速率为左边>右边,能否一定说明Fe3+比Cu2+对H2O2分解的催化效果更好
② 定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。用简单的方法检验该装置的气密性
(2)实验二:KMnO4酸性溶液(含H2SO4)和H2C2O4(草酸,又叫做乙二酸)溶液反应时,发现开始一段时间溶液褪色不明显,但不久后溶液突然褪色。
① 写出KMnO4酸性溶液和H2C2O4发生反应的离子方程式:
② 针对上述实验现象,某同学认为KMnO4与H2C2O4的反应是放热反应,导致溶液温度快速升高反应速率快速增大。从影响化学反应速率的因素看,猜想使反应速率快速增大的原因还可能是
③ 若用实验证明上述猜想,除酸性KMnO4溶液、H2C2O4溶液外,还需要选择的试剂最合理的是
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰
您最近一年使用:0次
7 . 某实验小组采用下列实验探究外界条件对化学反应速率及其化学平衡的影响。按要求回答下列问题:

(1)实验(I)目的是探究浓度对反应速率的影响。
①为了观察到明显的现象,它们初始物质的量需要满足的关系为:n(H2C2O4):n(KMnO4)_____ 。反应的快慢可通过测定_____ 来判断。
②在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
甲同学据此提出以下假设:
假设1:反应放热
假设2:生成Mn2+对反应有催化作用
乙同学用如下实验证明假设2成立:
则实验b中V=_____ mL,在实验b中加入蒸馏水的目的是_____ 。预期的实验现象是_____ ,同学们认为不宜用MnCl2溶液代替MnSO4溶液对该反应进行催化探究,其原因是(用离子方程式表示)_____ 。
(2)实验(II)探究浓度对化学平衡的影响。
①试管甲中发生反应的离子方程式为___________ 。
②试管乙中的现象是______ ,说明增大溶液中的Fe3+浓度,平衡______ ,重新达到平衡时Fe3+转化率______ 。
③向试管丙中加入KC1固体,平衡________ 。

(1)实验(I)目的是探究浓度对反应速率的影响。
①为了观察到明显的现象,它们初始物质的量需要满足的关系为:n(H2C2O4):n(KMnO4)
②在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
甲同学据此提出以下假设:
假设1:反应放热
假设2:生成Mn2+对反应有催化作用
乙同学用如下实验证明假设2成立:
| 实验 编号 | 室温下,试管中所加试剂及用量/mL | |||
| 0.20 mol/LH2C2O4溶液 | 0.10 mol/L酸性KMnO4溶液 | 0.10 mol/LMnSO4溶液 | H2O | |
| a | 4.00 | 1.00 | 1.00 | 0 |
| b | 4.00 | 1.00 | 0 | V |
(2)实验(II)探究浓度对化学平衡的影响。
①试管甲中发生反应的离子方程式为
②试管乙中的现象是
③向试管丙中加入KC1固体,平衡
您最近一年使用:0次
8 . 下列操作不能达到实验目的的是
| 实验目的 | 实验操作 | |
| A | 证明非金属性:S>C | 向硫酸溶液中滴入碳酸钠溶液,有气泡产生 |
| B | 证明葡萄糖有还原性 | 向2 mL10%CuSO4溶液中滴加5滴5%NaOH溶液,再加入2 mL10%葡萄糖溶液,加热 |
| C | 探究催化剂对化学反应速率的影响 | 两只大小相同的试管中均加入5%的H2O2溶液2 mL,向其中一支试管滴加 1 mol•L-1 FeCl3溶液1 mL,另一支试管中滴加H2O 1 mL |
| D | 比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | 将颗粒大小相同的钠分别与等体积的无水乙醇、水反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-08-26更新
|
224次组卷
|
2卷引用:黑龙江省齐齐哈尔市2020-2021学年高一下学期期末考试化学试题
名校
9 . CO2催化加氢合成二甲醚(CH3OCH3)是一种CO2转化方法,反应原理为:
2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)
(1)加快该反应速率的措施有___________________ (填两条)。
(2)能证明上述反应达到平衡状态是____ (填标号)。
A.v正(CO2)=3v逆(H2) B.CH3OCH3的浓度不再改变
C.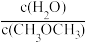 不再变化 D.混合气体的平均相对分子质量不再改变
不再变化 D.混合气体的平均相对分子质量不再改变
(3)某温度下,在体积为2 L的密闭容器中加入2 mol CO2与5 mol H2发生催化反应,经过10 min后CO2的浓度不再变化,测得其体积分数为20%。试计算:
①在0~10 min时段,用CH3OCH3表示的平均反应速率____ 。
②起始状态与平衡状态容器内的压强之比____ 。(无计算过程不给分)
2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)
(1)加快该反应速率的措施有
(2)能证明上述反应达到平衡状态是
A.v正(CO2)=3v逆(H2) B.CH3OCH3的浓度不再改变
C.
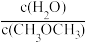 不再变化 D.混合气体的平均相对分子质量不再改变
不再变化 D.混合气体的平均相对分子质量不再改变(3)某温度下,在体积为2 L的密闭容器中加入2 mol CO2与5 mol H2发生催化反应,经过10 min后CO2的浓度不再变化,测得其体积分数为20%。试计算:
①在0~10 min时段,用CH3OCH3表示的平均反应速率
②起始状态与平衡状态容器内的压强之比
您最近一年使用:0次
2021-07-15更新
|
355次组卷
|
2卷引用:四川省绵阳市2020-2021学年高一下学期期末考试化学试题
名校
10 . 为分别验证温度、浓度、催化剂颗粒大小对化学反应速率的影响规律,某同学设计了如下4组实验。
(1)上表中,反应速率最快的是_______ ;
(2)实验3、4预期可得出的结论是_______ ;
(3)设计实验2、3的目的是_______ ;
(4)设计一个实验证明在其它条件相同时,改变温度对过氧化氢分解速率的影响(写出操作步骤)_______ 。
| 实验序号 | 温度 | H2O2溶液初始浓度 | MnO2颗粒大小 |
| 1 | 25℃ | 4% | 无MnO2 |
| 2 | 25℃ | 12% | 1g细颗粒MnO2 |
| 3 | 25℃ | 4% | 1g细颗粒MnO2 |
| 4 | 25℃ | 4% | 1g粗颗粒MnO2 |
(2)实验3、4预期可得出的结论是
(3)设计实验2、3的目的是
(4)设计一个实验证明在其它条件相同时,改变温度对过氧化氢分解速率的影响(写出操作步骤)
您最近一年使用:0次
2021-06-27更新
|
206次组卷
|
3卷引用:云南省大姚县一中2020-2021学年高二下学期6月份考试化学试题
云南省大姚县一中2020-2021学年高二下学期6月份考试化学试题(已下线)2.1.2 影响化学反应速率的因素(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)云南省曲靖市马龙区第一中学2021-2022学年高二下学期3月考试化学试题



