1 . 工业上制备硫酸的一步重要反应是 在400~500℃下的催化氧化反应
在400~500℃下的催化氧化反应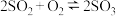 △H<0。下列有关说法错误的是
△H<0。下列有关说法错误的是
 在400~500℃下的催化氧化反应
在400~500℃下的催化氧化反应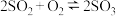 △H<0。下列有关说法错误的是
△H<0。下列有关说法错误的是A.实际生产中, 、 、 再循环使用提高原料利用率 再循环使用提高原料利用率 |
B.在实际生产中控制温度为400~500℃,温度过低速率慢,温度过高 转化率低 转化率低 |
C.为提高反应速率和平衡时 的转化率,实际生产中采用的压强越大越好 的转化率,实际生产中采用的压强越大越好 |
| D.要综合考虑影响速率与平衡的各种因素、设备条件和经济成本等,寻找适宜的生产条件 |
您最近一年使用:0次
名校
2 . 以下事实不能用勒夏特列原理解释的是
| A.实验室常用排饱和食盐水的方法收集氯气 |
| B.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率 |
| C.工业制取硫酸和合成氨反应都要使用催化剂 |
| D.合成氨工业生产中,把合成塔中的氨气不断抽出 |
您最近一年使用:0次
2024-01-05更新
|
94次组卷
|
2卷引用:广东省深圳市罗湖外语学校2023-2024学年高二上学期期中考试化学试题
名校
3 .  催化氧化是制硫酸的关键步骤:
催化氧化是制硫酸的关键步骤: 。
。 时,在
时,在 的恒温恒容容器中加入
的恒温恒容容器中加入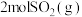 和
和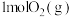 ,测得混合气体的总物质的量
,测得混合气体的总物质的量 随时间的变化如表所示:
随时间的变化如表所示:
下列推断不正确 的是
 催化氧化是制硫酸的关键步骤:
催化氧化是制硫酸的关键步骤: 。
。 时,在
时,在 的恒温恒容容器中加入
的恒温恒容容器中加入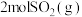 和
和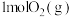 ,测得混合气体的总物质的量
,测得混合气体的总物质的量 随时间的变化如表所示:
随时间的变化如表所示: | 0 | 3 | 6 | 10 | 15 | 25 |  |
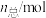 | 3 | 2.50 | 2.35 | 2.15 | 2.10 | 2.08 | 2.06 |
A. ,混合体系的压强逐渐减小 ,混合体系的压强逐渐减小 |
B.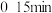 , , |
C. 时,反应时间最好定为 时,反应时间最好定为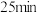 |
D. 时, 时, 的平衡转化率为 的平衡转化率为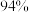 |
您最近一年使用:0次
名校
解题方法
4 . 硫酸是一种重要的基础化工产品,接触法制硫酸生产中的关键工序是 的催化氧化:
的催化氧化: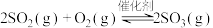
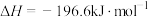 。回答下列问题。
。回答下列问题。
(1)某温度下,在体积为 的刚性密闭容器中投入
的刚性密闭容器中投入 和
和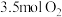 ,下图是
,下图是 和
和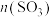 随时间的变化曲线。
随时间的变化曲线。

①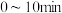 ,
,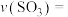
___________ 。
②反应达到平衡时,平衡常数
___________  。(保留3位有效数字)
。(保留3位有效数字)
③下列情况不能说明反应达到化学平衡状态的是___________ 。
A. B.混合气体的相对分子质量不再变化
B.混合气体的相对分子质量不再变化
C.体系的压强不再发生改变 D.混合气体的密度保持不变
(2)下表列出了在不同温度和压强下,反应达到平衡时 的转化率。
的转化率。
①仅从表中数据可得出最优的条件是___________ 。
②在实际生产中,选定的温度为400~500℃和常压(0.1MPa),原因是___________ 。
(3)当 、
、 和
和 起始的物质的量分数分别为7.5%、10.5%和82%时,在
起始的物质的量分数分别为7.5%、10.5%和82%时,在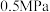 、
、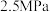 和
和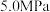 压强下,
压强下, 平衡转化率
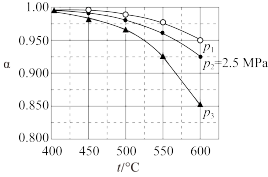
平衡转化率 随温度的变化如下图所示。反应在
随温度的变化如下图所示。反应在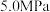 、550℃时的
、550℃时的
___________ ,影响 的因素有温度、压强和
的因素有温度、压强和___________ 。
 的催化氧化:
的催化氧化: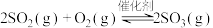
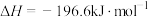 。回答下列问题。
。回答下列问题。(1)某温度下,在体积为
 的刚性密闭容器中投入
的刚性密闭容器中投入 和
和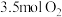 ,下图是
,下图是 和
和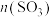 随时间的变化曲线。
随时间的变化曲线。
①
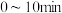 ,
,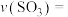
②反应达到平衡时,平衡常数

 。(保留3位有效数字)
。(保留3位有效数字)③下列情况不能说明反应达到化学平衡状态的是
A.
 B.混合气体的相对分子质量不再变化
B.混合气体的相对分子质量不再变化C.体系的压强不再发生改变 D.混合气体的密度保持不变
(2)下表列出了在不同温度和压强下,反应达到平衡时
 的转化率。
的转化率。| 温度/℃ | 平衡时 的转化率/% 的转化率/% | ||||
 | 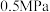 |  |  | 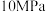 | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
②在实际生产中,选定的温度为400~500℃和常压(0.1MPa),原因是
(3)当
 、
、 和
和 起始的物质的量分数分别为7.5%、10.5%和82%时,在
起始的物质的量分数分别为7.5%、10.5%和82%时,在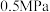 、
、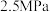 和
和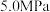 压强下,
压强下, 平衡转化率
平衡转化率 随温度的变化如下图所示。反应在
随温度的变化如下图所示。反应在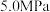 、550℃时的
、550℃时的
 的因素有温度、压强和
的因素有温度、压强和
您最近一年使用:0次
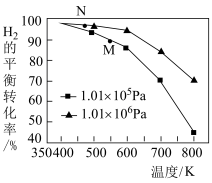
5 . 向恒容密闭容器中充入物质的量之比为1:1的CO和H2,进行反应: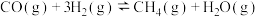 ,测得不同压强下,H2的平衡转化率随温度的变化情况如图所示。下列有关说法正确的是
,测得不同压强下,H2的平衡转化率随温度的变化情况如图所示。下列有关说法正确的是
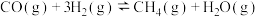 ,测得不同压强下,H2的平衡转化率随温度的变化情况如图所示。下列有关说法正确的是
,测得不同压强下,H2的平衡转化率随温度的变化情况如图所示。下列有关说法正确的是
A.该反应的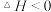 |
| B.M、N点时均表示平衡状态,故M、N点时的正反应速率一定相等 |
| C.降低温度,H2的转化率可达到100% |
| D.工业上用此法制取甲烷应采用更高的压强 |
您最近一年使用:0次
解题方法
6 . 合成氨工业中采用了物质循环操作,主要的目的是
| A.降低氨的沸点 | B.增大化学反应速率 |
| C.提高N2和H2的利用率 | D.提高平衡混合物中氨的含量 |
您最近一年使用:0次
2023-11-08更新
|
163次组卷
|
2卷引用:广东省汕头市育能实验学校2023-2024学年高二上学期期中考试化学试卷
名校
解题方法
7 . 硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。有关反应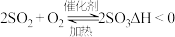 的说法不正确的是:
的说法不正确的是:
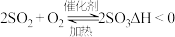 的说法不正确的是:
的说法不正确的是:| A.实际生产中,SO2、O2再循环使用提高原料利用率 |
| B.实际生产中,为了降低成本,提高生成效益,通常采用常压、和较高的反应温度 |
| C.实际生产中,选定400—500℃作为反应温度,主要原因是该温度范围催化剂的活性最高 |
| D.实际生产中,通常通入过量SO2来提高O2的转化率 |
您最近一年使用:0次
解题方法
8 . ZnO是制备各种含锌材料的原料,在电镀、医疗上有广泛应用。一种以菱锌矿(主要成分为 ,杂质为
,杂质为 以及含有Fe、Mn、Ni等元素)为原料制备ZnO的工艺流程如下:
以及含有Fe、Mn、Ni等元素)为原料制备ZnO的工艺流程如下:
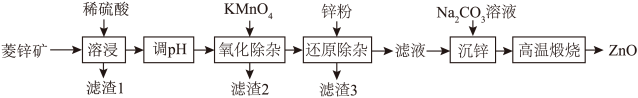
已知:①“溶浸”后的溶液中金属离子主要有: 、
、 、
、 、
、 。
。
②在本实验条件下, 不能被氧化;弱酸性溶液中
不能被氧化;弱酸性溶液中 能将
能将 氧化生成
氧化生成 。
。
③生成氢氧化物沉淀的pH见下表:
回答下列问题:
(1)“溶浸”实验中,锌的浸出率结果如下图所示,由图可知,当锌的浸出率为70%时,所采用的实验条件为___________ 。

(2)“调pH”中,向“溶浸”后的溶液中加入___________ (填化学式)调节pH约为5。
(3)“氧化除杂”中发生反应的离子方程式分别是:① ,②
,②___________ 。
(4)“还原除杂”中,滤渣3的主要成分是___________ 及过量的锌粉,“还原除杂”的反应类型为___________ 。
(5)“沉锌”后,沉淀要用水洗,检查沉淀是否洗涤干净的方法是___________ 。
(6)“沉锌”生成碱式碳酸锌的成分可能是 ,取干燥后的沉淀11.2g,“高温煅烧”后可得到产品ZnO8.1g,则x=
,取干燥后的沉淀11.2g,“高温煅烧”后可得到产品ZnO8.1g,则x=___________ 。
 ,杂质为
,杂质为 以及含有Fe、Mn、Ni等元素)为原料制备ZnO的工艺流程如下:
以及含有Fe、Mn、Ni等元素)为原料制备ZnO的工艺流程如下:
已知:①“溶浸”后的溶液中金属离子主要有:
 、
、 、
、 、
、 。
。②在本实验条件下,
 不能被氧化;弱酸性溶液中
不能被氧化;弱酸性溶液中 能将
能将 氧化生成
氧化生成 。
。③生成氢氧化物沉淀的pH见下表:
| 物质 |  |  |  |  |  |
| 开始沉淀时的pH | 1.5 | 6.3 | 6.2 | 6.9 | 8.1 |
| 沉淀完全时的pH | 2.8 | 8.3 | 8.2 | 8.9 | 10.1 |
(1)“溶浸”实验中,锌的浸出率结果如下图所示,由图可知,当锌的浸出率为70%时,所采用的实验条件为

(2)“调pH”中,向“溶浸”后的溶液中加入
(3)“氧化除杂”中发生反应的离子方程式分别是:①
 ,②
,②(4)“还原除杂”中,滤渣3的主要成分是
(5)“沉锌”后,沉淀要用水洗,检查沉淀是否洗涤干净的方法是
(6)“沉锌”生成碱式碳酸锌的成分可能是
 ,取干燥后的沉淀11.2g,“高温煅烧”后可得到产品ZnO8.1g,则x=
,取干燥后的沉淀11.2g,“高温煅烧”后可得到产品ZnO8.1g,则x=
您最近一年使用:0次
名校
解题方法
9 . 下列有关合成氨工业的说法正确的是
| A.从合成塔出来的混合气体中,其中NH3只占15%,所以合成氨厂的产率都很低 |
| B.由于氨易液化,N2、H2在实际生产中可循环使用,所以总体来说合成氨的产率很高 |
| C.合成氨工业的反应温度控制在400~500℃,目的是使化学平衡向正反应方向移动 |
| D.合成氨厂采用的压强越大,产率越高,无须考虑设备、条件 |
您最近一年使用:0次
2023-09-08更新
|
286次组卷
|
2卷引用:广东省深圳外国语学校高中园2023-2024学年高二上学期第一学段(一)考试化学试题
10 . 工业合成氨反应为N2(g)+3H2(g)⇌2NH3(g),氨在工农业生产中应用广泛。
(1)已知:键能是1mol化学键完全断裂形成气态原子所需要吸收的能量,部分化学键的键能如表格所示。计算每合成2molNH3可以_______ (填“放出”或“吸收”)热量_______ kJ。
(2)实验室中模拟合成氨过程,将1mol 和2.7mol
和2.7mol 置于恒温、体积为2L的容器中反应。下列情况可说明该反应已经达到化学平衡状态的是
置于恒温、体积为2L的容器中反应。下列情况可说明该反应已经达到化学平衡状态的是_______ (填序号)。
a.反应不再进行,已经停止
b.单位时间内生成nmol 的同时生成3nmol
的同时生成3nmol
c.2υ(H2)=υ(NH3)
d. 、
、 和
和 的物质的量浓度之比为1:3:2
的物质的量浓度之比为1:3:2
e.混合气体的压强不再改变
f.混合气体的密度不再改变
若10min时测得氢气浓度为1.2 mol∙L−1,则用氨气表示的0~10min内的平均化学反应速率为_______ 。
(3)工业合成氨过程中,按一定投料比将原料气以及催化剂置于反应容器中,测得在不同温度和压强下达到化学平衡状态时的氨的平衡含量(%)如表格所示:
实际生产时,通常采用铁触媒作为催化剂、在400~500℃和10~30MPa的条件下合成氨。结合所学知识以及上述表格数据分析,工业上采用400~500℃反应的原因是_______ 。
(4)氨氧燃料电池具有很大的发展潜力。氨氧燃料电池的工作原理如图所示。
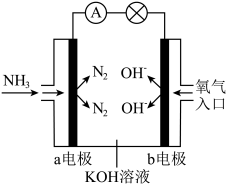
a电极是_______ (填“正极”或“负极”)。b电极的电极反应式是_______ 。
| 化学键 | H−H | N−H | N≡N |
键能( ) ) | 436 | 391 | 945.6 |
(1)已知:键能是1mol化学键完全断裂形成气态原子所需要吸收的能量,部分化学键的键能如表格所示。计算每合成2molNH3可以
(2)实验室中模拟合成氨过程,将1mol
 和2.7mol
和2.7mol 置于恒温、体积为2L的容器中反应。下列情况可说明该反应已经达到化学平衡状态的是
置于恒温、体积为2L的容器中反应。下列情况可说明该反应已经达到化学平衡状态的是a.反应不再进行,已经停止
b.单位时间内生成nmol
 的同时生成3nmol
的同时生成3nmol
c.2υ(H2)=υ(NH3)
d.
 、
、 和
和 的物质的量浓度之比为1:3:2
的物质的量浓度之比为1:3:2e.混合气体的压强不再改变
f.混合气体的密度不再改变
若10min时测得氢气浓度为1.2 mol∙L−1,则用氨气表示的0~10min内的平均化学反应速率为
(3)工业合成氨过程中,按一定投料比将原料气以及催化剂置于反应容器中,测得在不同温度和压强下达到化学平衡状态时的氨的平衡含量(%)如表格所示:
压强(MPa)氨的平衡 含量(%) 温度(摄氏度) | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
(4)氨氧燃料电池具有很大的发展潜力。氨氧燃料电池的工作原理如图所示。

a电极是
您最近一年使用:0次



