名校
1 . (1)对于下列反应:2SO2 + O2 2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为___________ ,用O2浓度变化来表示的反应速率为___________ 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为___________ 。
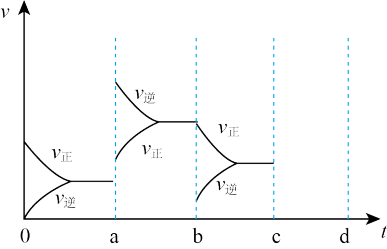
(2)如图表示在密闭容器中反应:2SO2+O2 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是__________ ;b c过程中改变的条件可能是__________ ;若增大压强时,反应速度变化情况画在cd处__________ 。
 2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为(2)如图表示在密闭容器中反应:2SO2+O2
 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
您最近一年使用:0次
2020-12-10更新
|
123次组卷
|
8卷引用:2016-2017学年河北省张家口万全中学高二上第一次月考化学试卷
名校
2 . 在一定条件下,aA+bB cC的可逆反应达到平衡:
cC的可逆反应达到平衡:
(1)若A、B、C都是气体,缩小容器体积,则反应速率______________ (填“增大”或“减小”或“不变”)。
(2)若A、B、C都是气体,减小压强,平衡向逆反应方向移动,则a+b__________ c(填“>”或“=”或“<”)。
(3)若A为固体、B为无色气体、C为有色气体,再加入适量的A物质,则平衡__________ 移动(填“向左”或“向右”或“不”),气体的颜色_________ (填“加深”或“变浅”或“不变”)。
(4)若加热后C的质量分数减少,则正反应是__________ 反应(填“放热”或“吸热”)。
 cC的可逆反应达到平衡:
cC的可逆反应达到平衡:(1)若A、B、C都是气体,缩小容器体积,则反应速率
(2)若A、B、C都是气体,减小压强,平衡向逆反应方向移动,则a+b
(3)若A为固体、B为无色气体、C为有色气体,再加入适量的A物质,则平衡
(4)若加热后C的质量分数减少,则正反应是
您最近一年使用:0次
名校
3 . 某同学研究浓度对化学平衡的影响,下列说法正确的是:已知:Cr2O (aq) + H2O(l)
(aq) + H2O(l) 2CrO
2CrO (aq)+ 2H+(aq) △H=+13.8 kJ/mol
(aq)+ 2H+(aq) △H=+13.8 kJ/mol
 (aq) + H2O(l)
(aq) + H2O(l) 2CrO
2CrO (aq)+ 2H+(aq) △H=+13.8 kJ/mol
(aq)+ 2H+(aq) △H=+13.8 kJ/mol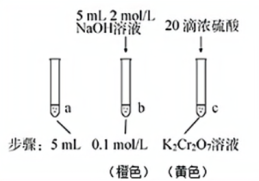 | 待试管b 中颜色不变后与试管a 比较,溶液颜色变浅。滴加浓硫酸, 试管 c 温度略有升高,溶液颜色与试管 a 相比,变深。 |
| A.该反应为氧化还原反应 |
B.待试管b中溶液颜色不变的目的是使Cr2O 完全反应 完全反应 |
| C.试管c中的现象说明影响平衡的主要因素是温度 |
| D.该实验不能证明减小生成物浓度平衡正向移动 |
您最近一年使用:0次
2020-11-12更新
|
530次组卷
|
20卷引用:河北省张家口第一中学2019-2020学年高二9月月考化学试题
河北省张家口第一中学2019-2020学年高二9月月考化学试题河北省张家口市宣化区宣化第一中学2020-2021学年高二上学期9月月考化学试题2016届北京市丰台区高三上学期期末练习化学试卷北京师范大学附属中学2017-2018学年高二上学期期末考试化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高二上学期10月月考化学试题河南省安阳市第二中学2018-2019学年高二上学期期中考试化学试题(已下线)【全国百强校】北京市第四中学2018-2019学年高二上学期期中考试化学试题北京市海淀区101中学2018-2019学年下学期高二期中考试化学试题江西省南昌市第二中学2020-2021学年高二上学期第一次月考化学试题(已下线)【南昌新东方】3. 进贤一中 田荣达北京首都师范大学附属中学2020-2021学年高二上学期期中考试化学试题江西省名校2021-2022学年高二上学期第一次月考化学试题北京市第一七一中学2021-2022学年高一下学期期中考试化学试题北京市第四十四中学2021-2022学年高二上学期期中考试化学试题北京市第二中学2022-2023学年高二上学期10月月考化学试题湖南省株洲市攸县第二中学2022-2023学年高二上学期期中考试化学试题北京十四中2022-2023学年高二上学期期中检测化学试题北京市第一○一中学2022-2023学年高一下学期期末考试化学试题山东省潍坊市第一中学2023-2024学年高二上学期10月月考化学试题北京市第六十六中学2023-2024学年高二上学期期中质量检测化学试题
10-11高二上·河北沧州·期中
名校
解题方法
4 . 现有X(g)+Y(g) 2Z(g),正反应放热,从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据如图回答:从t2~t3的曲线变化是由哪种条件引起的( )
2Z(g),正反应放热,从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据如图回答:从t2~t3的曲线变化是由哪种条件引起的( )
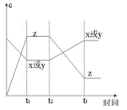
 2Z(g),正反应放热,从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据如图回答:从t2~t3的曲线变化是由哪种条件引起的( )
2Z(g),正反应放热,从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据如图回答:从t2~t3的曲线变化是由哪种条件引起的( )
| A.增大X或Y的浓度 | B.升高温度 |
| C.增大Z的浓度 | D.增大压强 |
您最近一年使用:0次
2020-10-30更新
|
75次组卷
|
15卷引用:河北省张家口市第一中学2016-2017学年高一(衔接班)6月月考(理)化学试题
河北省张家口市第一中学2016-2017学年高一(衔接班)6月月考(理)化学试题河北省张家口市宣化区宣化第一中学2020-2021学年高二上学期10月月考化学试题(已下线)2010年河北省黄骅中学高二上学期期中考试化学试卷(已下线)2011-2012学年江西省南昌三中高二上学期期中考试化学试卷(已下线)2012-2013学年山西省康杰中学高二第一次月考化学试卷(已下线)2012-2013学年陕西省西安市第一中学高二上学期期末考试理科化学卷(已下线)2013-2014学年江西省赣州市十二县高二上学期期中考试化学试卷2015-2016学年河南省洛阳市伊川实验高中高二上第二次月考化学试卷2015-2016学年安徽省安庆市怀宁高河中学高二上第一次月考化学试卷2016-2017学年黑龙江大庆中学高二上期中化学试卷2016-2017学年黑龙江牡丹江中学高二上期中理化学卷湖北省武汉市武昌区2017_2018学年高二化学上学期期中化学试题安徽省凤阳县二中2018-2019学年高二下学期开学摸底考试化学试题山东省日照市第一中学2019-2020学年高二10月月考化学试题(已下线)【南昌新东方】8. 外国语 刘惠文
5 . 密闭容器中进行合成氨反应N2+3H2 2NH3,该反应为放热反应。下列说法正确的是
2NH3,该反应为放热反应。下列说法正确的是
 2NH3,该反应为放热反应。下列说法正确的是
2NH3,该反应为放热反应。下列说法正确的是| A.1 mol N2和3 mol H2的能量之和小于2 mol NH3具有的能量 |
| B.反应过程中同时有1.5molH—H键和3molN—H键断裂时,N2的浓度维持不变 |
| C.降低NH3的浓度,正反应速率增大,逆反应速率减小 |
| D.当反应速率满足v(N2):v(H2)=1:3时,反应达到最大限度 |
您最近一年使用:0次
2020-08-07更新
|
151次组卷
|
4卷引用:河北省张家口市第一中学2019-2020学年高二上学期开学考试化学试题(实验班)
名校
6 . 各可逆反应达平衡后,改变反应条件,其变化趋势正确的是
A.CH3COOH CH3COO-+H+(忽略溶液体积变化) CH3COO-+H+(忽略溶液体积变化)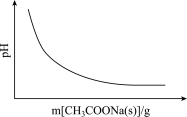 |
B.FeCl3+3KSCN Fe(SCN)3+3KCl(忽略溶液体积变化) Fe(SCN)3+3KCl(忽略溶液体积变化)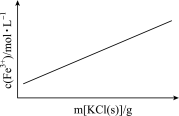 |
C.N2(g)+3H2(g)  2NH3(g)(恒温恒压) 2NH3(g)(恒温恒压) 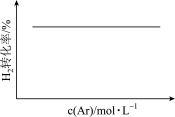 |
D.CH3OCH3(g)+3H2O(g)  6H2(g)+2CO2(g) △H>0(密闭容器,恒压) 6H2(g)+2CO2(g) △H>0(密闭容器,恒压)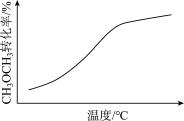 |
您最近一年使用:0次
2020-01-14更新
|
56次组卷
|
3卷引用:张家口市宣化第一中学2020-2021学年高二上学期期中考试化学试题
名校
7 . 对于下列化学平衡在一定条件下发生移动的描述,不正确的是
A.Cl2+H2O HCl+HClO,氯水中加入碳酸钙,漂白性增强 HCl+HClO,氯水中加入碳酸钙,漂白性增强 |
B.ZnS + Cu2+ CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS) CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS) |
C.2NO2 N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅 N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅 |
D.Cr2O72-(橙色)+H2O 2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深 2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深 |
您最近一年使用:0次
2019-12-19更新
|
1124次组卷
|
10卷引用:河北省张家口市第一中学2019-2020学年高二12月月考(实验班)化学试题
河北省张家口市第一中学2019-2020学年高二12月月考(实验班)化学试题北京市朝阳区2018-2019学年高二第二学期期末统一考试化学试题山西省朔州市怀仁一中2019-2020学年高二上学期第四次月考化学试题江西省赣州市会昌中学2019-2020学年高二上学期第二次月考化学试题湖北省荆州中学、宜昌一中两校2019-2020学年高二上学期期末考试化学试题新疆昌吉市教育共同体2019-2020学年高二年级上学期期末考试化学试题第2章《化学键 化学反应规律》单元测试——鲁科版(2019)必修第二册2020年北京高二下学期 复习模拟试题二(选修4人教版)新疆阿勒泰地区2020-2021学年高二上学期期末考试化学试题黑龙江省鸡东二中2020-2021学年高二上学期期末考试化学试题
10-11高二上·江西新余·期中
8 . 在容积不变的密闭容器中进行如下反应:N2+3H2 2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是( )
2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是( )
(1)平衡不发生移动 (2)平衡沿着正反应方向移动
(3)平衡沿着逆反应方向移动 (4)NH3的质量分数增加
(5)正逆反应速率都增大
 2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是( )
2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是( )(1)平衡不发生移动 (2)平衡沿着正反应方向移动
(3)平衡沿着逆反应方向移动 (4)NH3的质量分数增加
(5)正逆反应速率都增大
| A.(1)(5) | B.(1)(2)(5) | C.(3)(5) | D.(2)(4)(5) |
您最近一年使用:0次
2019-11-01更新
|
59次组卷
|
5卷引用:2016-2017学年河北省张家口万全中学高二上第一次月考化学试卷
11-12高二·河南鹤壁·阶段练习
名校
9 . 在相同容积的4个密闭器中进行同一种可逆反应,2A(g)+B(g) 3C(g)+2D(g),起始时4个容器所盛A、B的量如表所示各容器所盛物质的量:
3C(g)+2D(g),起始时4个容器所盛A、B的量如表所示各容器所盛物质的量:
在相同温度下,建立平衡时,4个容器中A或B的转化率的大小关系是
 3C(g)+2D(g),起始时4个容器所盛A、B的量如表所示各容器所盛物质的量:
3C(g)+2D(g),起始时4个容器所盛A、B的量如表所示各容器所盛物质的量:| 容器 | 甲 | 乙 | 丙 | 丁 |
| A | 2mol | 1mol | 2mol | 1mol |
| B | 1mol | 1mol | 2mol | 2mol |
| A.A的转化率为:甲<丙<乙<丁 | B.A的转化率为:甲<乙<丙<丁 |
| C.B的转化率为:甲>丙>乙>丁 | D.B的转化率为:丁>乙>丙>甲 |
您最近一年使用:0次
2019-10-29更新
|
276次组卷
|
8卷引用:河北省张家口市宣化区宣化第一中学2020-2021学年高二上学期10月月考化学试题
河北省张家口市宣化区宣化第一中学2020-2021学年高二上学期10月月考化学试题(已下线)2012-2013学年河南省淇县一中高二第一次月考化学试卷(已下线)2013-2014学年江西省赣州市十二县高二上学期期中考试化学试卷(已下线)2014届陕西省西安市西安中学高三第四次质量检测化学试卷(已下线)2014陕西省西安中学高三上学期第四次质量检测化学试卷浙江省诸暨中学2019-2020学年高二上学期10月阶段性考试化学试题(已下线)【南昌新东方】2019 进贤二中 高二上 期中.河南省鹤壁市高级中学2020-2021学年高二上学期阶段性检测(二)化学试题
名校
10 . 一定条件下,下列不能用勒夏特列原理解释的是
| A.H2、I2、HI 混合气体加压后颜色变深 | B.合成氨时将氨液化分离,可提高原料的利用率 |
| C.实验室常用排饱和NaCl溶液的方法收集Cl2 | D.新制氯水中,滴加硝酸银溶液,溶液颜色变浅 |
您最近一年使用:0次
2019-10-01更新
|
134次组卷
|
3卷引用:河北省张家口第一中学2019-2020学年高二9月月考化学试题



