1 . 工业废水中常含有一定量的 和
和 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为


 Cr3+
Cr3+ Cr(OH)3↓ 其中第①步存在平衡:2
Cr(OH)3↓ 其中第①步存在平衡:2 (黄色)+2H+
(黄色)+2H+
 (橙色)+H2O
(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显________ 色。
(2)能说明第①步反应达平衡状态的是_________ 。(选填编号)
a. 和
和 的浓度相同 b.v正(
的浓度相同 b.v正( )=2v逆(
)=2v逆( )
)
c.溶液的颜色不变 d.溶液的pH值不变
(3)写出第②步中 转变为Cr3+的离子方程式:
转变为Cr3+的离子方程式:_______________________ .
(4)向Cr2(SO4)3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)4]﹣离子.其平衡关系如下:H++[Cr(OH)4]﹣(亮绿色) Cr(OH)3(s,灰绿色)+H2O
Cr(OH)3(s,灰绿色)+H2O Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为
Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为____________________ 。
(5)在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以___________ 形式存在(填写离子符号)。
 和
和 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为


 Cr3+
Cr3+ Cr(OH)3↓ 其中第①步存在平衡:2
Cr(OH)3↓ 其中第①步存在平衡:2 (黄色)+2H+
(黄色)+2H+
 (橙色)+H2O
(橙色)+H2O(1)若平衡体系的pH=2,则溶液显
(2)能说明第①步反应达平衡状态的是
a.
 和
和 的浓度相同 b.v正(
的浓度相同 b.v正( )=2v逆(
)=2v逆( )
)c.溶液的颜色不变 d.溶液的pH值不变
(3)写出第②步中
 转变为Cr3+的离子方程式:
转变为Cr3+的离子方程式:(4)向Cr2(SO4)3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)4]﹣离子.其平衡关系如下:H++[Cr(OH)4]﹣(亮绿色)
 Cr(OH)3(s,灰绿色)+H2O
Cr(OH)3(s,灰绿色)+H2O Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为
Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为(5)在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以
您最近一年使用:0次
2 . 在某一容积为5 L的体积不变的密闭容器内,加入 0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图:

(1)根据图上数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)=________ mol/(L·min),该温度(800℃)下的平衡常数K=____________ 。
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有_______ (填字母)
E.加入催化剂
G.移出一氧化碳气体
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=___________ mol/L。
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,H2O的转化率_____________ (填“升高”、“降低”还是“不变”)。
(5)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L,c(CO2)=c(H2)=0.13mol/L,则此反应是否处于平衡状态:____________ (填“是”或“否”),若没有处于平衡状态则该反应向____________ 方向移动。(填“正反应”或“逆反应”)
 CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如图:
(1)根据图上数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)=
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有
| A.升高温度 |
| B.降低温度 |
| C.增大压强 |
| D.减小压强 |
E.加入催化剂
G.移出一氧化碳气体
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,H2O的转化率
(5)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L,c(CO2)=c(H2)=0.13mol/L,则此反应是否处于平衡状态:
您最近一年使用:0次
2016-12-09更新
|
316次组卷
|
2卷引用:2016-2017学年四川省成都开发区实验中学高二10月月考化学卷
解题方法
3 . 化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g) 2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
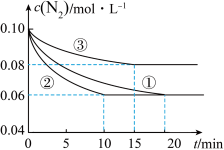
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=__________________ ;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的__________ 、__________ (填字母编号)。
a.增大压强
b.减小压强
c.升高温度
d.降低温度
e.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05mol/L,则该反应的平衡常数K=__________ ;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将__________ (填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时间的变化如图所示。下列说法正确的是__________ (填字母编号)。
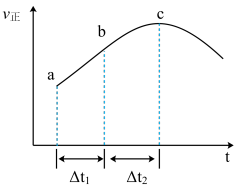
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a______ b。 (填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数Kb=
H2O的电离平衡常数Kb=________________ 。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)
 2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=
a.增大压强
b.减小压强
c.升高温度
d.降低温度
e.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g)
 N2O4(g)。
N2O4(g)。①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05mol/L,则该反应的平衡常数K=
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时间的变化如图所示。下列说法正确的是

A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a
 H2O的电离平衡常数Kb=
H2O的电离平衡常数Kb=
您最近一年使用:0次
2016-12-09更新
|
406次组卷
|
3卷引用:2015届山东省日照市高三12月校际联合检测化学试卷
4 . 红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO•Cr2O3)制备红矾钠的过程中会发生如下反应:4FeO(s)+Cr2O3(s)+8Na2CO3(s)+7O2(g) 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
(1)请写出上述反应的化学平衡常数表达式:K=_____________ 。
(2)图1、图2表示上述反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。由图1判断,反应进行至t2时,曲线发生变化的原因是____________________ (用文字表达);
由图2判断,t2到t3的曲线变化的原因可能是________ (填写序号)。

(3) 工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g),已知该反应能自发进行,在容积固定的密闭容器中,由CO2和H2合成甲醇,则下列图象正确的是
CH3OH(g)+H2O(g),已知该反应能自发进行,在容积固定的密闭容器中,由CO2和H2合成甲醇,则下列图象正确的是______ 。

 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0(1)请写出上述反应的化学平衡常数表达式:K=
(2)图1、图2表示上述反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。由图1判断,反应进行至t2时,曲线发生变化的原因是
由图2判断,t2到t3的曲线变化的原因可能是
| A.升高温度 | B.加了催化剂 | C.通入O2 | D.缩小容器体积 |

(3) 工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),已知该反应能自发进行,在容积固定的密闭容器中,由CO2和H2合成甲醇,则下列图象正确的是
CH3OH(g)+H2O(g),已知该反应能自发进行,在容积固定的密闭容器中,由CO2和H2合成甲醇,则下列图象正确的是
您最近一年使用:0次
2014·北京西城·二模
解题方法
5 . 利用某含铬废液[含较低浓度的Na2Cr2O7、Fe2(SO4)3]制备K2Cr2O7。流程如下:
Ⅰ.用NaOH溶液调pH至3.6,产生红褐色沉淀,过滤;
Ⅱ.向滤液中加入Na2SO3,一定操作后分离出Na2SO4;
Ⅲ.将分离出Na2SO4后的溶液调pH约为5,得到Cr(OH)3沉淀;
Ⅳ.在KOH存在条件下,向Cr(OH)3中加入足量H2O2溶液,得到黄色溶液;
Ⅴ.向黄色溶液中加入物质A后,溶液变为橙红色,一定操作后得到K2Cr2O7固体;
Ⅵ.测定K2Cr2O7固体的纯度。
已知:Cr2O (橙红色)+H2O
(橙红色)+H2O 2CrO
2CrO (黄色)+2H+
(黄色)+2H+
(1)步骤I中红褐色沉淀的化学式是_____ 。
(2)步骤II中加入Na2SO3的目的是_____ 。
(3)步骤IV中反应的离子方程式是_____ 。
(4)步骤V中加入的物质A可以是_____ 。(填序号)
a.KOH b.K2CO3 c.H2SO4 d.SO2
(5)步骤Ⅵ的操作是:取0.45 g K2Cr2O7产品配成溶液,酸化后滴入18.00 mL 0.50 mol/L的FeSO4溶液,恰好使Cr2O 完全转化为Cr3+。产品中K2Cr2O7的纯度是
完全转化为Cr3+。产品中K2Cr2O7的纯度是_____ 。(注:K2Cr2O7的摩尔质量为294 g/mol)
(6)向橙红色的K2Cr2O7溶液中,滴加Ba(NO3)2溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是_____ ,溶液pH变小的原因是_____ 。
Ⅰ.用NaOH溶液调pH至3.6,产生红褐色沉淀,过滤;
Ⅱ.向滤液中加入Na2SO3,一定操作后分离出Na2SO4;
Ⅲ.将分离出Na2SO4后的溶液调pH约为5,得到Cr(OH)3沉淀;
Ⅳ.在KOH存在条件下,向Cr(OH)3中加入足量H2O2溶液,得到黄色溶液;
Ⅴ.向黄色溶液中加入物质A后,溶液变为橙红色,一定操作后得到K2Cr2O7固体;
Ⅵ.测定K2Cr2O7固体的纯度。
已知:Cr2O
 (橙红色)+H2O
(橙红色)+H2O 2CrO
2CrO (黄色)+2H+
(黄色)+2H+(1)步骤I中红褐色沉淀的化学式是
(2)步骤II中加入Na2SO3的目的是
(3)步骤IV中反应的离子方程式是
(4)步骤V中加入的物质A可以是
a.KOH b.K2CO3 c.H2SO4 d.SO2
(5)步骤Ⅵ的操作是:取0.45 g K2Cr2O7产品配成溶液,酸化后滴入18.00 mL 0.50 mol/L的FeSO4溶液,恰好使Cr2O
 完全转化为Cr3+。产品中K2Cr2O7的纯度是
完全转化为Cr3+。产品中K2Cr2O7的纯度是(6)向橙红色的K2Cr2O7溶液中,滴加Ba(NO3)2溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是
您最近一年使用:0次
11-12高三上·江苏盐城·期中
解题方法
6 . 硫酸铜在工农业生产中有着广泛的应用,用某种氧化铜矿制备硫酸铜的工艺流程如下:

(1)浸出时所用硫酸的质量浓度(单位体积的溶液所含溶质的质量)为29.4g·L-1,其物质的量浓度是______________________ ,浸出过程中反应的化学方程式是____________________________________________ 。

(2)萃取“相比”是表示萃取效果的参数之一,指的是有机相(O)与水相(A)的体积比。采用一定浓度的铜萃取剂萃取硫酸浸出液中的铜离子,测得当萃取时间为120s时,“相比”(O/A)对铜萃取率的影响如上图所示。在实际操作中“相比”应选择___________。(填序号)
(3)已知铜萃取剂可用HR(O)表示,萃取过程可表示为:Cu2++2HR(O)⇌ CuR2(O)+2H+,反萃取加入400 g·L-1硫酸的理由是_________________________________ 。
(4)从富铜液中获得较多晶体粗品的实验操作依次是___________ 、___________
(填操作名称)过滤、干燥。
(5)游泳场馆常用硫酸铜作杀菌剂,这是利用了CuSO4的___________ 性质。

(1)浸出时所用硫酸的质量浓度(单位体积的溶液所含溶质的质量)为29.4g·L-1,其物质的量浓度是

(2)萃取“相比”是表示萃取效果的参数之一,指的是有机相(O)与水相(A)的体积比。采用一定浓度的铜萃取剂萃取硫酸浸出液中的铜离子,测得当萃取时间为120s时,“相比”(O/A)对铜萃取率的影响如上图所示。在实际操作中“相比”应选择___________。(填序号)
| A.1∶1 | B.1∶3 | C.1∶5 |
(4)从富铜液中获得较多晶体粗品的实验操作依次是
(填操作名称)过滤、干燥。
(5)游泳场馆常用硫酸铜作杀菌剂,这是利用了CuSO4的
您最近一年使用:0次
11-12高三上·浙江温州·阶段练习
解题方法
7 . .以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90 ℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是_________________ 。
(2)Ⅱ中,需加一定量酸,该酸最好是____ 。运用化学平衡原理简述该酸的作用________________________________________________________________________ 。
(3)Ⅲ中,生成FeCO3的离子方程式是___________________________________________
若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_______________________________________ 。
(4)Ⅳ中,通过检验SO42-来判断沉淀是否洗涤干净,检验SO42-的操作是__________________________________________________________________________________ 。
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O22Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是________ kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90 ℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是
(2)Ⅱ中,需加一定量酸,该酸最好是
(3)Ⅲ中,生成FeCO3的离子方程式是
若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是
(4)Ⅳ中,通过检验SO42-来判断沉淀是否洗涤干净,检验SO42-的操作是
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O22Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是
您最近一年使用:0次
11-12高三上·浙江金华·期中
解题方法
8 . 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为:CrO42- Cr2O72-
Cr2O72-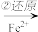 Cr3+
Cr3+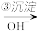 Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
⑴若平衡体系的pH=2,该溶液显______ 色。
⑵能说明第①步反应达平衡状态的是_____________ 。
a. Cr2O72-和CrO42-的浓度相同 b.2υ(Cr2O72-)=υ(CrO42-) c.溶液的颜色不变
⑶第②步中,还原1molCr2O72-离子,需要_________ mol的FeSO4·7H2O。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
⑷用Fe做电极的原因为____________________________________ 。
⑸在阴极附近溶液pH升高的原因是(用电极反应解释)__________________ ,溶液中同时生成的沉淀还有_________________ 。
⑹写出Cr2O72-变为Cr3+的离子方程式___________________ ;
方法1:还原沉淀法
该法的工艺流程为:CrO42-
 Cr2O72-
Cr2O72-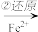 Cr3+
Cr3+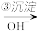 Cr(OH)3↓
Cr(OH)3↓其中第①步存在平衡:2CrO42-(黄色)+2H+
 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O⑴若平衡体系的pH=2,该溶液显
⑵能说明第①步反应达平衡状态的是
a. Cr2O72-和CrO42-的浓度相同 b.2υ(Cr2O72-)=υ(CrO42-) c.溶液的颜色不变
⑶第②步中,还原1molCr2O72-离子,需要
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
⑷用Fe做电极的原因为
⑸在阴极附近溶液pH升高的原因是(用电极反应解释)
⑹写出Cr2O72-变为Cr3+的离子方程式
您最近一年使用:0次
11-12高三上·北京朝阳·期末
9 . 已知工业制氢气的反应为CO(g) + H2O(g) CO2(g) + H2(g),反应过程中能量变化如右图所示。在500 ℃时的平衡常数 K = 9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
CO2(g) + H2(g),反应过程中能量变化如右图所示。在500 ℃时的平衡常数 K = 9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
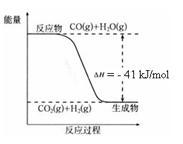
(1)增加H2O(g)的浓度,CO的转化率将_______ (填“增大”“减小”或“不变”)。
(2)平衡常数的表达式K =_______ 。400 ℃时的平衡常数K______ 9(填“>”“<”或”“=”)。
(3)500 ℃时,10 min内v(H2O)=_______ ,在此过程中体系的能量将_______ (填“增加”或“减少”)_________ kJ。
(4)已知 2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol
结合上图写出CO完全燃烧生成CO2的热化学方程式:_______ 。
 CO2(g) + H2(g),反应过程中能量变化如右图所示。在500 ℃时的平衡常数 K = 9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
CO2(g) + H2(g),反应过程中能量变化如右图所示。在500 ℃时的平衡常数 K = 9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
(1)增加H2O(g)的浓度,CO的转化率将
(2)平衡常数的表达式K =
(3)500 ℃时,10 min内v(H2O)=
(4)已知 2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol
结合上图写出CO完全燃烧生成CO2的热化学方程式:
您最近一年使用:0次
2010·江苏泰州·一模
解题方法
10 . 重铬酸钠(Na2Cr2O7)广泛用于合成颜料、媒染剂等,以铬铁矿(主要成分为Cr2O3,还有FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程图如下:

请回答下列问题。
(1)铬铁矿中的Cr2O3与纯碱、O2在高温下反应的化学方程式为______________ 。
(2)若Ⅰ中只用一种试剂调节溶液的pH,应选用________ (填标号)。
A.稀硫酸 B.氧化钠固体 C.氢氧化钾溶液
(3)Ⅰ中,调节溶液pH后,如果溶液的pH过小,可能导致W沉淀部分溶解,原因是:____________ 。(用离子方程式表示)。
(4)Ⅱ中,Na2CrO4转化为Na2Cr2O7的离子反应如下:
 ①该反应
①该反应______________ (填“是”或“不是”)氧化还原反应。
②若往Na2Cr2O7溶液(橙红色)中加入足量NaOH固体,溶液___________ (填标号)。
A.变黄色 B.颜色不变 C.橙红色变深
③已知:25℃,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7。25℃,往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是_______ 。

请回答下列问题。
(1)铬铁矿中的Cr2O3与纯碱、O2在高温下反应的化学方程式为
(2)若Ⅰ中只用一种试剂调节溶液的pH,应选用
A.稀硫酸 B.氧化钠固体 C.氢氧化钾溶液
(3)Ⅰ中,调节溶液pH后,如果溶液的pH过小,可能导致W沉淀部分溶解,原因是:
(4)Ⅱ中,Na2CrO4转化为Na2Cr2O7的离子反应如下:
 ①该反应
①该反应②若往Na2Cr2O7溶液(橙红色)中加入足量NaOH固体,溶液
A.变黄色 B.颜色不变 C.橙红色变深
③已知:25℃,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7。25℃,往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是
您最近一年使用:0次



