1 . 用来表示可逆反应: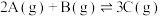
 的正确图像是
的正确图像是
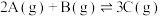
 的正确图像是
的正确图像是A.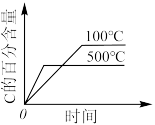 | B.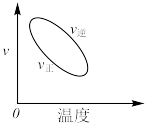 |
C.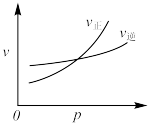 | D. |
您最近半年使用:0次
名校
解题方法
2 . 一定条件下发生反应: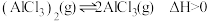 ,平衡时该体系的气体平均摩尔质量(M)在不同温度(T)下随压强(p)的变化曲线如图所示。下列说法正确的是
,平衡时该体系的气体平均摩尔质量(M)在不同温度(T)下随压强(p)的变化曲线如图所示。下列说法正确的是
 ,平衡时该体系的气体平均摩尔质量(M)在不同温度(T)下随压强(p)的变化曲线如图所示。下列说法正确的是
,平衡时该体系的气体平均摩尔质量(M)在不同温度(T)下随压强(p)的变化曲线如图所示。下列说法正确的是
A.温度: | B.a、b两点M相同,平衡常数也相同 |
C.反应速率: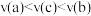 | D.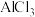 的物质的量浓度: 的物质的量浓度: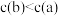 |
您最近半年使用:0次
2024-01-22更新
|
210次组卷
|
2卷引用:辽宁省朝阳市建平县2023-2024学年高三上学期1月期末化学试题
名校
解题方法
3 . 反应 ,在温度为
,在温度为 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。下列说法正确的是
的体积分数随压强变化曲线如图所示。下列说法正确的是
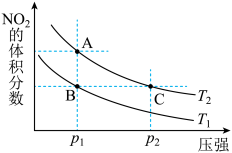
 ,在温度为
,在温度为 时,平衡体系中
时,平衡体系中 的体积分数随压强变化曲线如图所示。下列说法正确的是
的体积分数随压强变化曲线如图所示。下列说法正确的是
A.A、C两点的反应速率: |
| B.A、C两点气体的颜色:A深,C浅 |
C.由状态 到状态 到状态 ,可以用加热的方法 ,可以用加热的方法 |
D.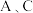 两点气体的平均相对分子质量: 两点气体的平均相对分子质量: |
您最近半年使用:0次
2023-08-11更新
|
1241次组卷
|
26卷引用:辽宁省朝阳市建平县建平县实验中学2023-2024学年高二上学期开学考试化学试题
辽宁省朝阳市建平县建平县实验中学2023-2024学年高二上学期开学考试化学试题广东省东莞市二中2020-2021学年上学期高二10月考试化学试题辽宁省大连市普兰店第二中学2020-2021学年高二上学期期中考试化学试题内蒙古通辽市科左后旗甘旗卡第二高级中学2020-2021学年高二下学期开学考试化学试题四川省成都市实验外国语学校(西区)2019-2020 学年高二上学期期中考试化学试题江西省名校2021-2022学年高二上学期第一次月考化学试题安徽省淮北市树人高级中学2021-2022学年高二上学期第一次月考化学试题浙江省绍兴鲁迅中学2021-2022学年高二上学期第一次限时训练化学试题江西省新余市第四中学2021-2022学年高二上学期第一次月考化学试题(已下线)必考点03 化学平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版)安徽省亳州市第二中学2021-2022学年高二上学期期中考试化学试题广东省佛山市第一中学2021-2022学年高二上学期第一次段考化学试题 吉林省松原市长岭县第三中学2021-2022学年高二上学期第三次考试化学试题湖北省宜城市第三高级中学2021-2022学年高二上学期期中考试化学试卷题安徽省怀宁县第二中学2021-2022学年高二上学期期中考试化学试题大庆市肇州县肇州中学2021-2022学年高二上学期第二次月考化学试题广东省江门市第一中学2022-2023学年高二上学期第一次月考化学试题河南省平顶山市汝州第一高级中学2022-2023学年高二10月月考化学试题湖南省邵阳市武冈市2022-2023学年高二上学期期中考试化学试题(已下线)第06讲 化学反应速率与化学平衡的图像-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)湖南师范大学附属中学2022-2023学年高一下学期期末考试化学试题辽宁省鞍山市普通高中2022-2023学年高二上学期第一次月考化学试题山东学情2023-2024学年高二上学期10月质量检测(人教版)化学试题四川省仁寿第一中学校南校区2023-2024学年高二上学期10月月考化学试题浙江省湖州市吴兴高级中学2023-2024学年高二上学期10月阶段性测试化学试题天津市第四十七中学2023-2024学年高二上学期11月期中考试化学试题
4 . 已知反应 达平衡时,
达平衡时,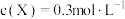 ,其他条件不变,若容器扩大到原来的2倍,再次达平衡时
,其他条件不变,若容器扩大到原来的2倍,再次达平衡时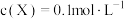 ,下列说法正确的是
,下列说法正确的是
 达平衡时,
达平衡时,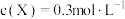 ,其他条件不变,若容器扩大到原来的2倍,再次达平衡时
,其他条件不变,若容器扩大到原来的2倍,再次达平衡时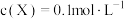 ,下列说法正确的是
,下列说法正确的是| A.反应向逆方向移动 | B. 可能是固体或液体 可能是固体或液体 |
C.系数 一定大于 一定大于 | D.再次平衡时,平衡常数增大 |
您最近半年使用:0次
2023-07-12更新
|
333次组卷
|
4卷引用:辽宁省朝阳市2022-2023学年高二下学期期末联考化学试题
辽宁省朝阳市2022-2023学年高二下学期期末联考化学试题辽宁省凌源市2022-2023学年高二下学期期末联考化学试题(已下线)实验03 探究外界条件对化学平衡移动的影响-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)课时3影响化学平衡的因素课堂例题
5 . 恒温下气体反应达到化学平衡,平衡常数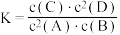 。恒容时,若降低温度,D的浓度增大。下列说法错误的是
。恒容时,若降低温度,D的浓度增大。下列说法错误的是
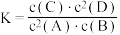 。恒容时,若降低温度,D的浓度增大。下列说法错误的是
。恒容时,若降低温度,D的浓度增大。下列说法错误的是A.该反应的化学方程式为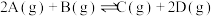 |
B.增大 减小 减小 |
C.恒容时,向容器中充入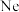 ,反应速率不变 ,反应速率不变 |
| D.正反应为放热反应 |
您最近半年使用:0次
2023-06-16更新
|
212次组卷
|
2卷引用:辽宁省凌源市普通高中2022-2023学年高二下学期6月月考化学试题
名校
解题方法
6 . 为实现碳中和,将 在一定条件下转化为化工原料,其中
在一定条件下转化为化工原料,其中 和
和 可发生如下两个平行反应:
可发生如下两个平行反应:
①

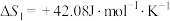
②

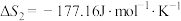
(1)根据所给信息,若要反应②自发进行,需要控制温度范围为_______ K(保留一位小数)。
(2)为了提高 的产率,理论上可采用的措施是
的产率,理论上可采用的措施是_______ (填标号)。
A.低温低压 B.高温低压 C.合适的催化剂 D.高温高压 E.低温高压
(3)将 和
和 按物质的量之比
按物质的量之比 通入刚性密闭容器中,在催化剂作用下发生反应①和反应②,在相同的时间内
通入刚性密闭容器中,在催化剂作用下发生反应①和反应②,在相同的时间内 的选择性和产率随温度的变化如下表所示。已知:X代表
的选择性和产率随温度的变化如下表所示。已知:X代表 的选择性
的选择性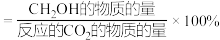 Y代表甲醇的产率%
Y代表甲醇的产率%
①在上述条件下合成甲醇的工业条件是_______ 。
A.483K B.503K C.催化剂 D.催化剂
D.催化剂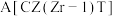
②503K以上,升高温度导致 的转化率增大,甲醇的产率降低。可能的原因是
的转化率增大,甲醇的产率降低。可能的原因是_______ 。
(4)在容器体积不变的条件下,下列说法中,能判断反应②达到平衡状态的有_______ (填标号)。
A.混合气体总压强不再变化
B.断裂3molH—H键的同时断裂2molO—H键
C. 和
和 的物质的量之比不再变化
的物质的量之比不再变化
D.混合气体的平均相对分子质量不再变化
E.混合气体的密度不再变化
F.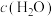 保持不变
保持不变
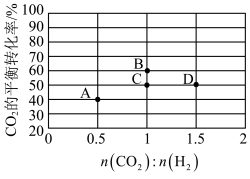
(5)若体积不变的密闭容器中只发生上述反应①,在进气比 不同、温度不同时,测得相应的
不同、温度不同时,测得相应的 平衡转化率如图所示。则B和D两点的温度
平衡转化率如图所示。则B和D两点的温度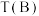
_______ 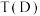 (选填“<”,“>”,或“=”),其原因是
(选填“<”,“>”,或“=”),其原因是_______ 。
 在一定条件下转化为化工原料,其中
在一定条件下转化为化工原料,其中 和
和 可发生如下两个平行反应:
可发生如下两个平行反应:①


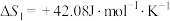
②


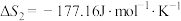
(1)根据所给信息,若要反应②自发进行,需要控制温度范围为
(2)为了提高
 的产率,理论上可采用的措施是
的产率,理论上可采用的措施是A.低温低压 B.高温低压 C.合适的催化剂 D.高温高压 E.低温高压
(3)将
 和
和 按物质的量之比
按物质的量之比 通入刚性密闭容器中,在催化剂作用下发生反应①和反应②,在相同的时间内
通入刚性密闭容器中,在催化剂作用下发生反应①和反应②,在相同的时间内 的选择性和产率随温度的变化如下表所示。已知:X代表
的选择性和产率随温度的变化如下表所示。已知:X代表 的选择性
的选择性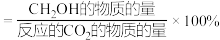 Y代表甲醇的产率%
Y代表甲醇的产率%| 温度/K | 催化剂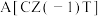 | 催化剂 | ||
| X(甲醇选择性) | Y(甲醇产率) | X(甲醇选择性) | Y(甲醇产率) | |
| 483 | 38 | 2 | 19 | 0.9 |
| 503 | 26 | 4.5 | 33 | 2.2 |
| 523 | 23 | 3.9 | 30 | 1.9 |
| 543 | 18 | 3 | 25 | 1.8 |
| 563 | 16 | 3 | 25 | 1.6 |
A.483K B.503K C.催化剂
 D.催化剂
D.催化剂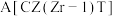
②503K以上,升高温度导致
 的转化率增大,甲醇的产率降低。可能的原因是
的转化率增大,甲醇的产率降低。可能的原因是(4)在容器体积不变的条件下,下列说法中,能判断反应②达到平衡状态的有
A.混合气体总压强不再变化
B.断裂3molH—H键的同时断裂2molO—H键
C.
 和
和 的物质的量之比不再变化
的物质的量之比不再变化D.混合气体的平均相对分子质量不再变化
E.混合气体的密度不再变化
F.
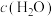 保持不变
保持不变(5)若体积不变的密闭容器中只发生上述反应①,在进气比
 不同、温度不同时,测得相应的
不同、温度不同时,测得相应的 平衡转化率如图所示。则B和D两点的温度
平衡转化率如图所示。则B和D两点的温度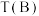
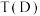 (选填“<”,“>”,或“=”),其原因是
(选填“<”,“>”,或“=”),其原因是
您最近半年使用:0次
2023-05-06更新
|
549次组卷
|
2卷引用:辽宁省2023届高三第二次全省统考化学试题
名校
7 . 下列现象不能用勒夏特列原理解释的是
| A.为了准确测定NO2的相对分子质量,应尽量在高温低压条件下测定 |
| B.实验室制备乙酸乙酯,加入过量的乙醇 |
| C.实验室制备氯气,选用饱和食盐水净化氯气 |
| D.工业上选择高温条件和铁触媒作催化剂合成氨 |
您最近半年使用:0次
名校
解题方法
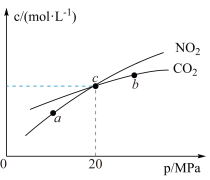
8 . 在恒温的密闭容器中,加入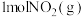 和足量活性炭发生反应
和足量活性炭发生反应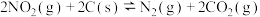 ,测得平衡时
,测得平衡时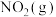 和
和 的物质的量浓度与平衡总压的关系如图所示(
的物质的量浓度与平衡总压的关系如图所示( 为以分压表示的平衡常数,分压
为以分压表示的平衡常数,分压 总压
总压 物质的量分数)。下列说法错误的是
物质的量分数)。下列说法错误的是
 和足量活性炭发生反应
和足量活性炭发生反应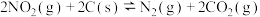 ,测得平衡时
,测得平衡时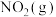 和
和 的物质的量浓度与平衡总压的关系如图所示(
的物质的量浓度与平衡总压的关系如图所示( 为以分压表示的平衡常数,分压
为以分压表示的平衡常数,分压 总压
总压 物质的量分数)。下列说法错误的是
物质的量分数)。下列说法错误的是
A.图示的三个点中,a点 的转化率最高 的转化率最高 |
B.该温度下, 点的 点的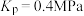 |
| C.减小容器体积可实现从c点到b点的移动 |
D.a、b、c三点的 大小相同 大小相同 |
您最近半年使用:0次
2022-11-12更新
|
341次组卷
|
12卷引用:辽宁省朝阳市凌源市实验中学2022-2023学年高二上学期1月月考化学试题
辽宁省朝阳市凌源市实验中学2022-2023学年高二上学期1月月考化学试题湖南省部分学校2022-2023学年高二上学期期中考试化学试题江西省赣州市十六县(市)二十校2022-2023学年高二上学期期中联考化学试题河北省邢台市南和区第一中学2022-2023学年高二上学期期中考试化学试题江西省赣州市重点中学六校2022-2023学年高二上学期期中联考化学试题河北省部分学校2022-2023学年高二上学期期中考试化学试题湖北省部分学校2022-2023学年高二上学期期中考试化学试题河南省新乡市长垣市2022-2023学年高二上学期11月期中考试化学试题辽宁省抚顺市六校协作体2022-2023学年高二上学期期中考试化学试题辽宁省东北育才中学少儿部2023-2024学年高二上学期第一次月考化学试题江西省宜春市上高二中2023-2024学年高二上学期第二次月考化学试题河南省获嘉县第一中学2023-2024学年高二上学期第一次月考化学试卷
名校
解题方法
9 . “碳中和”是指企业、团体或个人测算在一定时间内,直接或间接产生的温室气体排放总量,通过植树造林、节能减排等形式,抵消自身产生的二氧化碳排放,实现二氧化碳的“零排放”。简单地说,也就是让二氧化碳排放量“收支相抵”。利用CO2合成二甲醚在近年来深受人们的关注,可以很大程度地帮助实现“碳中和”,其合成过程由两种工艺组成。
工艺1:先在设备一加氢合成甲醇,涉及以下主要反应:
Ⅰ.甲醇的合成:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
Ⅱ.逆水汽变换:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.2kJ·mol-1
CO(g)+H2O(g) △H2=+41.2kJ·mol-1
再通过设备二由甲醇脱水合成二甲醚。
Ⅲ.甲醇脱水:2CH3OH(g) CH3OCH3(g)+H2O(g) △H3=-23.9kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-23.9kJ·mol-1
工艺2:在双功能催化剂作用下,由CO2加氢直接得到二甲醚。
请回答:
(1)请写出工艺2中CO2直接加氢合成CH3OCH3(g)(反应Ⅳ)的热化学方程式为_______ 。
(2)向一绝热恒容密闭容器中充入等物质的量的CO2和H2进行反应Ⅱ,下面不能判断该反应已达到平衡状态的是_______ ;
A.混合气体的密度保持不变
B.总压强不变
C.平衡常数不变
D.容器中n(CO2)/n(H2O)的值保持不变
E.CO2和H2的体积比保持不变
(3)①工艺1需先在设备一先合成甲醇。在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。

下列说法正确的是_______ 。
A.图甲纵坐标表示CH3OH的平衡产率
B.P1<P2<P3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压的反应条件
D.一定温度、压强下,寻找活性更高的催化剂,是提高CO2的平衡转化率的主要研究方向
②解释图乙不同压强下CO2的平衡转化率在550℃后趋于相等的原因_______ 。
(4)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应II,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。
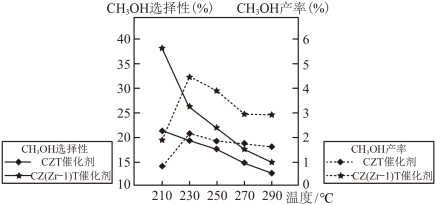
其中:CH3OH的选择性=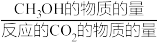 ×100%
×100%
在上述条件下合成甲醇的工业条件是_______。
(5)恒温恒压密闭容器中,加入2molCO2和4molH2,只发生反应I和反应II,初始压强为p0,在300℃发生反应,反应达平衡时,CO2的转化率为50%,容器体积减小20%。则达到平衡时H2的转化率为_______ ,反应II的平衡常数K=_______ (保留两位有效数字)。
工艺1:先在设备一加氢合成甲醇,涉及以下主要反应:
Ⅰ.甲醇的合成:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1Ⅱ.逆水汽变换:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.2kJ·mol-1
CO(g)+H2O(g) △H2=+41.2kJ·mol-1再通过设备二由甲醇脱水合成二甲醚。
Ⅲ.甲醇脱水:2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H3=-23.9kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-23.9kJ·mol-1工艺2:在双功能催化剂作用下,由CO2加氢直接得到二甲醚。
请回答:
(1)请写出工艺2中CO2直接加氢合成CH3OCH3(g)(反应Ⅳ)的热化学方程式为
(2)向一绝热恒容密闭容器中充入等物质的量的CO2和H2进行反应Ⅱ,下面不能判断该反应已达到平衡状态的是
A.混合气体的密度保持不变
B.总压强不变
C.平衡常数不变
D.容器中n(CO2)/n(H2O)的值保持不变
E.CO2和H2的体积比保持不变
(3)①工艺1需先在设备一先合成甲醇。在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。

下列说法正确的是
A.图甲纵坐标表示CH3OH的平衡产率
B.P1<P2<P3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压的反应条件
D.一定温度、压强下,寻找活性更高的催化剂,是提高CO2的平衡转化率的主要研究方向
②解释图乙不同压强下CO2的平衡转化率在550℃后趋于相等的原因
(4)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应II,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。

其中:CH3OH的选择性=
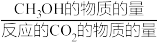 ×100%
×100%在上述条件下合成甲醇的工业条件是_______。
| A.210℃ | B.230℃ | C.催化CZT | D.催化剂CZ(Zr-1)T |
您最近半年使用:0次
2022-11-05更新
|
402次组卷
|
3卷引用:辽宁省朝阳市部分学校2022-2023学年高二下学期期末考试化学试题
名校
10 . 2SO2(g)+O2(g) 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列说法正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列说法正确的是
 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列说法正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列说法正确的是| 容器 | 甲 | 乙 | 丙 | |
| 起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率/% | 80 | α1 | α2 | |
| A.该温度下,平衡常数值为200 |
| B.乙中反应的平衡常数小于丙 |
| C.平衡时,丙中c(SO3)是甲中的2倍 |
| D.平衡时,乙中O2的转化率大于甲中O2的转化率 |
您最近半年使用:0次
2022-09-22更新
|
129次组卷
|
5卷引用:辽宁省凌源市2022-2023学年高二上学期10月月考化学试题



