名校
解题方法
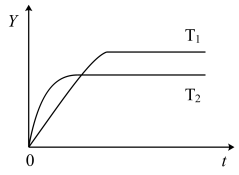
1 . 温度为T时,在2 L容积不变的密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论错误 的是
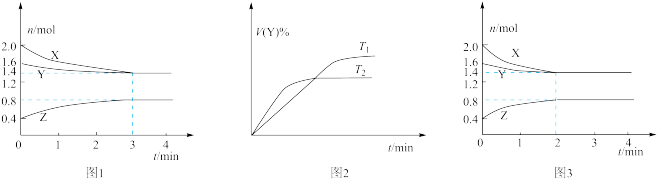

A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g) 2Z(g) |
| B.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂 |
| C.反应进行的前3 min内,用X表示的反应速率v(X)=0.1 mol·L-1·min-1 |
| D.保持其他条件不变,升高温度,平衡逆向移动 |
您最近半年使用:0次
2022-10-22更新
|
76次组卷
|
6卷引用:北京市顺义牛栏山第一中学2022-2023学年高二上学期10月月考化学试题
北京市顺义牛栏山第一中学2022-2023学年高二上学期10月月考化学试题北京市顺义区第一中学2023-2024学年高二上学期10月月考化学试题(已下线)09-10年万州二中高二下学期期末考试化学卷(已下线)2011届四川省资阳市资阳中学高三第一次高考模拟(理综)化学部分(已下线)2013-2014黑龙江省鹤岗一中高一下学期期末考试化学试卷(已下线)2014~2015学年江西四校9月联考高二化学试卷
名校
解题方法
2 . 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间t(单位为分钟)变化的曲线如图,下列描述正确的是
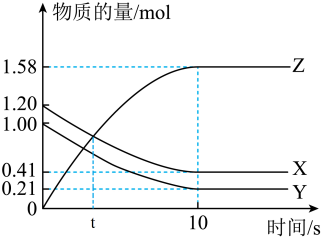

| A.t分钟时该反应达到化学平衡状态 |
B.反应开始到10分钟,用X表示的反应速率为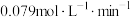 |
| C.反应开始到10分钟时,Y的转化率为79.0% |
D.反应的化学方程式为: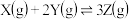 |
您最近半年使用:0次
2022-10-08更新
|
516次组卷
|
6卷引用:北京市顺义区杨镇第一中学2021-2022学年高一下学期期中考试化学试题
名校
3 . 已知反应2SO2(g)+O2(g) 2SO3(g);ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入SO2和O2,在一定条件下发生反应。下图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是
2SO3(g);ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入SO2和O2,在一定条件下发生反应。下图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是
 2SO3(g);ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入SO2和O2,在一定条件下发生反应。下图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是
2SO3(g);ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入SO2和O2,在一定条件下发生反应。下图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是
| A.SO2的转化率 | B.混合气体的密度 |
| C.密闭容器内的压强 | D.SO3的体积分数 |
您最近半年使用:0次
4 . 合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应N2(g)+3H2(g)⇌2NH3(g)的化学平衡常数表达式为_______ 。
(2)对于反应N2(g)+3H2(g)⇌2NH3(g),在一定条件下氨的平衡含量如下表。
①该反应为_______ (填“吸热”或“放热”)反应。
②其他条件不变时,温度升高氨的平衡含量减小的原因是_______ (填字母序号)。
a.温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b.温度升高,浓度商(Q)变大,Q>K,平衡逆向移动
c.温度升高,活化分子数增多,反应速率加快
d.温度升高,K变小,平衡逆向移动
(3)一定温度下,在容积恒定的密闭容器中充入1 mol 氮气和3 mol氢气,一段时间后达化学平衡状态。若保持其他条件不变,向上述平衡体系中再充入1 mol氮气和3 mol 氢气,氮气的平衡转化率_______ (填“变大”“变小”或“不变”)。
(4)原料气H2可通过反应 CH4(g)+H2O(g)⇌CO(g) + 3H2(g)获取,已知该反应中当初始混合气中的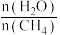 恒定时,温度、压强对平衡混合气CH4含量的影响如下图:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图:
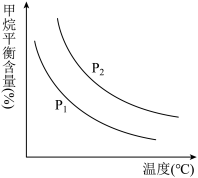
①图中,两条曲线表示压强的关系是:P1_______ P2(填“>”、“=”或“<”)。
②该反应为_______ 反应(填“吸热”或“放热”)。
(5)原料气H2还可通过反应CO(g)+H2O(g)⇌CO2(g)+H2(g)获取。
①T℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为_______ ,该温度下反应的平衡常数K值为_______ 。
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_______ (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
(1)反应N2(g)+3H2(g)⇌2NH3(g)的化学平衡常数表达式为
(2)对于反应N2(g)+3H2(g)⇌2NH3(g),在一定条件下氨的平衡含量如下表。
| 温度/℃ | 压强/MPa | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
②其他条件不变时,温度升高氨的平衡含量减小的原因是
a.温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b.温度升高,浓度商(Q)变大,Q>K,平衡逆向移动
c.温度升高,活化分子数增多,反应速率加快
d.温度升高,K变小,平衡逆向移动
(3)一定温度下,在容积恒定的密闭容器中充入1 mol 氮气和3 mol氢气,一段时间后达化学平衡状态。若保持其他条件不变,向上述平衡体系中再充入1 mol氮气和3 mol 氢气,氮气的平衡转化率
(4)原料气H2可通过反应 CH4(g)+H2O(g)⇌CO(g) + 3H2(g)获取,已知该反应中当初始混合气中的
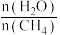 恒定时,温度、压强对平衡混合气CH4含量的影响如下图:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图:
①图中,两条曲线表示压强的关系是:P1
②该反应为
(5)原料气H2还可通过反应CO(g)+H2O(g)⇌CO2(g)+H2(g)获取。
①T℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
您最近半年使用:0次
5 . 对于2A(g)+B(g) 2C(g) △H<0,下列图象正确的是
2C(g) △H<0,下列图象正确的是
 2C(g) △H<0,下列图象正确的是
2C(g) △H<0,下列图象正确的是A.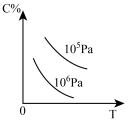 | B. | C. | D. |
您最近半年使用:0次
22-23高三上·江苏南京·阶段练习
名校
解题方法
6 . 将金红石(TiO2)转化为TiCl4是生产金属钛的关键步骤。在1.0×105Pa,将TiO2、C、Cl2以物质的量比1:2:2进行反应,平衡体系中主要物质的物质的量分数(x)随温度变化理论计算结果如图所示。
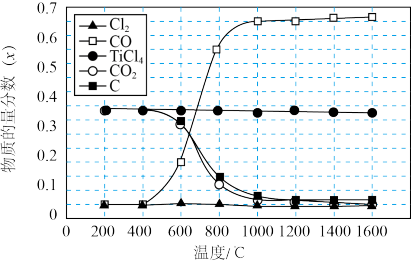
下列说法不 正确的是

下列说法
| A.200~1600℃反应达到平衡时,TiO2的转化率均已接近100% |
B.将400℃时的平衡体系加热至800℃,平衡C(s)+CO2(g) 2CO(g)向正反应方向移动 2CO(g)向正反应方向移动 |
| C.1000℃时,测得某时刻x(TiCl4)=0.2.其他条件不变,延长反应时间能使x(TiCl4)超过该温度下平衡时的x(TiCl4) |
| D.实际生产时反应温度选择900℃而不选择200℃,其主要原因是:900℃比200℃时化学反应速率更快,生产效益更高 |
您最近半年使用:0次
2022-09-08更新
|
1089次组卷
|
8卷引用:2022年北京高考真题化学试题变式题(选择题11-14)
(已下线)2022年北京高考真题化学试题变式题(选择题11-14)江苏省南京市2023届高三9月学情调研化学试题浙江省舟山市舟山中学2022-2023学年国庆返校检测高三化学试题江苏省南京师范大学附属中学江宁分校2022-2023学年高三上学期期末检测化学试题江苏省常州市2022-2023学年高二下学期3月联合调研考试化学试题(已下线)题型23 平衡常数、平衡转化率图象(已下线)题型04 化学反应速率与平衡图像分析-2024年高考化学答题技巧与模板构建江苏省无锡市第一中学2023-2024学年高三上学期综合练习(三)化学试题
22-23高三上·重庆·阶段练习
名校
解题方法
7 . 利用丙烷(C3H8)在无氧条件下制备丙烯(C3H6)的反应方程式为:C3H8(g) C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
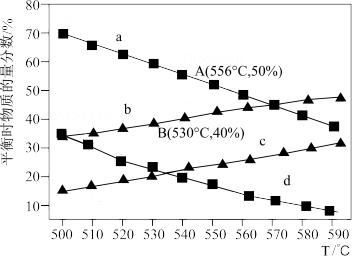
 C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
| A.c曲线表示的是0.01MPa压强下丙烯随温度变化的物质的量分数 |
| B.A点对应的该反应平衡常数Kp=1.25MPa(Kp为以分压表示的平衡常数) |
| C.B点丙烷的平衡转化率为33.3% |
| D.实际生产过程中需通入一定量水蒸气,其目的是稀释原料气,增大丙烯的平衡产率 |
您最近半年使用:0次
2022-09-04更新
|
1471次组卷
|
5卷引用:2022年北京高考真题变式题1-14
(已下线)2022年北京高考真题变式题1-14(已下线)2022年北京高考真题化学试题变式题(选择题11-14)重庆市南开中学校2022-2023学年高三上学期第一次质量检测联考化学试题黑龙江省牡丹江市第一高级中学2022-2023学年高二10月月考化学试题重庆市南开中学2022-2023学年高三上学期第一次质检化学试题
8 . 某兴趣小组同学探究 酸性溶液与草酸
酸性溶液与草酸 溶液反应速率的影响因素。将
溶液反应速率的影响因素。将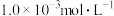 的
的 酸性溶液与
酸性溶液与 草酸溶液按如下比例混合。
草酸溶液按如下比例混合。
【设计实验】
(1)补全 酸性溶液与草酸溶液反应的离子方程式:
酸性溶液与草酸溶液反应的离子方程式:_______ 。

(2)实验①和②的目的是_______ 。
【进行实验】
小组同学进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
Ⅰ.紫色溶液变为青色溶液;Ⅱ.青色溶液逐渐褪至无色溶液。
【查阅资料】
a. 酸性溶液与草酸溶液的反应主要包含如下几个过程:
酸性溶液与草酸溶液的反应主要包含如下几个过程:
反应ⅰ.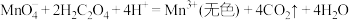
反应ⅱ.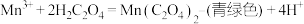
反应ⅲ。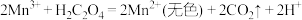
b. 的氧化性较弱,在本实验条件下不能氧化
的氧化性较弱,在本实验条件下不能氧化 。
。
c. 呈绿色,在酸性条件下不稳定,迅速分解为
呈绿色,在酸性条件下不稳定,迅速分解为 和
和 。
。
【继续探究】
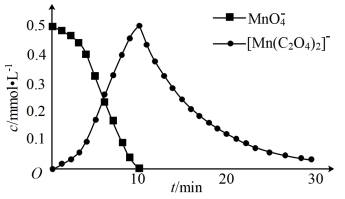
进一步实验证明溶液中含有 ,实验①反应过程中
,实验①反应过程中 和
和 的浓度随时间的变化如下图。
的浓度随时间的变化如下图。
【解释与反思】
(3)本实验中,化学反应速率:反应ⅱ_______ 反应ⅲ(填“>”、“=”或“<”)。
(4)小组同学认为反应ⅱ的离子方程式应该改为: ,结合实验现象,说明其理由
,结合实验现象,说明其理由_______ 。
 酸性溶液与草酸
酸性溶液与草酸 溶液反应速率的影响因素。将
溶液反应速率的影响因素。将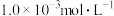 的
的 酸性溶液与
酸性溶液与 草酸溶液按如下比例混合。
草酸溶液按如下比例混合。【设计实验】
| 序号 | V( 酸性溶液)/ 酸性溶液)/ | V(草酸溶液)/ | 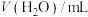 | 反应温度/ |
| ① | 2.0 | 2.0 | 0 | 20 |
| ② | 2.0 | 1.0 | 1.0 | 20 |
 酸性溶液与草酸溶液反应的离子方程式:
酸性溶液与草酸溶液反应的离子方程式:
(2)实验①和②的目的是
【进行实验】
小组同学进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
Ⅰ.紫色溶液变为青色溶液;Ⅱ.青色溶液逐渐褪至无色溶液。
【查阅资料】
a.
 酸性溶液与草酸溶液的反应主要包含如下几个过程:
酸性溶液与草酸溶液的反应主要包含如下几个过程:反应ⅰ.
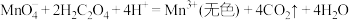
反应ⅱ.
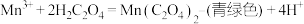
反应ⅲ。
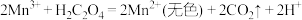
b.
 的氧化性较弱,在本实验条件下不能氧化
的氧化性较弱,在本实验条件下不能氧化 。
。c.
 呈绿色,在酸性条件下不稳定,迅速分解为
呈绿色,在酸性条件下不稳定,迅速分解为 和
和 。
。【继续探究】
进一步实验证明溶液中含有
 ,实验①反应过程中
,实验①反应过程中 和
和 的浓度随时间的变化如下图。
的浓度随时间的变化如下图。
【解释与反思】
(3)本实验中,化学反应速率:反应ⅱ
(4)小组同学认为反应ⅱ的离子方程式应该改为:
 ,结合实验现象,说明其理由
,结合实验现象,说明其理由
您最近半年使用:0次
名校
解题方法
9 . 合成氨是人类科技发展史上的一项重大突破。已知:在一定条件下,N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1
2NH3(g) ΔH=-92.4kJ·mol-1
(1)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是___________ 。
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.3v(N2)正=v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2)将N2和H2通入体积为2L的恒温恒容密闭容器中,5min后达到化学平衡,测得NH3的浓度为0.2mol/L,这段时间内用N2的浓度变化表示的化学反应速率为___________ mol/(L·min)。
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。
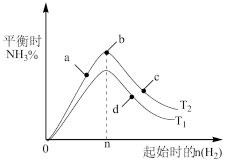
①图象中T2和T1的关系是:T2___________ T1(填“>,<或=”)
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是___________ (填字母)。
(4)下图是某压强下,密闭容器中,N2和H2按物质的量浓度分别1mol/L和3mol/L投料进行反应,反应混合物中NH3的物质的量分数随温度的变化曲线。Ⅰ是平衡时的曲线,Ⅱ是不同温度下反应经过相同时间测得的曲线。
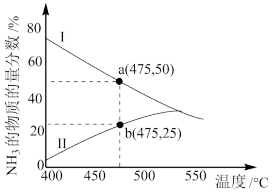
①图中a点,容器内n(N2)∶n(NH3)=____________
②图中a点条件下该反应的化学平衡常数K=___________ 。(用分数表示)
③图中b点,υ正___________ υ逆(填“>”、“<”或“=”)。
④400~530℃,Ⅱ中NH3的物质的量分数随温度升高而增大,主要原因是___________ 。
 2NH3(g) ΔH=-92.4kJ·mol-1
2NH3(g) ΔH=-92.4kJ·mol-1(1)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.3v(N2)正=v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2)将N2和H2通入体积为2L的恒温恒容密闭容器中,5min后达到化学平衡,测得NH3的浓度为0.2mol/L,这段时间内用N2的浓度变化表示的化学反应速率为
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图象中T2和T1的关系是:T2
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是
(4)下图是某压强下,密闭容器中,N2和H2按物质的量浓度分别1mol/L和3mol/L投料进行反应,反应混合物中NH3的物质的量分数随温度的变化曲线。Ⅰ是平衡时的曲线,Ⅱ是不同温度下反应经过相同时间测得的曲线。

①图中a点,容器内n(N2)∶n(NH3)=
②图中a点条件下该反应的化学平衡常数K=
③图中b点,υ正
④400~530℃,Ⅱ中NH3的物质的量分数随温度升高而增大,主要原因是
您最近半年使用:0次
名校
解题方法
10 . 下列叙述与图像相符的是
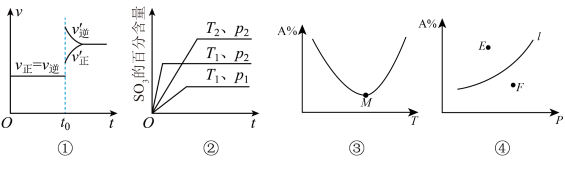

A.图①表示反应2SO2(g)+O2(g) 2SO3(g)达到平衡后在t0时刻充入了一定量的SO3 2SO3(g)达到平衡后在t0时刻充入了一定量的SO3 |
B.图②可满足反应2SO2(g)+O2(g) 2SO3(g) ΔH<0 2SO3(g) ΔH<0 |
C.图③表示反应aA(g)+bB(g) cC(g),在容器中充入1molA和1molB,经过相同时间容器中A的百分含量随温度的变化,可知反应ΔH>0 cC(g),在容器中充入1molA和1molB,经过相同时间容器中A的百分含量随温度的变化,可知反应ΔH>0 |
D.图④表示反应aA(g)+bB(g) cC(g)平衡时A的百分含量随压强的变化,可知E点v(逆)>v(正) cC(g)平衡时A的百分含量随压强的变化,可知E点v(逆)>v(正) |
您最近半年使用:0次
2021-11-23更新
|
833次组卷
|
9卷引用:北京市第五十五中学2021-2022学年高二上学期期中考试化学试题
北京市第五十五中学2021-2022学年高二上学期期中考试化学试题北京市第五十五中学2022-2023学年高二上学期期中考试化学试题北京市第一○一中学2023-2024学年高二上学期期中练习化学试题浙江省杭州地区(含周边)重点中学2021-2022学年高二上学期期中联考化学试题浙江省金华第一中学2021-2022学年高一上学期领军班期末联考化学试题(已下线)专题24 化学平衡图像题的突破-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)浙江省金华一中(领军班)2021-2022学年高一上学期期末化学试题河南省兰考县第二高级中学2021-2022学年高二上学期第三次考试化学试题甘肃省张掖市2022-2023学年高二下学期第一次全市联考化学试题



