11-12高二上·安徽淮北·期中
名校
1 . 已知FeO(s) +C(s)= CO(g) + Fe(s) △H>0,下列叙述正确的是
| A.低温下为自发过程,高温下为非自发过程 | B.任何温度下为非自发过程 |
| C.高温下为自发过程,低温下为非自发过程 | D.任何温度下为自发过程 |
您最近一年使用:0次
2022-10-26更新
|
466次组卷
|
25卷引用:【全国百强校】黑龙江省鹤岗市第一中学2018-2019学年高二上学期第一次月考(10月)化学试题
【全国百强校】黑龙江省鹤岗市第一中学2018-2019学年高二上学期第一次月考(10月)化学试题黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期第一次月考化学试题(已下线)2011-2012学年安徽省濉溪县临涣中学高二上学期期中联考化学试卷(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(A)卷(已下线)2014秋安徽省宿州市高二上学期期中化学(理)试卷2015-2016学年安徽省舒城晓天中学高二上学期期中测试化学试卷【全国百强校】江苏省南菁高级中学2017-2018学年高二下学期期中考试化学试题安徽省新城高升学校2018-2019学年高二上学期期中考试化学试题广西南宁市“4N”高中联合体2018-2019学年高二下学期期末考试化学试题云南省普洱市澜沧县第一中学2018-2019学年高二下学期期末考试化学试题云南省普洱市澜沧县民族中学2018-2019学年高二下学期期末考试化学试题河南省鹤壁市浚县二中2019-2020学年高二上学期第二次月考化学试题安徽省亳州市第十八中学2019-2020学年高二上学期第一次月考化学试题2020年春季人教版高中化学选修4第二章《化学反应速率和化学平衡》测试卷人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第三节 化学反应的方向 作业帮(已下线)第二章 化学反应速率与化学平衡(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第1节 化学反应的方向安徽省蚌埠田家炳中学2020-2021学年高二12月月考化学试题重庆市铁路中学校2020-2021学年高二上学期11月月考化学试题贵州省贵阳市清镇养正学校2019-2020学年高二上学期期中考试化学试题吉林省延吉市第一高级中学2021-2022年学年高二上学期期中考试化学试题湖北省黄州中学2022--2023学年高二上学期10月月考化学试题四川省宜宾市第四中学校2022-2023学年高二上学期期中考试化学试题新疆喀什地区疏附县第一中学2022-2023学年高二上学期期末考试化学试题百所名校联考-化学反应速率与化学平衡
名校
2 . 下列说法正确的是
A.可逆反应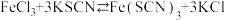 达到平衡后,加入 达到平衡后,加入 固体,逆反应速率加快 固体,逆反应速率加快 |
B.工业上合成 常选择500℃时进行而不是常温,是基于勒夏特列原理考虑的 常选择500℃时进行而不是常温,是基于勒夏特列原理考虑的 |
C.反应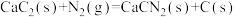 能自发进行,是因为 能自发进行,是因为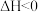 |
D.在装有2mL和1mL0.1mol/L 溶液的二支试管中,分别添加足量稀硫酸,观察浑浊产生的时间或产生气体的多少即可判断反应的快慢 溶液的二支试管中,分别添加足量稀硫酸,观察浑浊产生的时间或产生气体的多少即可判断反应的快慢 |
您最近一年使用:0次
名校
解题方法
3 . (I)在某恒容密闭容器中通入等物质的量的CO和NO,在不同温度(T)下发生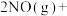
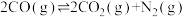 反应时,
反应时,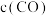 随时间
随时间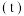 的变化曲线如图所示。已知该反应的
的变化曲线如图所示。已知该反应的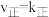
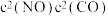 ,
,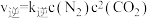 (
( ,
, 送为速率常数,只与温度有关)。
送为速率常数,只与温度有关)。
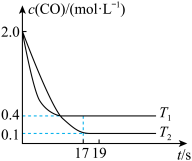
(1)温度为 时,达到平衡时NO的转化率为
时,达到平衡时NO的转化率为___________ 。
(2)温度为 时,若平衡后升高温度,则
时,若平衡后升高温度,则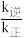
___________ (填“增大”、“不变”或“减小”)。
(II)目前工业上可利用CO或 来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数
来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数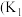 、、
、、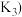 如下表所示:
如下表所示:
请回答下列问题:
(3)根据反应①与②可推导出 、
、 与
与 之间的关系,则
之间的关系,则
___________ (用 、
、 表示);
表示);
(4)根据反应③判断熵变
___________ 0(填“>”“=”或“<”),依据反应自发进行的判据: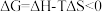 时可自发进行,判断:在
时可自发进行,判断:在___________ 填“较高”或“较低”)温度下有利于该反应自发进行。
(5)500℃下,测得反应③在某时刻时, 、
、 、
、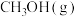 、
、 的浓度分别为
的浓度分别为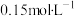 、
、 、
、 、
、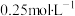 ,则此时
,则此时
___________  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
(6)要提高反应③的反应速率,同时增大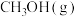 的产率,可采取的措施有___________(填字母代号)。
的产率,可采取的措施有___________(填字母代号)。
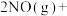
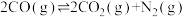 反应时,
反应时,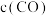 随时间
随时间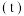 的变化曲线如图所示。已知该反应的
的变化曲线如图所示。已知该反应的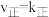
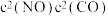 ,
,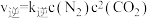 (
( ,
, 送为速率常数,只与温度有关)。
送为速率常数,只与温度有关)。
(1)温度为
 时,达到平衡时NO的转化率为
时,达到平衡时NO的转化率为(2)温度为
 时,若平衡后升高温度,则
时,若平衡后升高温度,则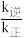
(II)目前工业上可利用CO或
 来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数
来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数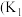 、、
、、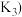 如下表所示:
如下表所示:| 化学反应 | 平衡 常数 | 平衡常数 | ||
| 500℃ | 700℃ | 800℃ | ||
①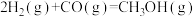 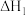 |  | 2.5 | 0.34 | 0.15 |
②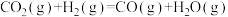 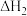 |  | 1.0 | 1.70 | 2.52 |
③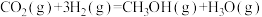 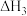 |  | |||
(3)根据反应①与②可推导出
 、
、 与
与 之间的关系,则
之间的关系,则
 、
、 表示);
表示);(4)根据反应③判断熵变

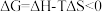 时可自发进行,判断:在
时可自发进行,判断:在(5)500℃下,测得反应③在某时刻时,
 、
、 、
、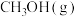 、
、 的浓度分别为
的浓度分别为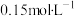 、
、 、
、 、
、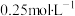 ,则此时
,则此时
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(6)要提高反应③的反应速率,同时增大
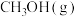 的产率,可采取的措施有___________(填字母代号)。
的产率,可采取的措施有___________(填字母代号)。| A.扩大反应容器的容积 | B.使用合适的催化剂 |
| C.缩小反应容器的容积 | D.从平衡体系中及时分离出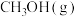 |
您最近一年使用:0次
名校
解题方法
4 . 下列关于焓判据和熵判据的说法中,不正确的是
| A.放热的自发过程可能是熵减小的过程,吸热的自发过程一定为熵增加的过程 |
B.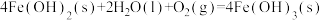 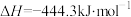 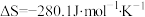 在常温常压下能自发进行 在常温常压下能自发进行 |
| C.碳酸钙分解为吸热反应,该反应室温下不能自发进行,但在较高温度(1200K)下则能自发进行 |
D.AB型强电解质在水中的溶解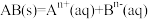 其焓变 其焓变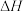 可能大于零或小于零,熵变 可能大于零或小于零,熵变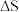 一定大于零 一定大于零 |
您最近一年使用:0次
名校
5 . 下列叙述不正确的是
| A.混乱度增大的放热反应能自发进行 |
| B.碳酸氢钠加热可以分解,因为升高温度利于熵增方向的反应自发进行 |
C.在温度、压强一定条件卜,自发反应总是向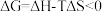 的方向进行 的方向进行 |
| D.水结冰的过程不能自发进行的原因是此过程熵减,改变条件也不可能自发进行 |
您最近一年使用:0次
20-21高二·全国·单元测试
名校
解题方法
6 . 下列对化学反应预测正确的是
| 选项 | 化学反应方程式 | 已知条件 | 预测 |
| A | 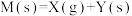 | 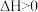 | 它一定是非自发反应 |
| B | 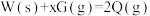 | 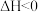 ,自发反应 ,自发反应 | x可以等于3 |
| C |  | 能自发反应 | 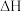 一定小于0 一定小于0 |
| D | 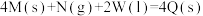 | 常温下,自发进行 | 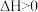 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-10-14更新
|
603次组卷
|
15卷引用:黑龙江省五校(嫩江市第一中学、嫩江市职业高中、伊拉哈中学、海江中学等)2021-2022学年高二上学期期中联考化学试题
黑龙江省五校(嫩江市第一中学、嫩江市职业高中、伊拉哈中学、海江中学等)2021-2022学年高二上学期期中联考化学试题(已下线)第2章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)河北省迁安市第一中学2020-2021学年高二上学期期中考试化学试题(已下线)2.3 化学反应的方向(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)新疆和田地区皮山县高级中学2021-2022学年高二上学期期末考试化学试题山东省日照实验高级中学2022-2023学年高二上学期10月月考化学试题山东省菏泽市郓城第一中学2022-2023学年高二上学期自我检测(10月)化学试题重庆市2022-2023学年高二上学期12月调研考试化学试题河北省保定市2022-2023学年高二上学期1月期末考试化学试题浙江省宁波效实中学2022-2023学年高二上学期期中考试化学试题广东省广州市三校(广附,铁一,广外)2022-2023学年高二上学期期末联考化学试题宁夏回族自治区银川一中2022-2023学年高二上学期期末考试化学试题四川省青神中学校2022-2023学年高二下学期3月月考化学试题广东省梅州市大埔县虎山中学2023-2024学年高二上学期10月期中考试化学试题(已下线)第28练 化学反应的方向-2023年高考化学一轮复习小题多维练(全国通用)
名校
7 . 下列说法错误的是
| A.ΔH<0,ΔS>0 的反应一定能自发进行 |
| B.一定温度下,反应 MgCl2(l)=Mg(l)+Cl2(g)的ΔH>0、ΔS>0 |
| C.反应 NH3(g)+HCl(g)=NH4Cl(s) 在室温下可自发进行,则该反应的ΔH>0 |
| D.NH4HCO3(g)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
您最近一年使用:0次
2022-10-04更新
|
337次组卷
|
5卷引用:黑龙江省牡丹江穆棱市第二中学2021-2022学年高二上学期期末考试化学试题
名校
8 . 对于反应 ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是A.反应的 |
B.反应的平衡常数可表示为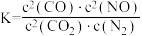 |
| C.保持其他条件不变,升高温度,反应体系的活化分子百分数增大 |
D.使用合适的催化剂能降低该反应的活化能从而改变该反应的 |
您最近一年使用:0次
2022-10-01更新
|
442次组卷
|
5卷引用:黑龙江省哈尔滨市第三中学校2022-2023学年高二上学期第三次验收考试化学试题
9 . Ⅰ.氨的工业合成工艺的成熟推动了人类文明的进步,不少科技工作者为了寻找廉价的氨的制备方法,进行了前赴后继的探索性工作。用氢气和氮气合成氨是一个可逆反应,化学方程式为N2+3H2 2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
(1)请写出该反应的热化学方程式:_______ 。
(2)如果一个反应的ΔH—TΔS<0,则该反应能够自发进行。已知上述氨的合成反应的ΔS=—198.2 J·mol-1·K-1,则其在常温下_______ (填“能”或“不能”)自发进行。
Ⅱ.已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(3)该反应的平衡常数表达式K=_______ ,ΔH=_______ (填“<”“>”或“=”)0。
(4)830℃时,向一个5 L的密闭容器中充入0.20 mol A和0.80 mol B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s时,c(A)=_______ mol·L-1,C的物质的量为_______ mol;若反应经一段时间后,达到平衡时A的转化率为_______ ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_______ 。
(5)判断该反应是否达到平衡的依据为_______ 。
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(6)1200℃时,反应C(g)+D(g) A(g)+B(g)的平衡常数的值为
A(g)+B(g)的平衡常数的值为_______ 。
 2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。(1)请写出该反应的热化学方程式:
(2)如果一个反应的ΔH—TΔS<0,则该反应能够自发进行。已知上述氨的合成反应的ΔS=—198.2 J·mol-1·K-1,则其在常温下
Ⅱ.已知A(g)+B(g)
 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(3)该反应的平衡常数表达式K=
(4)830℃时,向一个5 L的密闭容器中充入0.20 mol A和0.80 mol B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s时,c(A)=
(5)判断该反应是否达到平衡的依据为
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(6)1200℃时,反应C(g)+D(g)
 A(g)+B(g)的平衡常数的值为
A(g)+B(g)的平衡常数的值为
您最近一年使用:0次
名校
解题方法
10 . 在500℃时,可逆反应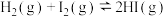
 。500℃时,向10L恒容密闭容器内充入0.89mol HI、0.25mol
。500℃时,向10L恒容密闭容器内充入0.89mol HI、0.25mol  和0.40mol
和0.40mol  ,下列说法正确的是
,下列说法正确的是
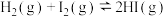
 。500℃时,向10L恒容密闭容器内充入0.89mol HI、0.25mol
。500℃时,向10L恒容密闭容器内充入0.89mol HI、0.25mol  和0.40mol
和0.40mol  ,下列说法正确的是
,下列说法正确的是| A.此反应的初始状态为化学平衡状态 |
| B.此反应的初始状态不是化学平衡状态,反应将正向进行 |
| C.此反应的初始状态不是化学平衡状态,反应将逆向进行 |
| D.无法判断此反应的初始状态是否为化学平衡状态 |
您最近一年使用:0次
2022-09-22更新
|
186次组卷
|
4卷引用:黑龙江省鸡西市密山市第四中学2023-2024学年高二上学期11月月考化学试题



