解题方法
1 . 生产合成气的反应: 在高温下能自发进行,则该反应的
在高温下能自发进行,则该反应的
 在高温下能自发进行,则该反应的
在高温下能自发进行,则该反应的A.  | B.  |
C.  | D.  |
您最近一年使用:0次
2022-11-25更新
|
187次组卷
|
2卷引用:安徽省明光市第二中学2023-2024学年高二上学期期中考试化学试卷
解题方法
2 . 下列反应中,熵显著增加的反应是
A. |
B. |
C.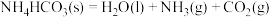 |
D.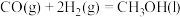 |
您最近一年使用:0次
名校
解题方法
3 . 一定温度下,在2个容积均为1L的密闭容器中,充入一定量的反应物,发生反应:
 。相关反应数据如下表所示:
。相关反应数据如下表所示:
下列说法正确的是

 。相关反应数据如下表所示:
。相关反应数据如下表所示:| 容器编号 | 温度 | 起始物质的量/mol | 10s时物质的量/mol | |
| NO | 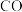 |  | ||
| I |  | 0.2 | 0.2 | 0.05 |
| II | 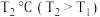 | 0.2 | 0.2 | 0.05 |
A.10s时,容器I中的化学反应速率 |
| B.该反应在任何条件下均能自发进行 |
| C.10s时,容器I中的反应处于平衡状态 |
D.若起始时,向容器II中充入0.08mol NO、0.1mol CO、0.04mol 和0.1mol 和0.1mol ,反应将向逆反应方向进行 ,反应将向逆反应方向进行 |
您最近一年使用:0次
2022-11-20更新
|
185次组卷
|
2卷引用:安徽省淮北市第一中学2022-2023学年高二上学期11月期中化学试题
名校
解题方法
4 . 下列叙述错误的是
| A.混乱度减小的吸热反应一定不能自发进行 |
| B.碳酸氢钠加热可以分解,因为升高温度利于熵增的方向自发进行 |
C.在温度、压强一定条件下,自发反应总是向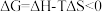 的方向进行 的方向进行 |
| D.水结冰的过程不能自发进行的原因是熵减的过程,改变条件也不可能自发进行 |
您最近一年使用:0次
2022-11-19更新
|
200次组卷
|
7卷引用:安徽省省十联考合肥市第八中学2022-2023学年高二上学期期中联考化学试题
13-14高三·全国·课时练习
名校
解题方法
5 . 下列说法正确的是
| A.凡是放热反应都是自发的,因为吸热反应都是非自发的 |
| B.自发反应的熵一定增大,非自发反应的熵一定减小 |
C.常温下,反应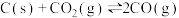 不能自发进行,则该反应的 不能自发进行,则该反应的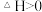 |
D.反应 能自发进行,则该反应的 能自发进行,则该反应的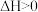 |
您最近一年使用:0次
2022-11-18更新
|
148次组卷
|
31卷引用:安徽省青阳县第一中学2019-2020学年高二10月月考化学试题
安徽省青阳县第一中学2019-2020学年高二10月月考化学试题安徽省合肥市2019—2020学年高二下学期期中考试化学试题(已下线)2014-2015学年浙江省温州市十校联合体高二上学期期中联考化学试卷2016-2017学年河南省郑州一中高二上期中化学卷(已下线)2.4 化学反应进行的方向甘肃省武山一中2017-2018学年度高二上学期期末考试化学试题湖南省衡阳县第四中学2018-2019学年高二第一学期实验班9月月考化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高二上学期10月月考化学试题云南省通海三中2018-2019学年高二下学期6月份考试化学试题山东省日照市第一中学2019-2020学年高二10月月考化学试题四川省蓬溪县蓬南中学2019-2020学年高二上学期第四次月考化学试题河北省沧州市泊头市第一中学2019-2020学年高二月考检测化学试题河北省泊头市第一中学2019-2020学年高二上学期期末模拟考试化学试卷河北省张家口市宣化区宣化第一中学2020-2021学年高二上学期10月月考化学试题浙江省浙北G2(嘉兴一中、湖州中学)2020-2021学年高二上学期期中联考化学试题(已下线)【浙江新东方】98江苏省东台中学2018-2019学年高二上学期期末考试化学试题四川省成都市实验外国语学校(西区)2019-2020 学年高二上学期期中考试化学试题辽宁省清原满族自治县第二高级中学2020-2021学年高二上学期期中考试化学试题浙江省桐庐中学2021-2022学年高二10月阶段性测试化学试题山东省济南市历城第一中学2021-2022学年高二上学期10月月考化学试题山东省济宁市泗水县2021-2022学年高二上学期期中考试化学试题(已下线)第2章基础巩固测评卷-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)作业(十) 化学反应的方向黑龙江省哈尔滨市兆麟中学2023-2024学年高二上学期第一次月考化学试题(已下线)2014年高考化学一轮复习课后规范训练7-3练习卷2017届河北省沧州一中高三上学期9.22周测化学卷高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第四节 化学反应进行的方向 化学反应进行的方向(已下线)第28练 化学反应的方向-2023年高考化学一轮复习小题多维练(全国通用)陕西省西安市高新第一中学2021-2022学年高一下学期第二次月考化学试题(已下线)考点24 化学反应的方向(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
解题方法
6 . 下列反应既是氧化还原反应且在任何温度下都能正向自发进行的是
A.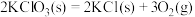  |
B.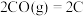 (s,石墨) (s,石墨)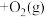  |
C.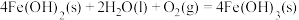  |
D.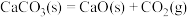  |
您最近一年使用:0次
2022-11-13更新
|
189次组卷
|
4卷引用:安徽省合肥庐巢八校2022-2023学年高二上学期12月联考化学试题
名校
7 . 下列说法正确的是
| A.在常温下,放热反应一般能自发进行,吸热反应都不能自发进行 |
B.  ,在无催化下不加热也能自发进行,原因是反应有自发地向混乱度增加的方向转变的倾向 ,在无催化下不加热也能自发进行,原因是反应有自发地向混乱度增加的方向转变的倾向 |
| C.焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 |
| D.在其他外界条件不变的情况下,使用催化剂可以改变化学反应进行的方向 |
您最近一年使用:0次
2022-11-09更新
|
370次组卷
|
19卷引用:安徽省滁州市定远县重点中学2020-2021学年高二上学期期末考试化学试题
安徽省滁州市定远县重点中学2020-2021学年高二上学期期末考试化学试题甘肃省武威第五中学2016-2017学年高二下学期第二次月考化学试题(已下线)2018年9月30日《每日一题》人教选修4每周一测河南省上蔡县第二高级中学2018-2019学年高二上学期期中考试化学试题云南省会泽县茚旺高级中学2018-2019学年高二上学期12月月考化学试题四川省遂宁二中2018-2019学年高二上学期半期考试化学试题新疆哈密市第十五中学2018-2019学年高二上学期期末考试化学试题(已下线)2019年9月29日《每日一题》选修4—— 每周一测2019年10月24日《每日一题》2019-2020学年高二化学人教选修4——化学反应方向的判断广东省广州市2019-2020学年高二上学期期中模拟测试化学试题(二)新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高二上学期期中考试化学试题陕西省咸阳百灵中学2019-2020学年高二上学期第二次月考化学(理)试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第三节 化学反应的方向 方法帮山东省青岛第二中学2019-2020学年高二上学期期中考试化学试题甘肃省靖远县第二中学2021-2022学年高二上学期期中考试化学(理)试题天津市第四十七中学2022-2023学年高二上学期期末检测化学试题2014-2015学年江西省高安中学高一重点班下期末化学试卷2014-2015学年江西省高安中学高一下学期期末化学试卷辽宁省庄河市高级中学2016-2017学年高一下学期期末考试化学试题
8 . 在汽车尾气净化器中CO和NO发生反应可转化为无毒的N2和CO2,主要反应为2NO(g)+2CO(g) N2(g)+2CO2(g) △H=-746.8kJ•mol-1。下列相关说法正确的是
N2(g)+2CO2(g) △H=-746.8kJ•mol-1。下列相关说法正确的是
 N2(g)+2CO2(g) △H=-746.8kJ•mol-1。下列相关说法正确的是
N2(g)+2CO2(g) △H=-746.8kJ•mol-1。下列相关说法正确的是| A.该反应的△S>0 |
| B.升高温度,该反应的平衡常数增大 |
C.该反应的平衡常数可表示为K=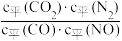 |
| D.平衡时,将CO2分离出来,NO的转化率增大 |
您最近一年使用:0次
2022-10-28更新
|
302次组卷
|
4卷引用:安徽省舒城晓天中学2022-2023学年高二上学期期中考试化学试题
安徽省舒城晓天中学2022-2023学年高二上学期期中考试化学试题河南省南阳六校2022-2023学年高二上学期期中考试化学试题江苏省淮安市2022-2023学年高二上学期期末考试化学试题(已下线)专题08 化学反应速率与化学平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(江苏专用)
2022高二上·安徽阜阳·竞赛
解题方法
9 . 化学反应的方向:对于可逆反应而言,有正向进行和逆向进行两个方向。一般地,判断反应方向有“焓判据”和“熵判据”两种判断方法。在此之前我们要先了解“熵”的概念。熵( )的定义式为
)的定义式为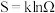 ,其中
,其中 为体系混乱度,
为体系混乱度, 为玻尔兹曼常数,熵单位为J·K-1·mol-1;
为玻尔兹曼常数,熵单位为J·K-1·mol-1; 越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):
越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):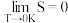
即在绝对零度下任何完美的纯净的晶体的熵值为0,对于同一种物质,其熵值:气态>液态>固态。
•焓判据:放热反应体系能量降低,因此具有自发进行(指没有任何外力做功的情况下能够“自己”进行)的倾向。
•熵判据:反应体系具有自发向熵增的方向进行的倾向。
但是仅凭焓判据和熵判据都存在特例,无法概况全部化学反应,因此1876年美国化学家吉布斯引入了一个新的热力学函数——吉布斯自由能( ),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式:
),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式: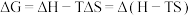
因此有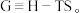 在压强与温度恒定时,若
在压强与温度恒定时,若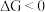 则正反应自发,若
则正反应自发,若 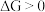 则逆反应自发,若
则逆反应自发,若 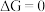 反应达到化学平衡。根据材料,许多放热化学反应能够自发进行,使得人们总结出焓判据的原因在于
反应达到化学平衡。根据材料,许多放热化学反应能够自发进行,使得人们总结出焓判据的原因在于
 )的定义式为
)的定义式为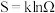 ,其中
,其中 为体系混乱度,
为体系混乱度, 为玻尔兹曼常数,熵单位为J·K-1·mol-1;
为玻尔兹曼常数,熵单位为J·K-1·mol-1; 越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):
越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):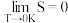
即在绝对零度下任何完美的纯净的晶体的熵值为0,对于同一种物质,其熵值:气态>液态>固态。
•焓判据:放热反应体系能量降低,因此具有自发进行(指没有任何外力做功的情况下能够“自己”进行)的倾向。
•熵判据:反应体系具有自发向熵增的方向进行的倾向。
但是仅凭焓判据和熵判据都存在特例,无法概况全部化学反应,因此1876年美国化学家吉布斯引入了一个新的热力学函数——吉布斯自由能(
 ),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式:
),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式: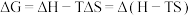
因此有
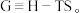 在压强与温度恒定时,若
在压强与温度恒定时,若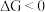 则正反应自发,若
则正反应自发,若 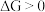 则逆反应自发,若
则逆反应自发,若 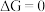 反应达到化学平衡。根据材料,许多放热化学反应能够自发进行,使得人们总结出焓判据的原因在于
反应达到化学平衡。根据材料,许多放热化学反应能够自发进行,使得人们总结出焓判据的原因在于| A.其反应熵变很小 |
| B.其反应需要的温度较高 |
| C.反应活化能较低 |
D.反应的体积功大(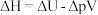 ,其中 ,其中 为其体积功) 为其体积功) |
您最近一年使用:0次
2022高二上·安徽阜阳·竞赛
解题方法
10 . 化学反应的方向:对于可逆反应而言,有正向进行和逆向进行两个方向。一般地,判断反应方向有“焓判据”和“熵判据”两种判断方法。在此之前我们要先了解“熵”的概念。熵( )的定义式为
)的定义式为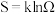 ,其中
,其中 为体系混乱度,
为体系混乱度, 为玻尔兹曼常数,熵单位为J·K-1·mol-1;
为玻尔兹曼常数,熵单位为J·K-1·mol-1; 越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):
越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):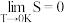
即在绝对零度下任何完美的纯净的晶体的熵值为0,对于同一种物质,其熵值:气态>液态>固态。
•焓判据:放热反应体系能量降低,因此具有自发进行(指没有任何外力做功的情况下能够“自己”进行)的倾向。
•熵判据:反应体系具有自发向熵增的方向进行的倾向。
但是仅凭焓判据和熵判据都存在特例,无法概况全部化学反应,因此1876年美国化学家吉布斯引入了一个新的热力学函数——吉布斯自由能( ),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式:
),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式: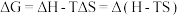
因此有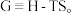 在压强与温度恒定时,若
在压强与温度恒定时,若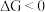 则正反应自发,若
则正反应自发,若 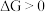 则逆反应自发,若
则逆反应自发,若 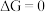 反应达到化学平衡。对于一个
反应达到化学平衡。对于一个 均为正的反应,下列可以使其正向进行的是
均为正的反应,下列可以使其正向进行的是
 )的定义式为
)的定义式为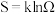 ,其中
,其中 为体系混乱度,
为体系混乱度, 为玻尔兹曼常数,熵单位为J·K-1·mol-1;
为玻尔兹曼常数,熵单位为J·K-1·mol-1; 越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):
越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):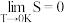
即在绝对零度下任何完美的纯净的晶体的熵值为0,对于同一种物质,其熵值:气态>液态>固态。
•焓判据:放热反应体系能量降低,因此具有自发进行(指没有任何外力做功的情况下能够“自己”进行)的倾向。
•熵判据:反应体系具有自发向熵增的方向进行的倾向。
但是仅凭焓判据和熵判据都存在特例,无法概况全部化学反应,因此1876年美国化学家吉布斯引入了一个新的热力学函数——吉布斯自由能(
 ),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式:
),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式: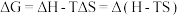
因此有
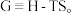 在压强与温度恒定时,若
在压强与温度恒定时,若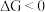 则正反应自发,若
则正反应自发,若 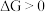 则逆反应自发,若
则逆反应自发,若 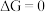 反应达到化学平衡。对于一个
反应达到化学平衡。对于一个 均为正的反应,下列可以使其正向进行的是
均为正的反应,下列可以使其正向进行的是| A.置于低温条件下 |
| B.置于高温条件下 |
| C.加入合适的催化剂 |
| D.将产物及时分离 |
您最近一年使用:0次



