2022高二上·安徽阜阳·竞赛
解题方法
1 . 化学反应的方向:对于可逆反应而言,有正向进行和逆向进行两个方向。一般地,判断反应方向有“焓判据”和“熵判据”两种判断方法。在此之前我们要先了解“熵”的概念。熵( )的定义式为
)的定义式为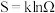 ,其中
,其中 为体系混乱度,
为体系混乱度,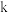 为玻尔兹曼常数,熵单位为J·K-1·mol-1;
为玻尔兹曼常数,熵单位为J·K-1·mol-1; 越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):
越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):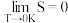
即在绝对零度下任何完美的纯净的晶体的熵值为0,对于同一种物质,其熵值:气态>液态>固态。
•焓判据:放热反应体系能量降低,因此具有自发进行(指没有任何外力做功的情况下能够“自己”进行)的倾向。
•熵判据:反应体系具有自发向熵增的方向进行的倾向。
但是仅凭焓判据和熵判据都存在特例,无法概况全部化学反应,因此1876年美国化学家吉布斯引入了一个新的热力学函数——吉布斯自由能( ),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式:
),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式: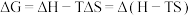
因此有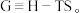 在压强与温度恒定时,若
在压强与温度恒定时,若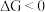 则正反应自发,若
则正反应自发,若 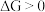 则逆反应自发,若
则逆反应自发,若 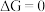 反应达到化学平衡。以下化学反应不适用焓判据的是
反应达到化学平衡。以下化学反应不适用焓判据的是
 )的定义式为
)的定义式为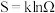 ,其中
,其中 为体系混乱度,
为体系混乱度,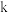 为玻尔兹曼常数,熵单位为J·K-1·mol-1;
为玻尔兹曼常数,熵单位为J·K-1·mol-1; 越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):
越大系统混乱度越大,规定(开氏温标下,0K=-273.15℃即绝对零度,开氏温标每增加1K,摄氏温标增加1℃):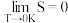
即在绝对零度下任何完美的纯净的晶体的熵值为0,对于同一种物质,其熵值:气态>液态>固态。
•焓判据:放热反应体系能量降低,因此具有自发进行(指没有任何外力做功的情况下能够“自己”进行)的倾向。
•熵判据:反应体系具有自发向熵增的方向进行的倾向。
但是仅凭焓判据和熵判据都存在特例,无法概况全部化学反应,因此1876年美国化学家吉布斯引入了一个新的热力学函数——吉布斯自由能(
 ),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式:
),其物理意义是一个化学反应可被利用来做有用功的能力,根据吉布斯-亥姆霍兹方程式: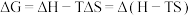
因此有
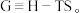 在压强与温度恒定时,若
在压强与温度恒定时,若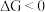 则正反应自发,若
则正反应自发,若 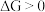 则逆反应自发,若
则逆反应自发,若 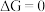 反应达到化学平衡。以下化学反应不适用焓判据的是
反应达到化学平衡。以下化学反应不适用焓判据的是| A.氢气的氧化反应 |
| B.铜锌原电池反应 |
| C.氢氧化钡与铵盐反应 |
| D.醋酸的电离反应 |
您最近一年使用:0次
11-12高二上·安徽淮北·期中
名校
2 . 已知FeO(s) +C(s)= CO(g) + Fe(s) △H>0,下列叙述正确的是
| A.低温下为自发过程,高温下为非自发过程 | B.任何温度下为非自发过程 |
| C.高温下为自发过程,低温下为非自发过程 | D.任何温度下为自发过程 |
您最近一年使用:0次
2022-10-26更新
|
466次组卷
|
25卷引用:2011-2012学年安徽省濉溪县临涣中学高二上学期期中联考化学试卷
(已下线)2011-2012学年安徽省濉溪县临涣中学高二上学期期中联考化学试卷(已下线)2014秋安徽省宿州市高二上学期期中化学(理)试卷2015-2016学年安徽省舒城晓天中学高二上学期期中测试化学试卷安徽省新城高升学校2018-2019学年高二上学期期中考试化学试题安徽省亳州市第十八中学2019-2020学年高二上学期第一次月考化学试题安徽省蚌埠田家炳中学2020-2021学年高二12月月考化学试题(已下线)2014-2015学年山东安丘市实验中学期中考试高二化学模拟(A)卷【全国百强校】江苏省南菁高级中学2017-2018学年高二下学期期中考试化学试题【全国百强校】黑龙江省鹤岗市第一中学2018-2019学年高二上学期第一次月考(10月)化学试题广西南宁市“4N”高中联合体2018-2019学年高二下学期期末考试化学试题云南省普洱市澜沧县第一中学2018-2019学年高二下学期期末考试化学试题云南省普洱市澜沧县民族中学2018-2019学年高二下学期期末考试化学试题河南省鹤壁市浚县二中2019-2020学年高二上学期第二次月考化学试题2020年春季人教版高中化学选修4第二章《化学反应速率和化学平衡》测试卷人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第三节 化学反应的方向 作业帮(已下线)第二章 化学反应速率与化学平衡(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第1节 化学反应的方向重庆市铁路中学校2020-2021学年高二上学期11月月考化学试题贵州省贵阳市清镇养正学校2019-2020学年高二上学期期中考试化学试题黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期第一次月考化学试题吉林省延吉市第一高级中学2021-2022年学年高二上学期期中考试化学试题湖北省黄州中学2022--2023学年高二上学期10月月考化学试题四川省宜宾市第四中学校2022-2023学年高二上学期期中考试化学试题新疆喀什地区疏附县第一中学2022-2023学年高二上学期期末考试化学试题百所名校联考-化学反应速率与化学平衡
名校
3 . 下列说法中正确的是
| A.非自发反应在任何条件下都不能实现 |
| B.ΔH>0,ΔS>0的反应在任何条件都可以实际发生 |
| C.金属单质导电属于物理变化,电解质溶液导电是化学变化 |
D.O2(g)+2SO2(g) 2SO3(g)在298K时的平衡常数K=7.0×1022,说明在该温度下反应速率很快 2SO3(g)在298K时的平衡常数K=7.0×1022,说明在该温度下反应速率很快 |
您最近一年使用:0次
2022-09-25更新
|
159次组卷
|
2卷引用:安徽省芜湖市安徽师范大学附属中学2022-2023学年高二上学期期中考查化学试题
11-12高二下·安徽六安·单元测试
名校
解题方法
4 . 拿破仑在俄国时,当时法国士兵军服的纽扣都是用金属锡做的。灰锡结构松散,不能用于制造器皿,而白锡结构坚固,可以制造器皿。试分析现把白锡制成的器皿放在0℃、100kPa的室内存放,它会不会变成灰锡而不能再继续使用?已知:在0℃、100kPa条件下白锡转化为灰锡反应的焓变和熵变分别为ΔH=-2.1809kJ·mol-1,ΔS=-6.6J·mol-1·K-1。
| A.会变 | B.不会变 | C.不能确定 | D.升高温度才会变 |
您最近一年使用:0次
2022-09-14更新
|
289次组卷
|
18卷引用:2011-2012学年安徽省舒城晓天中学高二下学期质量测试1化学试卷
(已下线)2011-2012学年安徽省舒城晓天中学高二下学期质量测试1化学试卷安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题2016-2017学年湖南省衡阳一中高二上10月月考化学卷(已下线)2018年10月25日 《每日一题》人教选修4--化学反应方向的判断山西省运城市2019-2020学年高二上学期期末调研测试化学试题(已下线)第02章 化学反应速率与化学平衡(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)吉林省白城市第一中学2021-2022学年高二上学期9月阶段考试化学试题福建省三明第一中学2021-2022学年高二上学期第一次月考化学试题黑龙江省牡丹江市海林市朝鲜族中学2021-2022学年上学期高二10月月考化学试题福建省莆田市擢英中学2021-2022学年高二上学期第一次月考化学试卷(已下线)必考点04 化学反应的方向和调控-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)福建省福州第一中学2021-2022学年高二上学期期中考试化学试题山东省青岛市第十九中学2021-2022学年高二上学期10月月考化学试题福建省三明市四地四校2021-2022学年高二上学期期中联考协作卷化学试题内蒙古自治区呼伦贝尔市鄂温克族自治旗第三中学2021-2022学年高二上学期第一次月考化学试题(已下线)第07讲 化学反应的方向-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)(已下线)第28练 化学反应的方向-2023年高考化学一轮复习小题多维练(全国通用)
名校
解题方法
5 . 研究CO2的回收利用既可变废为宝,又可减少碳的排放。回答下列问题;
二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料,由CO2和H2制备二甲醚的反应原理如下:
反应Ⅰ:
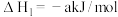 (a>0)
(a>0)
反应Ⅱ: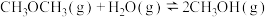
 (b>0)
(b>0)
反应Ⅲ: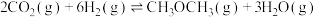

(1) =
=_______ kJ/mol,据此判断反应Ⅲ在_______ (填“低温”、“高温”或“任意温度”)条件下能自发进行。
(2)恒温恒压条件下,在密闭容器中通入等物质的量的CO2和H2发生反应I,能说明反应I达到平衡状态的是_______ (填字母序号)。
a.平衡常数保持不变 b.生成3molH—H键的同时断裂1molC—O键
c.容器内混合气体的密度保持不变 d.CO2和H2O的物质的量之比保持不变
(3)T1℃时,将1mol二甲醚充入某恒容密闭容器中,发生如下分解反应:
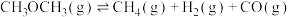 ,在不同时间测定容器内的总压,所得数据见下表:
,在不同时间测定容器内的总压,所得数据见下表:
由表中数据计算:反应达平衡时,二甲醚的分解率为_______ ,该温度下的平衡常数
_______ 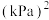 (
(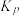 为用气体平衡分压代替气体平衡浓度表示的平衡常数,分压=总压×气体的物质的量分数)。
为用气体平衡分压代替气体平衡浓度表示的平衡常数,分压=总压×气体的物质的量分数)。
(4)恒压下将CO2和氢气按体积比1:3混合,在不同催化剂作用下发生反应I和反应Ⅲ,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。其中:CH3OH的选择性=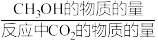 ×100%
×100%

①在上述条件下,结合图象分析,合成甲醇的最佳温度是_______ ,最佳催化剂是_______ 。
②温度高于230℃,CH3OH产率随温度升高而下降的原因是_______ 。
二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料,由CO2和H2制备二甲醚的反应原理如下:
反应Ⅰ:

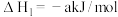 (a>0)
(a>0)反应Ⅱ:
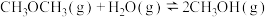
 (b>0)
(b>0)反应Ⅲ:
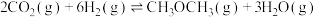

(1)
 =
=(2)恒温恒压条件下,在密闭容器中通入等物质的量的CO2和H2发生反应I,能说明反应I达到平衡状态的是
a.平衡常数保持不变 b.生成3molH—H键的同时断裂1molC—O键
c.容器内混合气体的密度保持不变 d.CO2和H2O的物质的量之比保持不变
(3)T1℃时,将1mol二甲醚充入某恒容密闭容器中,发生如下分解反应:
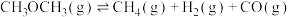 ,在不同时间测定容器内的总压,所得数据见下表:
,在不同时间测定容器内的总压,所得数据见下表:| 反应时间t/min | 0 | 5 | 10 | 15 | 20 |  |
| 气体总压p总/kPa | p0 | 1.4p0 | 1.6p0 | 1.8p0 | 1.9p0 | 2p0 |

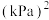 (
(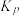 为用气体平衡分压代替气体平衡浓度表示的平衡常数,分压=总压×气体的物质的量分数)。
为用气体平衡分压代替气体平衡浓度表示的平衡常数,分压=总压×气体的物质的量分数)。(4)恒压下将CO2和氢气按体积比1:3混合,在不同催化剂作用下发生反应I和反应Ⅲ,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。其中:CH3OH的选择性=
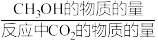 ×100%
×100%
①在上述条件下,结合图象分析,合成甲醇的最佳温度是
②温度高于230℃,CH3OH产率随温度升高而下降的原因是
您最近一年使用:0次
2022-09-11更新
|
583次组卷
|
3卷引用:安徽省合肥市第一中学2023-2024学年高二上学期期中考试化学试题
名校
6 . 下列有关反应原理的说法正确的是
A.对于 且能自发进行的化学反应,其 且能自发进行的化学反应,其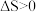 |
B.向新制氯水中加适量石灰石不能增大溶液中的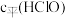 |
C.对于 的可逆反应来说,升高温度可加快反应速率,增大反应物的平衡转化率 的可逆反应来说,升高温度可加快反应速率,增大反应物的平衡转化率 |
| D.反应物分子间的碰撞都能使化学反应发生,碰撞越多,反应速率越高 |
您最近一年使用:0次
2022-09-02更新
|
308次组卷
|
5卷引用:安徽省亳州市2021-2022学年高二上学期期末考试化学试题
名校
解题方法
7 . 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g) +H2O(g)。下图表示该反应进行过程中能量的变化。关于该反应的下列说法中正确的是


| A.ΔH>0, ΔS>0 | B.ΔH>0,ΔS<0 |
| C.ΔH<0, ΔS<0 | D.ΔH<0,ΔS>0 |
您最近一年使用:0次
2022-08-18更新
|
357次组卷
|
22卷引用:安徽省六安市城南中学2020-2021学年高二上学期期中考试化学试题
安徽省六安市城南中学2020-2021学年高二上学期期中考试化学试题安徽省蚌埠第三中学2021-2022学年高二上学期10月教学质量检测化学试题河南省长垣市第十中学2020-2021学年高二上学期第二次月考化学试题湖北省咸宁市通城二中2020-2021学年高二上学期10月月考化学试题内蒙古集宁新世纪中学2020-2021学年高二上学期期中考试化学试题黑龙江省哈尔滨师范大学附属中学2021-2022学年高二上学期开学考试化学试题河北省石家庄市第一中学2021-2022学年高二上学期开学考试化学试题(已下线)第二单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)山东省烟台市招远市第二中学2021-2022学年高二10月月考化学试题辽宁省朝阳育英高考补习学校2021-2022学年高二10月月考化学试题黑龙江省哈尔滨市第六中学2021-2022学年高二上学期第一次月考化学试题河南省范县第一中学2021-2022学年高二上学期第二次月考检测化学试题贵州省凯里市第一中学2021-2022学年高二上学期期中考试化学(理科)试题(已下线)必考点04 化学反应的方向和调控-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)(已下线)章末培优2 专题2 化学反应速率与化学平衡-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)贵州省毕节市金沙县第一中学2021-2022学年高二上学期期中考试化学试题黑龙江省齐齐哈尔市恒昌中学校2021-2022学年高二上学期期中考试化学试题黑龙江省牡丹江市第三高级中学2022-2023学年高二上学期第一次月考化学试题福建泉州现代中学2021-2022学年高二上学期期中考试化学试题吉林省吉化第一高级中学校2021-2022学年高一下学期复课检测化学试题湖北省恩施州高中教育联盟2020-2021学年高一下学期期末考试化学试题(已下线)第20讲 化学平衡常数及转化率的计算(练)-2023年高考化学一轮复习讲练测(新教材新高考)
名校
8 . 二氧化碳的捕获、利用是实现碳中和的一个重要战略方向。回答下列问题:
(1)已知:常温下,反应CaO(s)+CO2(g) CaCO3(s)能自发进行。则该反应为
CaCO3(s)能自发进行。则该反应为____ (填“吸热”或“放热”)反应;上述反应达到平衡后,若其他条件不变,增大CaO的用量,CO2的转化率将____ (填“增大”“减小”或“不变”)。
(2)工业上以CO2和H2为原料合成CH3OH涉及的主要反应如下:
反应I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
反应II.CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41kJ·mol-1
CO(g)+H2O(g) △H2=+41kJ·mol-1
①将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
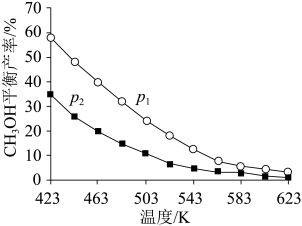
不同温度和压强下,CH3OH平衡产率如图所示。则图中的压强p1____ (填“>”“=”或“<”)p2,推断的依据是____ 。
②T℃时,在体积为V的密闭容器中,反应I、II均达到化学平衡,CO2转化率为25%,且生成等物质的量的CH3OH和CO,则该温度下反应II的平衡常数的值为_____ (用分数表示)。
(3)调节溶液pH可实现工业废气中CO2的捕获和释放。已知20℃时碳酸的电离常数为Ka1、Ka2,当溶液pH=11时,c(H2CO3):c(HCO ):c(CO
):c(CO )=1:
)=1:____ :____ 。(用Ka1、Ka2表示)
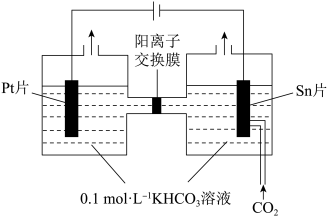
(4)电解CO2制HCOOH的原理如图所示,写出在Sn片上发生的电极反应式:____ 。
(1)已知:常温下,反应CaO(s)+CO2(g)
 CaCO3(s)能自发进行。则该反应为
CaCO3(s)能自发进行。则该反应为(2)工业上以CO2和H2为原料合成CH3OH涉及的主要反应如下:
反应I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49kJ·mol-1反应II.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41kJ·mol-1
CO(g)+H2O(g) △H2=+41kJ·mol-1①将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
不同温度和压强下,CH3OH平衡产率如图所示。则图中的压强p1

②T℃时,在体积为V的密闭容器中,反应I、II均达到化学平衡,CO2转化率为25%,且生成等物质的量的CH3OH和CO,则该温度下反应II的平衡常数的值为
(3)调节溶液pH可实现工业废气中CO2的捕获和释放。已知20℃时碳酸的电离常数为Ka1、Ka2,当溶液pH=11时,c(H2CO3):c(HCO
 ):c(CO
):c(CO )=1:
)=1:(4)电解CO2制HCOOH的原理如图所示,写出在Sn片上发生的电极反应式:

您最近一年使用:0次
2022-07-14更新
|
109次组卷
|
3卷引用:安徽省淮南市第一中学2023-2024学年高二下学期开学考试化学试题
解题方法
9 . “中国芯”的主要原料是高纯单晶硅,反应 可用于纯硅的制备。下列有关说法不正确的是
可用于纯硅的制备。下列有关说法不正确的是
 可用于纯硅的制备。下列有关说法不正确的是
可用于纯硅的制备。下列有关说法不正确的是| A.自然界中没有游离态硅,化合态硅主要是二氧化硅和硅酸盐 |
B.该反应在高温下能自发进行,其焓变 |
| C.工业上可用氢氟酸作抛光液抛光单晶硅 |
D.若原料 中含有 中含有 ,可用蒸馏的方法进行提纯 ,可用蒸馏的方法进行提纯 |
您最近一年使用:0次
解题方法
10 . 以 、
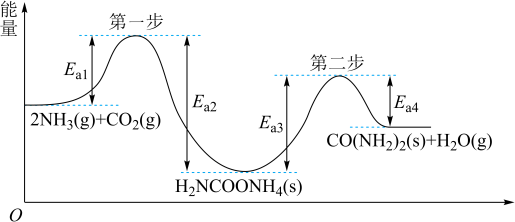
、 为原料生产重要的高效氮肥—尿素[CO(NH2)2],反应过程中能量(
为原料生产重要的高效氮肥—尿素[CO(NH2)2],反应过程中能量( )变化如图所示,下列说法正确的是
)变化如图所示,下列说法正确的是
 、
、 为原料生产重要的高效氮肥—尿素[CO(NH2)2],反应过程中能量(
为原料生产重要的高效氮肥—尿素[CO(NH2)2],反应过程中能量(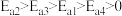 )变化如图所示,下列说法正确的是
)变化如图所示,下列说法正确的是
A.由图知 和 和 在一定条件下发生有效碰撞直接生成了 在一定条件下发生有效碰撞直接生成了 和 和 |
| B.第二步反应是合成尿素的决速步骤 |
| C.该过程的总反应在高温条件下有利于自发进行 |
D.合成尿素的热化学方程式为  |
您最近一年使用:0次
2022-05-16更新
|
178次组卷
|
2卷引用:安徽省示范高中培优联盟 2021-2022学年高二下学期春季联赛化学试题



