名校
1 . 下列说法中正确的是
| A.非自发反应在任何条件下都不能实现 |
| B.ΔH>0,ΔS>0的反应在任何条件都可以实际发生 |
| C.金属单质导电属于物理变化,电解质溶液导电是化学变化 |
D.O2(g)+2SO2(g) 2SO3(g)在298K时的平衡常数K=7.0×1022,说明在该温度下反应速率很快 2SO3(g)在298K时的平衡常数K=7.0×1022,说明在该温度下反应速率很快 |
您最近一年使用:0次
2022-09-25更新
|
167次组卷
|
2卷引用:安徽省芜湖市安徽师范大学附属中学2022-2023学年高二上学期期中考查化学试题
名校
解题方法
2 . 下列说法正确的是
| A.2C(s)+O2(g)=2CO(g) △H=-221kJ/mol,则碳的燃烧热等于110.5kJ/mol |
| B.C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol,则金刚石比石墨稳定 |
| C.CaCO3(s)=CaO(s)+CO2(g) △H>0,△S>0,则不论在何种条件下都不可能自发进行 |
| D.用CH3COOH溶液和NaOH溶液反应测定中和热:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(aq) △H>-57.3kJ/mol |
您最近一年使用:0次
2022-09-17更新
|
753次组卷
|
6卷引用:安徽省芜湖市2023-2024学年高二上学期1月期末化学试题
11-12高二下·安徽六安·单元测试
名校
解题方法
3 . 拿破仑在俄国时,当时法国士兵军服的纽扣都是用金属锡做的。灰锡结构松散,不能用于制造器皿,而白锡结构坚固,可以制造器皿。试分析现把白锡制成的器皿放在0℃、100kPa的室内存放,它会不会变成灰锡而不能再继续使用?已知:在0℃、100kPa条件下白锡转化为灰锡反应的焓变和熵变分别为ΔH=-2.1809kJ·mol-1,ΔS=-6.6J·mol-1·K-1。
| A.会变 | B.不会变 | C.不能确定 | D.升高温度才会变 |
您最近一年使用:0次
2022-09-14更新
|
332次组卷
|
18卷引用:2011-2012学年安徽省舒城晓天中学高二下学期质量测试1化学试卷
(已下线)2011-2012学年安徽省舒城晓天中学高二下学期质量测试1化学试卷安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题安徽省池州市贵池区2021-2022学年高二上学期期中考试化学试题2016-2017学年湖南省衡阳一中高二上10月月考化学卷(已下线)2018年10月25日 《每日一题》人教选修4--化学反应方向的判断山西省运城市2019-2020学年高二上学期期末调研测试化学试题(已下线)第02章 化学反应速率与化学平衡(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)吉林省白城市第一中学2021-2022学年高二上学期9月阶段考试化学试题福建省三明第一中学2021-2022学年高二上学期第一次月考化学试题黑龙江省牡丹江市海林市朝鲜族中学2021-2022学年上学期高二10月月考化学试题福建省莆田市擢英中学2021-2022学年高二上学期第一次月考化学试卷(已下线)必考点04 化学反应的方向和调控-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)福建省福州第一中学2021-2022学年高二上学期期中考试化学试题山东省青岛市第十九中学2021-2022学年高二上学期10月月考化学试题福建省三明市四地四校2021-2022学年高二上学期期中联考协作卷化学试题内蒙古自治区呼伦贝尔市鄂温克族自治旗第三中学2021-2022学年高二上学期第一次月考化学试题(已下线)第07讲 化学反应的方向-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)(已下线)第28练 化学反应的方向-2023年高考化学一轮复习小题多维练(全国通用)
名校
解题方法
4 . 研究CO2的回收利用既可变废为宝,又可减少碳的排放。回答下列问题;
二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料,由CO2和H2制备二甲醚的反应原理如下:
反应Ⅰ:
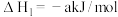 (a>0)
(a>0)
反应Ⅱ: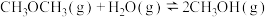
 (b>0)
(b>0)
反应Ⅲ:

(1) =
=_______ kJ/mol,据此判断反应Ⅲ在_______ (填“低温”、“高温”或“任意温度”)条件下能自发进行。
(2)恒温恒压条件下,在密闭容器中通入等物质的量的CO2和H2发生反应I,能说明反应I达到平衡状态的是_______ (填字母序号)。
a.平衡常数保持不变 b.生成3molH—H键的同时断裂1molC—O键
c.容器内混合气体的密度保持不变 d.CO2和H2O的物质的量之比保持不变
(3)T1℃时,将1mol二甲醚充入某恒容密闭容器中,发生如下分解反应:
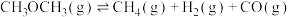 ,在不同时间测定容器内的总压,所得数据见下表:
,在不同时间测定容器内的总压,所得数据见下表:
由表中数据计算:反应达平衡时,二甲醚的分解率为_______ ,该温度下的平衡常数
_______  (
( 为用气体平衡分压代替气体平衡浓度表示的平衡常数,分压=总压×气体的物质的量分数)。
为用气体平衡分压代替气体平衡浓度表示的平衡常数,分压=总压×气体的物质的量分数)。
(4)恒压下将CO2和氢气按体积比1:3混合,在不同催化剂作用下发生反应I和反应Ⅲ,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。其中:CH3OH的选择性=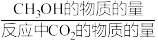 ×100%
×100%

①在上述条件下,结合图象分析,合成甲醇的最佳温度是_______ ,最佳催化剂是_______ 。
②温度高于230℃,CH3OH产率随温度升高而下降的原因是_______ 。
二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料,由CO2和H2制备二甲醚的反应原理如下:
反应Ⅰ:

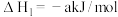 (a>0)
(a>0)反应Ⅱ:
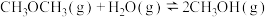
 (b>0)
(b>0)反应Ⅲ:


(1)
 =
=(2)恒温恒压条件下,在密闭容器中通入等物质的量的CO2和H2发生反应I,能说明反应I达到平衡状态的是
a.平衡常数保持不变 b.生成3molH—H键的同时断裂1molC—O键
c.容器内混合气体的密度保持不变 d.CO2和H2O的物质的量之比保持不变
(3)T1℃时,将1mol二甲醚充入某恒容密闭容器中,发生如下分解反应:
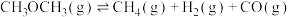 ,在不同时间测定容器内的总压,所得数据见下表:
,在不同时间测定容器内的总压,所得数据见下表:| 反应时间t/min | 0 | 5 | 10 | 15 | 20 |  |
| 气体总压p总/kPa | p0 | 1.4p0 | 1.6p0 | 1.8p0 | 1.9p0 | 2p0 |

 (
( 为用气体平衡分压代替气体平衡浓度表示的平衡常数,分压=总压×气体的物质的量分数)。
为用气体平衡分压代替气体平衡浓度表示的平衡常数,分压=总压×气体的物质的量分数)。(4)恒压下将CO2和氢气按体积比1:3混合,在不同催化剂作用下发生反应I和反应Ⅲ,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。其中:CH3OH的选择性=
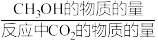 ×100%
×100%
①在上述条件下,结合图象分析,合成甲醇的最佳温度是
②温度高于230℃,CH3OH产率随温度升高而下降的原因是
您最近一年使用:0次
2022-09-11更新
|
641次组卷
|
3卷引用:安徽省合肥市第一中学2023-2024学年高二上学期期中考试化学试题
名校
5 . 下列有关反应原理的说法正确的是
A.对于 且能自发进行的化学反应,其 且能自发进行的化学反应,其 |
B.向新制氯水中加适量石灰石不能增大溶液中的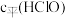 |
C.对于 的可逆反应来说,升高温度可加快反应速率,增大反应物的平衡转化率 的可逆反应来说,升高温度可加快反应速率,增大反应物的平衡转化率 |
| D.反应物分子间的碰撞都能使化学反应发生,碰撞越多,反应速率越高 |
您最近一年使用:0次
2022-09-02更新
|
316次组卷
|
5卷引用:安徽省亳州市2021-2022学年高二上学期期末考试化学试题
名校
6 . 二氧化碳的捕获、利用是实现碳中和的一个重要战略方向。回答下列问题:
(1)已知:常温下,反应CaO(s)+CO2(g) CaCO3(s)能自发进行。则该反应为
CaCO3(s)能自发进行。则该反应为____ (填“吸热”或“放热”)反应;上述反应达到平衡后,若其他条件不变,增大CaO的用量,CO2的转化率将____ (填“增大”“减小”或“不变”)。
(2)工业上以CO2和H2为原料合成CH3OH涉及的主要反应如下:
反应I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
反应II.CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41kJ·mol-1
CO(g)+H2O(g) △H2=+41kJ·mol-1
①将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
不同温度和压强下,CH3OH平衡产率如图所示。则图中的压强p1____ (填“>”“=”或“<”)p2,推断的依据是____ 。
②T℃时,在体积为V的密闭容器中,反应I、II均达到化学平衡,CO2转化率为25%,且生成等物质的量的CH3OH和CO,则该温度下反应II的平衡常数的值为_____ (用分数表示)。
(3)调节溶液pH可实现工业废气中CO2的捕获和释放。已知20℃时碳酸的电离常数为Ka1、Ka2,当溶液pH=11时,c(H2CO3):c(HCO ):c(CO
):c(CO )=1:
)=1:____ :____ 。(用Ka1、Ka2表示)
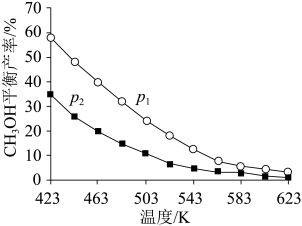
(4)电解CO2制HCOOH的原理如图所示,写出在Sn片上发生的电极反应式:____ 。
(1)已知:常温下,反应CaO(s)+CO2(g)
 CaCO3(s)能自发进行。则该反应为
CaCO3(s)能自发进行。则该反应为(2)工业上以CO2和H2为原料合成CH3OH涉及的主要反应如下:
反应I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49kJ·mol-1反应II.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41kJ·mol-1
CO(g)+H2O(g) △H2=+41kJ·mol-1①将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
不同温度和压强下,CH3OH平衡产率如图所示。则图中的压强p1

②T℃时,在体积为V的密闭容器中,反应I、II均达到化学平衡,CO2转化率为25%,且生成等物质的量的CH3OH和CO,则该温度下反应II的平衡常数的值为
(3)调节溶液pH可实现工业废气中CO2的捕获和释放。已知20℃时碳酸的电离常数为Ka1、Ka2,当溶液pH=11时,c(H2CO3):c(HCO
 ):c(CO
):c(CO )=1:
)=1:(4)电解CO2制HCOOH的原理如图所示,写出在Sn片上发生的电极反应式:

您最近一年使用:0次
2022-07-14更新
|
110次组卷
|
3卷引用:安徽省淮南市第一中学2023-2024学年高二下学期开学考试化学试题
解题方法
7 . “中国芯”的主要原料是高纯单晶硅,反应 可用于纯硅的制备。下列有关说法不正确的是
可用于纯硅的制备。下列有关说法不正确的是
 可用于纯硅的制备。下列有关说法不正确的是
可用于纯硅的制备。下列有关说法不正确的是| A.自然界中没有游离态硅,化合态硅主要是二氧化硅和硅酸盐 |
B.该反应在高温下能自发进行,其焓变 |
| C.工业上可用氢氟酸作抛光液抛光单晶硅 |
D.若原料 中含有 中含有 ,可用蒸馏的方法进行提纯 ,可用蒸馏的方法进行提纯 |
您最近一年使用:0次
解题方法
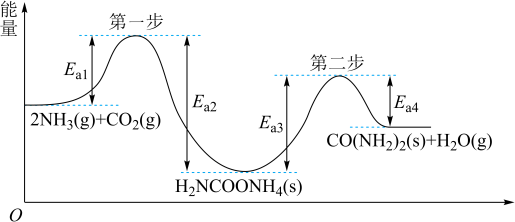
8 . 以 、
、 为原料生产重要的高效氮肥—尿素[CO(NH2)2],反应过程中能量(
为原料生产重要的高效氮肥—尿素[CO(NH2)2],反应过程中能量(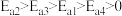 )变化如图所示,下列说法正确的是
)变化如图所示,下列说法正确的是
 、
、 为原料生产重要的高效氮肥—尿素[CO(NH2)2],反应过程中能量(
为原料生产重要的高效氮肥—尿素[CO(NH2)2],反应过程中能量( )变化如图所示,下列说法正确的是
)变化如图所示,下列说法正确的是
A.由图知 和 和 在一定条件下发生有效碰撞直接生成了 在一定条件下发生有效碰撞直接生成了 和 和 |
| B.第二步反应是合成尿素的决速步骤 |
| C.该过程的总反应在高温条件下有利于自发进行 |
D.合成尿素的热化学方程式为  |
您最近一年使用:0次
2022-05-16更新
|
184次组卷
|
2卷引用:安徽省示范高中培优联盟 2021-2022学年高二下学期春季联赛化学试题
名校
解题方法
9 . 下列反应在常温下均为非自发反应,在高温下仍为非自发的是
| A. NH4Cl(s) = NH3(g)+ HCl(g) |
B.Fe2O3(s) + C(s)=2Fe(s) + C(s)=2Fe(s) + CO2(g) CO2(g) |
C.Ag2O(s)=2Ag(s) + O2 (g) O2 (g) |
| D.2CO(g)=2C(s) + O2(g) |
您最近一年使用:0次
名校
解题方法
10 . 下列说法或表示方法正确的是
| A.由C(石墨,s)=C(金刚石,s) ΔH=+1.90kJ•mol﹣1可知,金刚石比石墨稳定 |
B.对于2SO2(g)+O2(g) 2SO3(g) ΔH=﹣QkJ•mol﹣1 (Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量为 2SO3(g) ΔH=﹣QkJ•mol﹣1 (Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量为 kJ kJ |
| C.HCl与NaOH反应的中和热ΔH=﹣57.3kJ•mol﹣1,若将含1molHCl的稀盐酸与1molNaOH固体混合,放出的热量等于57.3kJ |
| D.某化学反应其:ΔH=﹣122kJ•mol-1,ΔS=231J•mol-1•K-1,则此反应在任何温度下都能自发进行 |
您最近一年使用:0次



