解题方法
1 . 下列说法错误的是
A. ,恒温时,缩小容积,气体颜色变浅 ,恒温时,缩小容积,气体颜色变浅 |
B.若压强不再随时间变化能说明反应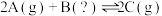 已达平衡,则 已达平衡,则 一定为气体 一定为气体 |
C.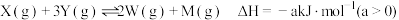 ,加入 ,加入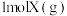 与 与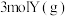 充分反应后,放出热量小于 充分反应后,放出热量小于 |
D. 该反应 该反应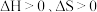 |
您最近一年使用:0次
名校
2 . 氯元素具有多种化合价,可形成 、
、 、
、 、
、 和
和 等离子,在一定条件下能发生相互转化。在新型催化剂
等离子,在一定条件下能发生相互转化。在新型催化剂 作用下,
作用下, 氧化HCl可获得
氧化HCl可获得 :
: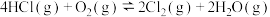
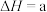 kJ⋅mol
kJ⋅mol 。对于该反应下列说法正确的是
。对于该反应下列说法正确的是
 、
、 、
、 、
、 和
和 等离子,在一定条件下能发生相互转化。在新型催化剂
等离子,在一定条件下能发生相互转化。在新型催化剂 作用下,
作用下, 氧化HCl可获得
氧化HCl可获得 :
: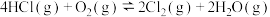
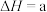 kJ⋅mol
kJ⋅mol 。对于该反应下列说法正确的是
。对于该反应下列说法正确的是A.该反应 |
B.4 mol HCl与1 mol  反应转移电子数约为 反应转移电子数约为 |
C. 的使用能使 的使用能使 氧化HCl的反应进行完全 氧化HCl的反应进行完全 |
D.反应的平衡常数为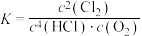 |
您最近一年使用:0次
3 . 对于反应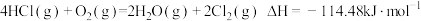 ,下列说法正确的是
,下列说法正确的是
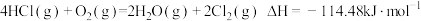 ,下列说法正确的是
,下列说法正确的是| A.使用催化剂可降低该反应的焓变 |
B.该反应的 |
C.该反应的平衡常数的表达式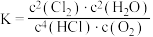 |
D.升高温度可提高 的平衡转化率 的平衡转化率 |
您最近一年使用:0次
名校
解题方法
4 . 在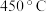 下
下 催化
催化 和
和 反应时的反应机理如下。
反应时的反应机理如下。
反应①: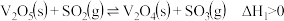
反应②: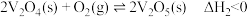 ,下列说法正确的是
,下列说法正确的是
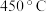 下
下 催化
催化 和
和 反应时的反应机理如下。
反应时的反应机理如下。反应①:
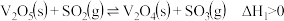
反应②:
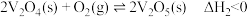 ,下列说法正确的是
,下列说法正确的是A.反应①的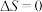 |
B. 在高温条件下能自发进行、低温条件下不能自发进行 在高温条件下能自发进行、低温条件下不能自发进行 |
C. |
D.使用 降低反应的焓变,氯碱工业使用阴离子交换膜可防止 降低反应的焓变,氯碱工业使用阴离子交换膜可防止 与 与 反应 反应 |
您最近一年使用:0次
2024-02-03更新
|
119次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2023-2024学年高二上学期1月期末化学试题
名校
5 . 下列说法中,正确的是
| A.冰在室温下自动熔化成水,这是熵增的过程 | B.能够自发进行的反应一定是放热反应 |
| C.ΔH > 0的反应均不能自发进行 | D.能够自发进行的反应一定是熵增的过程 |
您最近一年使用:0次
2024-02-02更新
|
105次组卷
|
2卷引用:黑龙江省哈尔滨师范大学附属中学2023-2024学年高二上学期期末考试化学试题
6 . Ⅰ.铁触媒催化合成氨经历下图所示①至⑥步基元反应(从状态Ⅰ至状态Ⅶ):
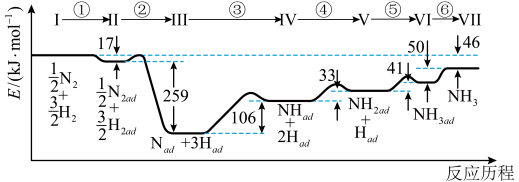
上图中“ad”表示吸附在催化剂表面的物质。
回答下列问题:
(1)根据上图计算合成氨反应的焓变:N2(g)+3H2(g) 2NH3(g) ΔH=
2NH3(g) ΔH=___________ 。
(2)上述反应的ΔS___ 0(填“>”“<”或“=”)。已知:反应N2(g)+3H2(g) 2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是
2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是____ (填标号)。
A.25℃ B.125℃ C.225℃ D.325℃
Ⅱ.高锰酸钾是一种常用的消毒剂和氧化剂。回答下列问题:
实验(一):电解法制备KMnO4。
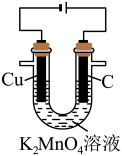
以石墨、铜为电极,电解K2MnO4溶液制备KMnO4溶液,装置如图所示。
(3)电解过程中,Cu极附近电解质溶液的pH______ (填“升高”“降低”或“不变”)。
(4)铜极、石墨极能否互换并简述理由:___________ 。
实验(二):探究K2FeO4和KMnO4氧化性强弱。装置如图所示。

关闭开关K,观察到左烧杯中紫红色溶液变为浅黄色,右烧杯中无色溶液变为紫红色。
(5)关闭K,盐桥中_______ (填离子符号)向左烧杯迁移。
(6)石墨极的电极反应式为_______ 。实验结论是氧化性:
___  (填>”“<”或“=”)。
(填>”“<”或“=”)。

上图中“ad”表示吸附在催化剂表面的物质。
回答下列问题:
(1)根据上图计算合成氨反应的焓变:N2(g)+3H2(g)
 2NH3(g) ΔH=
2NH3(g) ΔH=(2)上述反应的ΔS
 2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是
2NH3(g)的|ΔS|=199J/(mol·K),则下列温度中,合成氨反应能自发进行的是A.25℃ B.125℃ C.225℃ D.325℃
Ⅱ.高锰酸钾是一种常用的消毒剂和氧化剂。回答下列问题:
实验(一):电解法制备KMnO4。

以石墨、铜为电极,电解K2MnO4溶液制备KMnO4溶液,装置如图所示。
(3)电解过程中,Cu极附近电解质溶液的pH
(4)铜极、石墨极能否互换并简述理由:
实验(二):探究K2FeO4和KMnO4氧化性强弱。装置如图所示。

关闭开关K,观察到左烧杯中紫红色溶液变为浅黄色,右烧杯中无色溶液变为紫红色。
(5)关闭K,盐桥中
(6)石墨极的电极反应式为

 (填>”“<”或“=”)。
(填>”“<”或“=”)。
您最近一年使用:0次
2024-02-02更新
|
152次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期12月阶段性检测化学试题
解题方法
7 . 氢能源是最具应用前景的能源之一,甲烷-水蒸气催化重整制氢(SMR)是一种制高纯氢的方法,其涉及的主要反应如下:
反应Ⅰ:
反应Ⅱ: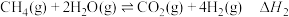
反应Ⅲ:
回答下列问题:
(1)
___________  ,反应Ⅱ能在
,反应Ⅱ能在___________ (填“高温”或“低温”)的条件下自发进行。
(2)某温度下,按照投料比 加入密闭容器中发生反应Ⅰ,平衡时
加入密闭容器中发生反应Ⅰ,平衡时 的体积分数为
的体积分数为 ,则
,则 的转化率为
的转化率为___________ (填分数);实际生产中反应物投料比小于反应的化学计量数之比,目的是___________ 。
(3)在常压、600℃条件下,向体系中加入适量生石灰后可提高 的产率。应用化学平衡移动原理解释原因
的产率。应用化学平衡移动原理解释原因___________ 。
(4)在T℃、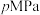 条件下,向恒温恒容密闭容器中充入
条件下,向恒温恒容密闭容器中充入 水蒸气和
水蒸气和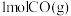 ,发生反应Ⅲ,达平衡时,
,发生反应Ⅲ,达平衡时, 的转化率为
的转化率为 。平衡时,
。平衡时, 的平衡分压为
的平衡分压为___________  ,此温度下,该反应的平衡常数
,此温度下,该反应的平衡常数
___________ (用平衡分压代替平衡浓度计算,分压=总压 物质的量分数)。
物质的量分数)。
(5)调整CO和 初始投料比发生反应Ⅲ,测得CO的平衡转化率如图:
初始投料比发生反应Ⅲ,测得CO的平衡转化率如图:

A、B、C、D、E中温度最高的点是___________ 。
反应Ⅰ:

反应Ⅱ:
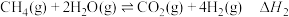
反应Ⅲ:

回答下列问题:
(1)

 ,反应Ⅱ能在
,反应Ⅱ能在(2)某温度下,按照投料比
 加入密闭容器中发生反应Ⅰ,平衡时
加入密闭容器中发生反应Ⅰ,平衡时 的体积分数为
的体积分数为 ,则
,则 的转化率为
的转化率为(3)在常压、600℃条件下,向体系中加入适量生石灰后可提高
 的产率。应用化学平衡移动原理解释原因
的产率。应用化学平衡移动原理解释原因(4)在T℃、
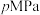 条件下,向恒温恒容密闭容器中充入
条件下,向恒温恒容密闭容器中充入 水蒸气和
水蒸气和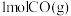 ,发生反应Ⅲ,达平衡时,
,发生反应Ⅲ,达平衡时, 的转化率为
的转化率为 。平衡时,
。平衡时, 的平衡分压为
的平衡分压为 ,此温度下,该反应的平衡常数
,此温度下,该反应的平衡常数
 物质的量分数)。
物质的量分数)。(5)调整CO和
 初始投料比发生反应Ⅲ,测得CO的平衡转化率如图:
初始投料比发生反应Ⅲ,测得CO的平衡转化率如图:
A、B、C、D、E中温度最高的点是
您最近一年使用:0次
名校
解题方法
8 . 下列推论正确的是
| A.S(g)+O2(g)=SO2(g)ΔH1,S(s)+O2(g)=SO2(g) ΔH2,则:ΔH1>ΔH2 |
| B.石墨燃烧热为393.5kJ·mol-1,则有2C(s)+O2(g)=2CO(g)ΔH=-393.5kJ·mol-1 |
| C.中和热为57.4kJ/mol,则有Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l) ΔH<-114.8kJ/mol |
| D.已知CaCO3(s)=CaO(s)+CO2(g)ΔH>0,该反应任何温度下都能自发进行 |
您最近一年使用:0次
2024-01-28更新
|
29次组卷
|
2卷引用:四川省成都市成华区某校2023-2024学年高二上学期12月月考化学试题
名校
解题方法
9 . 甲醇(CH3OH)是重要有机化工原料,现在全球的能源紧张,甲醇需求也在增大。利用合成气(主要成分为CO和H2)在催化剂的作用下合成甲醇的方法是:CO(g)+2H2(g) CH3OH(g) ∆H。
CH3OH(g) ∆H。
(1)已知该反应为自发反应,则∆H___________ 0。(填“>”,“<”或“=”)
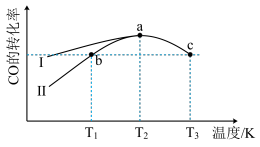
(2)向恒容密闭容器中充入一定量的CO和H2,在使用不同催化剂时,相同时间t内测得CO的转化率随温度的变化如下图所示,有关说法不正确的是___________。
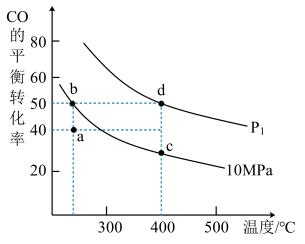
(3)已知:v(正)=k(正)·p(CO)·p2(H2),v(逆)=k(逆)·p(CH3OH);p(CO),p(H2),p(CH3OH)为各组分气体的分压(分压=气体的物质的量分数×体系总压)。在密闭容器中按物质的量之比为1:2充入CO和H2,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。
①P1___________ 10Mpa(填“>”或“<”);
②b、c、d三点平衡常数Kb、Kc、Kd三者之间的关系为___________ 。
③实际工业生产往往采用300-400℃和10Mpa的条件,其原因可能有___________ 。(至少写出两方面的原因)
④在10Mpa下,求a点的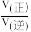 =
=___________ 。(保留1位小数)
 CH3OH(g) ∆H。
CH3OH(g) ∆H。(1)已知该反应为自发反应,则∆H
(2)向恒容密闭容器中充入一定量的CO和H2,在使用不同催化剂时,相同时间t内测得CO的转化率随温度的变化如下图所示,有关说法不正确的是___________。

| A.使用催化剂Ⅰ时,反应的活化能较高 |
| B.b点时v正>v逆。 |
| C.KT1对应的平衡常数等于KT3对应的平衡常数 |
| D.在相同时间t内,理论上最佳生产温度应为T2 |
(3)已知:v(正)=k(正)·p(CO)·p2(H2),v(逆)=k(逆)·p(CH3OH);p(CO),p(H2),p(CH3OH)为各组分气体的分压(分压=气体的物质的量分数×体系总压)。在密闭容器中按物质的量之比为1:2充入CO和H2,测得平衡混合气体中CO的平衡转化率随温度、压强的变化关系如图所示。

①P1
②b、c、d三点平衡常数Kb、Kc、Kd三者之间的关系为
③实际工业生产往往采用300-400℃和10Mpa的条件,其原因可能有
④在10Mpa下,求a点的
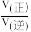 =
=
您最近一年使用:0次
名校
解题方法
10 . 工业上 加氢制
加氢制 ,为
,为 的减排与再利用提供了一种新策略,该过程中存在如下反应:
的减排与再利用提供了一种新策略,该过程中存在如下反应:
反应Ⅰ:
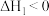
反应Ⅱ:

回答下列问题:
(1)已知: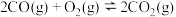
 ,则反应
,则反应

________ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(2)关于反应Ⅰ,下列说法正确的有___________(填标号)。
(3)向恒压(p)密闭装置中充入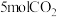 和
和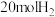 ,在不同温度下同时发生反应Ⅰ和Ⅱ,达平衡时,测得
,在不同温度下同时发生反应Ⅰ和Ⅱ,达平衡时,测得 和
和 的物质的量
的物质的量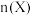 随温度
随温度 变化关系如图所示。
变化关系如图所示。

①曲线 对应物质为
对应物质为____ (填化学式)。
② 达平衡时,反应Ⅰ的平衡常数Kp=
达平衡时,反应Ⅰ的平衡常数Kp=____ (列计算式即可)。
③结合图像分析,达平衡时装置中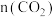 随温度升高的变化趋势为
随温度升高的变化趋势为____ (填标号)。
A.减小 B.增大 C.先减小后增大 D.先增大后减小
④工业制备 通常控制温度在
通常控制温度在 ℃之间的原因是
℃之间的原因是____ 。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
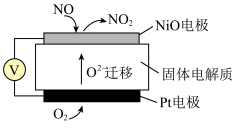
①Pt电极上发生的是______ 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:________ 。
 加氢制
加氢制 ,为
,为 的减排与再利用提供了一种新策略,该过程中存在如下反应:
的减排与再利用提供了一种新策略,该过程中存在如下反应:反应Ⅰ:

反应Ⅱ:


回答下列问题:
(1)已知:
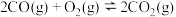
 ,则反应
,则反应

 、
、 、
、 的代数式表示)。
的代数式表示)。(2)关于反应Ⅰ,下列说法正确的有___________(填标号)。
| A.反应物的键能之和高于生成物的键能之和 |
| B.低温条件有利于该反应自发进行 |
| C.混合气体的平均摩尔质量不再改变,说明反应已达平衡 |
D.恒容条件下,充入更多的 能提高单位体积活化分子的百分数 能提高单位体积活化分子的百分数 |
(3)向恒压(p)密闭装置中充入
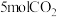 和
和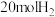 ,在不同温度下同时发生反应Ⅰ和Ⅱ,达平衡时,测得
,在不同温度下同时发生反应Ⅰ和Ⅱ,达平衡时,测得 和
和 的物质的量
的物质的量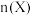 随温度
随温度 变化关系如图所示。
变化关系如图所示。
①曲线
 对应物质为
对应物质为②
 达平衡时,反应Ⅰ的平衡常数Kp=
达平衡时,反应Ⅰ的平衡常数Kp=③结合图像分析,达平衡时装置中
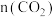 随温度升高的变化趋势为
随温度升高的变化趋势为A.减小 B.增大 C.先减小后增大 D.先增大后减小
④工业制备
 通常控制温度在
通常控制温度在 ℃之间的原因是
℃之间的原因是(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:

①Pt电极上发生的是
②写出NiO电极的电极反应式:
您最近一年使用:0次



