1 . 已知:常温下, 、
、 、
、 的溶度积依次为
的溶度积依次为 、
、 、
、 ,化学反应中,平衡常数
,化学反应中,平衡常数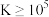 即认为反应能完全进行,不可逆,下列叙述正确的是
即认为反应能完全进行,不可逆,下列叙述正确的是
 、
、 、
、 的溶度积依次为
的溶度积依次为 、
、 、
、 ,化学反应中,平衡常数
,化学反应中,平衡常数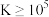 即认为反应能完全进行,不可逆,下列叙述正确的是
即认为反应能完全进行,不可逆,下列叙述正确的是A.溶解度: |
B.向含 废水中加入 废水中加入 ,可完全除去 ,可完全除去 |
C.在含 、 、 、 、 的溶液中通入 的溶液中通入 ,一定最先析出 ,一定最先析出 |
D.在饱和 溶液中, 溶液中, |
您最近一年使用:0次
名校
解题方法
2 . 室温下,用 溶液吸收
溶液吸收 的过程如图所示。
的过程如图所示。 ,
, 。
。
下列说法正确的是
 溶液吸收
溶液吸收 的过程如图所示。
的过程如图所示。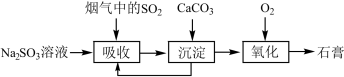
 ,
, 。
。下列说法正确的是
A.吸收烟气后的溶液中: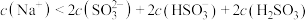 |
B.用0.100 的 的 溶液吸收 溶液吸收 ,当溶液的pH=7时,溶液中: ,当溶液的pH=7时,溶液中: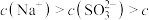  |
| C.检测“氧化”操作得到的产物的实验方案:取少量氧化产物溶于水,静置,在上层清液中滴加氯化钡溶液,若有白色沉淀生成,则说明已被氧化 |
D.“沉淀”操作得到的上层清液中: |
您最近一年使用:0次
3 . 下列离子方程式正确且符合题意的是
A.向 浊液中滴加 浊液中滴加 溶液产生蓝色沉淀: 溶液产生蓝色沉淀: |
B.向 溶液中滴加 溶液中滴加 溶液产生气泡: 溶液产生气泡: |
C.向变质的 溶液中滴加 溶液中滴加 溶液,溶液变红色: 溶液,溶液变红色: |
D.向 白色浊液中滴加氨水,溶液变澄清: 白色浊液中滴加氨水,溶液变澄清: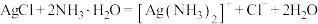 |
您最近一年使用:0次
4 . 由下列实验步骤得到的实验现象、结论或解释均正确的是
| 选项 | 实验步骤 | 实验现象 | 结论或解释 |
| A | 向 溶液中滴加酸性 溶液中滴加酸性 溶液 溶液 | 溶液紫色褪去 |  具有还原性 具有还原性 |
| B | 用玻璃棒蘸取NaClO溶液点在pH试纸上 | 试纸变白 | NaClO溶液呈中性 |
| C | 向 溶液中同时通入 溶液中同时通入 和 和 | 出现白色沉淀 | 白色沉淀为 |
| D | 向2mL 溶液中先滴加4滴 溶液中先滴加4滴 KCl溶液,再滴加4滴 KCl溶液,再滴加4滴 KI溶液 KI溶液 | 先产生白色沉淀,再产生黄色沉淀 | 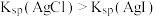 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 某温度下,分别向10.00mL0.1mol/L的KCl和K2CrO4溶液中滴加0.1mol/L AgNO3溶液,滴加过程中-lgc(M)(M为Cl-或 )与AgNO3溶液体积(V)的变化关系如图所示(忽略溶液体积变化,
)与AgNO3溶液体积(V)的变化关系如图所示(忽略溶液体积变化,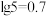 下列说法正确的是
下列说法正确的是
 )与AgNO3溶液体积(V)的变化关系如图所示(忽略溶液体积变化,
)与AgNO3溶液体积(V)的变化关系如图所示(忽略溶液体积变化,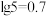 下列说法正确的是
下列说法正确的是 
| A.曲线L2表示lgc(Cl-)与V(AgNO3)的变化关系 |
| B.该温度下,Ksp(Ag2CrO4)=4.0×10-12 |
| C.x = 7.9 |
| D.相同实验条件下,若改为0.05mol/L的KCl和K2CrO4溶液,则曲线L2中N点移到Q点 |
您最近一年使用:0次
6 . 室温下,已知 ,饱和
,饱和 溶液中
溶液中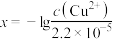 与pH的关系如图所示。向
与pH的关系如图所示。向 的Na2S溶液(pH=12.4)中加入一定量的CuSO4。下列说法正确的是
的Na2S溶液(pH=12.4)中加入一定量的CuSO4。下列说法正确的是
 ,饱和
,饱和 溶液中
溶液中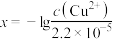 与pH的关系如图所示。向
与pH的关系如图所示。向 的Na2S溶液(pH=12.4)中加入一定量的CuSO4。下列说法正确的是
的Na2S溶液(pH=12.4)中加入一定量的CuSO4。下列说法正确的是
A.室温下 的 的 数量级为 数量级为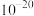 |
B.反应 的平衡常数为 的平衡常数为 |
C.室温下,CuS在等浓度的Na2S和H2S溶液中的 不相等 不相等 |
D.反应后的溶液中存在离子浓度关系: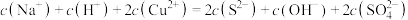 |
您最近一年使用:0次
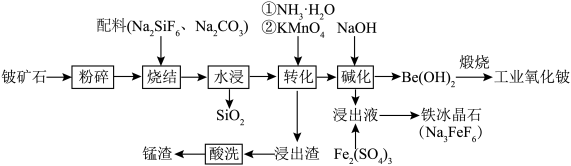
7 . 铍作为一种稀有元素,在航空航天、电子加工等领域具有重要意义。用铍矿石(含BeO及少量Ca、Mg、Mn元素)与配料生产工业氧化铍的工艺流程如下: 的还原产物为
的还原产物为 。回答下列问题:
。回答下列问题:
(1)若缺少粉碎步骤,产生的影响为_______ 。
(2)烧结时,若铍矿石中BeO恰好转化为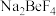 ,Si元素转化为
,Si元素转化为 ,则BeO发生反应的化学方程式为
,则BeO发生反应的化学方程式为_______ 。
(3)水浸后溶液中仍有未反应的 ,加入
,加入 后会转化为
后会转化为 沉淀,所得产物可除去溶液中的钙、镁元素,
沉淀,所得产物可除去溶液中的钙、镁元素, 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(4)水浸后溶液中Mn元素以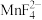 形式存在,加入稍过量
形式存在,加入稍过量 溶液煮沸50min至溶液
溶液煮沸50min至溶液______ 时说明反应结束。结合平衡移动原理解释酸洗时控制溶液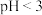 的原因:
的原因:______ 。
(5)碱化时,室温下加入NaOH,控制 ,析出颗粒状的
,析出颗粒状的 ,所得浸出液中
,所得浸出液中 ,此时溶液中
,此时溶液中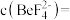
___  。已知
。已知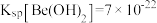 ,
,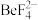 的解离常数
的解离常数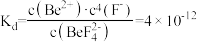
(6)碱化后浸出液中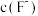 远高于排放标准,向其中加入硫酸铁生成
远高于排放标准,向其中加入硫酸铁生成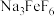 ,
, 为八面体结构,则Fe原子采取的杂化方式为
为八面体结构,则Fe原子采取的杂化方式为____ (填标号)。
A. B.
B. C.
C.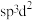
 的还原产物为
的还原产物为 。回答下列问题:
。回答下列问题:(1)若缺少粉碎步骤,产生的影响为
(2)烧结时,若铍矿石中BeO恰好转化为
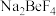 ,Si元素转化为
,Si元素转化为 ,则BeO发生反应的化学方程式为
,则BeO发生反应的化学方程式为(3)水浸后溶液中仍有未反应的
 ,加入
,加入 后会转化为
后会转化为 沉淀,所得产物可除去溶液中的钙、镁元素,
沉淀,所得产物可除去溶液中的钙、镁元素, 发生反应的离子方程式为
发生反应的离子方程式为(4)水浸后溶液中Mn元素以
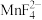 形式存在,加入稍过量
形式存在,加入稍过量 溶液煮沸50min至溶液
溶液煮沸50min至溶液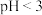 的原因:
的原因:(5)碱化时,室温下加入NaOH,控制
 ,析出颗粒状的
,析出颗粒状的 ,所得浸出液中
,所得浸出液中 ,此时溶液中
,此时溶液中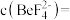
 。已知
。已知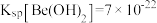 ,
,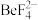 的解离常数
的解离常数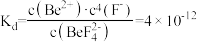
(6)碱化后浸出液中
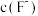 远高于排放标准,向其中加入硫酸铁生成
远高于排放标准,向其中加入硫酸铁生成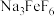 ,
, 为八面体结构,则Fe原子采取的杂化方式为
为八面体结构,则Fe原子采取的杂化方式为A.
 B.
B. C.
C.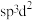
您最近一年使用:0次
2024-05-31更新
|
99次组卷
|
2卷引用:湖南省2024届普通高中高三下学期学业水平选择性考试临考预测押题密卷化学试题(A卷)
名校
解题方法
8 . 高砷烟尘(主要成分有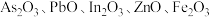 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;
② 在
在 易分解为
易分解为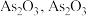 难溶于水;
难溶于水;
③ 。
。
回答下列问题:
(1)滤渣的主要成分为_______ (填化学式)。
(2)“高压酸浸”时, 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为_______ 。 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ 。已知 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为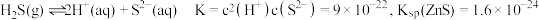 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
_______ 。
(4)“还原”后溶液酸性增强,主要原因是_______ (用离子方程式表示)。
(5)“结晶”操作为_______ 、过滤、洗涤、干燥。
(6)“萃余液”中含有的金属阳离子为_______ (填离子符号),将 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为_______ 。
(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是_______ ,该晶胞的六个面均为矩形,上、下底面的晶胞参数为 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为_______ (用含a、b、d的式子表示)。
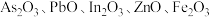 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 ,和金属铟的工业流程如下:
,和金属铟的工业流程如下: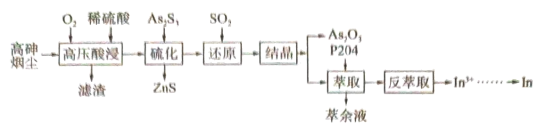
 在酸性溶液中以
在酸性溶液中以 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;②
 在
在 易分解为
易分解为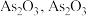 难溶于水;
难溶于水;③
 。
。回答下列问题:
(1)滤渣的主要成分为
(2)“高压酸浸”时,
 的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过 时,
时, 的浸出率随硫酸浓度增大而略微减小的原因可能为
的浸出率随硫酸浓度增大而略微减小的原因可能为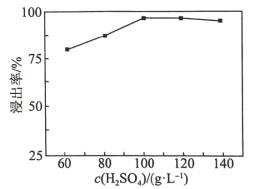
 ,发生反应的离子方程式为
,发生反应的离子方程式为 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为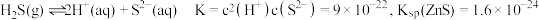 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
(4)“还原”后溶液酸性增强,主要原因是
(5)“结晶”操作为
(6)“萃余液”中含有的金属阳离子为
 溶液电解得到金属铟,阴极的电极反应式为
溶液电解得到金属铟,阴极的电极反应式为(7)硫化铟铜是一种新型的纳米材料,具有优异的光电性能和光催化性能。一种由S、
 三种元素组成的化合物的晶胞如图所示。采用
三种元素组成的化合物的晶胞如图所示。采用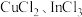 和
和 合成硫化铟铜薄膜,该反应的化学方程式是
合成硫化铟铜薄膜,该反应的化学方程式是 ,高为
,高为 ,晶体密度为
,晶体密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次
2024-05-31更新
|
173次组卷
|
5卷引用: 湖南省北师联盟2024届高三下学期模拟考试三模化学试题
解题方法
9 . 下列有关离子方程式错误 的是
A.向AgCl沉淀中加入过量氨水使AgCl溶解: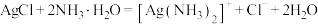 |
B.用 溶液处理锅炉水垢中的 溶液处理锅炉水垢中的 : : |
C.已知: 为二元弱碱,与足量浓 为二元弱碱,与足量浓 反应: 反应: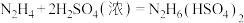 |
D.苯酚钠溶液中通入少量 气体: 气体: |
您最近一年使用:0次
解题方法
10 . 25℃时,将含有I-的溶液逐滴加入到含有Hg2+的溶液中,发生一系列可逆反应生成HgI+、HgI2(s)、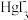 、
、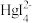 。其中,Hg2+、HgI+、
。其中,Hg2+、HgI+、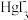 、
、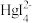 四种离子浓度的对数lgc与I-浓度的对数lgc(I-)关系如图所示(图中虚线及虚线的上方是HgI2的沉淀区)。下列说法正确的是
四种离子浓度的对数lgc与I-浓度的对数lgc(I-)关系如图所示(图中虚线及虚线的上方是HgI2的沉淀区)。下列说法正确的是
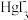 、
、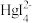 。其中,Hg2+、HgI+、
。其中,Hg2+、HgI+、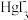 、
、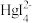 四种离子浓度的对数lgc与I-浓度的对数lgc(I-)关系如图所示(图中虚线及虚线的上方是HgI2的沉淀区)。下列说法正确的是
四种离子浓度的对数lgc与I-浓度的对数lgc(I-)关系如图所示(图中虚线及虚线的上方是HgI2的沉淀区)。下列说法正确的是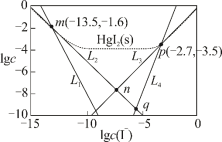
| A.Ksp(HgI2)的数量级为10-28 |
| B.n点的坐标为(-7.15,-7.95) |
C.反应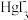 (aq) (aq) HgI2(s)+I-(aq)的平衡常数为K=10-0.8 HgI2(s)+I-(aq)的平衡常数为K=10-0.8 |
D.q点溶液中存在:c(H+)+2c(Hg2+)=c(OH-)+c(I-)+c(HgI )+c(HgI )+c(HgI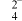 ) ) |
您最近一年使用:0次
2024-05-29更新
|
94次组卷
|
2卷引用:湖南省永州市2024届高三下学期第三次模拟考试化学试卷



