名校
解题方法
1 . 以钛铁矿(主要成分为FeO·TiO2,还含有MgO、CaO、SiO2等杂质)为原料合成锂离子电池的电极材料钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)的工艺流程如下:
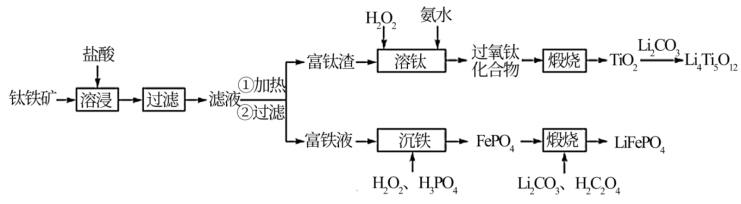
回答下列问题:
(1)“溶浸”后溶液中的金属阳离子主要包括Mg2+、TiOCl+___________ 。“滤液”经加热水解后转化为富钛渣(钛元素主要以TiO2·2H2O形式存在),写出上述转变的离子方程式:___________ 。
(2)“溶钛”过程反应温度不能太高,其原因是___________ 。
(3)“沉铁”步骤反应的化学方程式为___________ ,“沉铁”后的滤液经处理后可返回___________ 工序循环利用。
(4)“煅烧”制备LiFePO4过程中,Li2CO3和H2C2O4的理论投入量的物质的量之比为___________ 。
(5)以Li4Ti5O12和LiFePO4作电极组成电池,充电时发生反应:Li4Ti5O12+LiFePO4=Li4+xTi5O12+Li1-xFePO4(0<x<1),阳极的电极反应式为___________ 。
(6)从废旧LiFePO4电极中可回收锂元素。用硝酸充分溶浸废旧LiFePO4电极,测得浸取液中c(Li+)=4mol·L-1,加入等体积的碳酸钠溶液将Li+转化为Li2CO3沉淀 ,若沉淀中的锂元素占浸取液中锂元素总量的90%,则反应后的溶液中CO 的浓度为
的浓度为___________ mol·L-1[已知Ksp(Li2CO3)=1.6×10-3,假设反应后溶液体积为反应前两溶液之和]。

回答下列问题:
(1)“溶浸”后溶液中的金属阳离子主要包括Mg2+、TiOCl+
(2)“溶钛”过程反应温度不能太高,其原因是
(3)“沉铁”步骤反应的化学方程式为
(4)“煅烧”制备LiFePO4过程中,Li2CO3和H2C2O4的理论投入量的物质的量之比为
(5)以Li4Ti5O12和LiFePO4作电极组成电池,充电时发生反应:Li4Ti5O12+LiFePO4=Li4+xTi5O12+Li1-xFePO4(0<x<1),阳极的电极反应式为
(6)从废旧LiFePO4电极中可回收锂元素。用硝酸充分溶浸废旧LiFePO4电极,测得浸取液中c(Li+)=4mol·L-1,加入等体积的碳酸钠溶液将Li+转化为Li2CO3沉淀 ,若沉淀中的锂元素占浸取液中锂元素总量的90%,则反应后的溶液中CO
 的浓度为
的浓度为
您最近一年使用:0次
2021-08-06更新
|
1486次组卷
|
4卷引用:湖南省株洲市第八中学021-2022学年高三下学期5月月考化学试题
湖南省株洲市第八中学021-2022学年高三下学期5月月考化学试题九师联盟2021届高三下学期5月“考前练兵”联考理综化学试题宁夏回族自治区银川一中2022届高三二模理科综合化学试题(已下线)专题01 工艺流程专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)
2 . 已知相同温度下, 。某温度下,饱和溶液中
。某温度下,饱和溶液中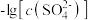 、
、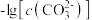 、与
、与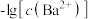 的关系如图所示。
的关系如图所示。
 。某温度下,饱和溶液中
。某温度下,饱和溶液中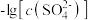 、
、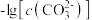 、与
、与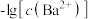 的关系如图所示。
的关系如图所示。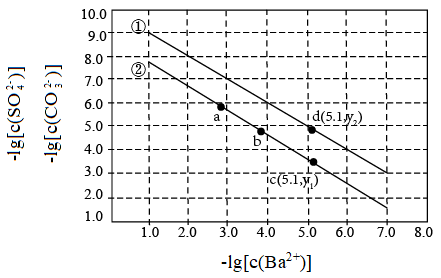
A.曲线①代表 的沉淀溶解曲线 的沉淀溶解曲线 |
B.该温度下 的 的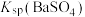 值为 值为 |
C.加适量 固体可使溶液由a点变到b点 固体可使溶液由a点变到b点 |
D. 时两溶液中 时两溶液中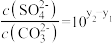 |
您最近一年使用:0次
2021-06-11更新
|
25708次组卷
|
71卷引用:湖南省株洲市第二中学2022-2023学年高二上学期期中考试化学试题
湖南省株洲市第二中学2022-2023学年高二上学期期中考试化学试题湖南省株洲九方中学2022-2023学年高二上学期期中考试化学试题湖南省株洲市第八中学2022-2023学年高二上学期期中考试化学试题2021年高考全国甲卷化学真题重庆市缙云教育联盟2020-2021学年高二下学期期末质量检测化学试题(已下线)第八章能力提升检测卷(精练)-2022年高考化学一轮复习讲练测(已下线)考点26 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)课时45 难溶电解质的溶解平衡-2022年高考化学一轮复习小题多维练(全国通用)湖南省邵阳邵东市第一中学2022届高三上学期第一次月考化学试题河北省石家庄市第一中学2021-2022学年高二上学期10月月考化学试卷(已下线)第24讲 沉淀溶解平衡(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)辽宁省东北育才学校2021-2022学年高二上学期期中考试化学试题河北省石家庄市第二中学2022届高三上学期11月第三次考试化学试题(已下线)2021年高考全国甲卷化学试题变式题(已下线)专题27 难溶电解质的溶解平衡(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)专题12 水溶液中的离子平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)第八单元 水溶液中的离子平衡(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)浙江省绍兴市诸暨中学2021-2022学年高二上学期期中考试(实验班)化学试题浙江省绍兴市诸暨中学2021-2022学年高二上学期期中考试(平行班)化学试题(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题13 水溶液中的离子平衡-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-练习山东省泰安市2021-2022学年高三下学期3月一模考试化学试题福建省三明第一中学2021-2022学年高二上学期第二次月考化学试题吉林省长春市2022届高三质量监测线上考试(三)理综化学试题(已下线)卷11 溶液中的离子平衡-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)卷09 水溶液中的离子平衡-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)【奋进985】08-备战2022年高考化学名校进阶模拟卷(通用版)云南省丽江市第一高级中学2021-2022学年高二下学期4月月考化学试题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点07 图像数据和结果的分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)回归教材重难点04 水溶液中的离子平衡-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)河南省商丘市五校2021-2022学年高二下学期5月联考化学试题(已下线)专题6 Ksp专练(已下线)专题10水溶液中的离子平衡-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题10水溶液中的离子平衡-五年(2018~2022)高考真题汇编(全国卷)黑龙江省饶河县高级中学2021-2022学年上学期期末考试化学试题(已下线)考点29 沉淀溶解平衡-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第33练 沉淀溶解平衡-2023年高考化学一轮复习小题多维练(全国通用)云南省玉溪市通海县第一中学2021-2022学年高二上学期期末考试化学试题第三章 综合拔高练(已下线)微专题39 水溶液中平衡图像的拓展与探析-备战2023年高考化学一轮复习考点微专题(已下线)第24讲 沉淀溶解平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)微专题42 四大平衡常数的计算与应用-备战2023年高考化学一轮复习考点微专题江苏省海安市立发中学2022-2023学年高三上学期学情检测卷(二)化学试题辽宁省沈阳市五校协作体2022-2023学年高二上学期期中考试化学试题(已下线)专题06 水溶液中的离子平衡(讲)-2023年高考化学二轮复习讲练测(新高考专用)广东省华南师范大学附属中学2022-2023学年高二上学期阶段检测化学B卷试题吉林省长春市第二实验中学2022-2023学年高二上学期期末考试化学试题(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 题型专攻4 电解质溶液各类图像的分析(已下线)第八章 水溶液中的离子反应与平衡 第53讲 沉淀溶解平衡图像的分析(已下线)题型142 有关沉淀溶解平衡图像湖南省岳阳市华容县普通高中2023届高三新高考适应性考试化学试题江西省赣州市重点中学九校联盟2022-2023学年高二下学期第一次月考化学试题(已下线)素养卷05 电解质溶液中微粒变化图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)题型27 沉淀溶解平衡常数及其应用图象(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)专题09 水溶液中的离子平衡-2023年高考化学真题题源解密(新高考专用)黑龙江省齐齐哈尔市讷河市第二中学等3校2022-2023学年高二下学期开学考试化学试题微专题(12) 电解质溶液中的两类特殊图像微专题(九)——沉淀溶解平衡曲线(已下线)考点29 沉淀溶解平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 沉淀溶解平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)广东省广州市真光中学2023-2024学年高二上学期12月月考化学试题山东省菏泽市鄄城县第一中学2023-2024学年高三上学期1月月考化学试题山东省青岛第一中学2023-2024学年高二上学期第二次月考化学试卷云南省大理白族自治州实验中学2021-2022学年高二上学期10月月考化学试题福建省福建师范大学附属中学2023-2024学年高三上学期开学考化学试题
名校
解题方法
3 . 某电子厂排放的酸性废液中含有Fe3+、Cu2+、Fe2+和Cl-等离子,以这种废液为原料设计制备高纯Fe2O3的工艺流程如图所示(部分操作和条件略)。已知:①HCl(浓)+FeCl3 HFeCl4 (易溶于有机溶剂)②Ksp[Fe(OH)3]=8.0×10-38,1g2≈0.3。下列说法不正确的是
HFeCl4 (易溶于有机溶剂)②Ksp[Fe(OH)3]=8.0×10-38,1g2≈0.3。下列说法不正确的是
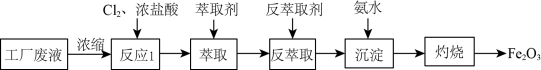
 HFeCl4 (易溶于有机溶剂)②Ksp[Fe(OH)3]=8.0×10-38,1g2≈0.3。下列说法不正确的是
HFeCl4 (易溶于有机溶剂)②Ksp[Fe(OH)3]=8.0×10-38,1g2≈0.3。下列说法不正确的是
| A.反应1所发生的反应中存在氧化还原反应 |
| B.在反萃取过程中利用了平衡移动原理,可用水作为反萃取剂 |
| C.氨水的作用是调节pH使Fe3+沉淀,相关反应离子方程式为:Fe3++3OH-=Fe(OH)3↓ |
| D.为使Fe3+沉淀完全(浓度小于1×10-5mol•L-1),需调节溶液pH>3.3 |
您最近一年使用:0次
2021-05-29更新
|
515次组卷
|
3卷引用:湖南省株洲市茶陵县第一中学2022届高三下学期第二次模拟考试化学试题
4 . 五氧化二钒常用于生产硫酸或石油精炼的催化剂。某化工厂从废钒催化剂中(含有K2SO4、V2O5、V2O4、SiO2、Fe2O3、Al2O3等)回收五氧化二钒和硫酸钾,既能避免环境污染,又能节约资源。回收工艺流程如下:

已知:①“酸浸”时V2O5和V2O4先与稀硫酸反应分别生成VO 和VO2+。
和VO2+。
②有机萃取剂萃取VO2+的能力比萃取VO 的能力强。
的能力强。
③溶液中VO 与VO
与VO 可相互转化:VO
可相互转化:VO +H2O
+H2O VO
VO +2H+。
+2H+。
(1)“酸浸”时,FeSO4的作用是___________ 。
(2)滤渣2的成分主要有___________ (填化学式)。
(3)“萃取”和“反萃取”时,将发生R2(SO4)n(水层)+2nHA(有机层) 2RAn(有机层)+nH2SO4(水层)(R表示VO2+,HA表示有机萃取剂),“反萃取”操作加入的试剂是
2RAn(有机层)+nH2SO4(水层)(R表示VO2+,HA表示有机萃取剂),“反萃取”操作加入的试剂是___________ (填化学式)。
(4)“氧化”过程中发生反应的离子方程式为___________ 。若该废钒催化剂中V2O5的含量为10%(原料中所有的钒已换算成V2O5)。该厂检验科实验室取100g待处理样品,按照上述流程进行实验。当加入150 mL 0.1 mol·L-1的KClO3溶液时,溶液中的钒元素恰好完全反应,则该工艺中钒的最大回收率是___________ %(假设与KClO3反应后的操作步骤中钒元素无损失)。
(5)沉钒率是回收钒的关键之一。
①“沉钒”时,钒元素主要以___________ 形式存在(填相应的离子符号)。
②实验发现,温度超过80℃以后沉钒率下降(如图),可能的原因是___________ 。


已知:①“酸浸”时V2O5和V2O4先与稀硫酸反应分别生成VO
 和VO2+。
和VO2+。②有机萃取剂萃取VO2+的能力比萃取VO
 的能力强。
的能力强。③溶液中VO
 与VO
与VO 可相互转化:VO
可相互转化:VO +H2O
+H2O VO
VO +2H+。
+2H+。(1)“酸浸”时,FeSO4的作用是
(2)滤渣2的成分主要有
(3)“萃取”和“反萃取”时,将发生R2(SO4)n(水层)+2nHA(有机层)
 2RAn(有机层)+nH2SO4(水层)(R表示VO2+,HA表示有机萃取剂),“反萃取”操作加入的试剂是
2RAn(有机层)+nH2SO4(水层)(R表示VO2+,HA表示有机萃取剂),“反萃取”操作加入的试剂是(4)“氧化”过程中发生反应的离子方程式为
(5)沉钒率是回收钒的关键之一。
①“沉钒”时,钒元素主要以
②实验发现,温度超过80℃以后沉钒率下降(如图),可能的原因是

您最近一年使用:0次
2021-05-11更新
|
276次组卷
|
3卷引用:湖南省株洲市九方中学2022届高三下学期第二次模拟考试化学试题
名校
解题方法
5 . 废旧电池的回收利用对保护环境、节约资源意义重大。某化学兴趣小组利用废旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO,部分实验过程如图所示。下列叙述不正确的是
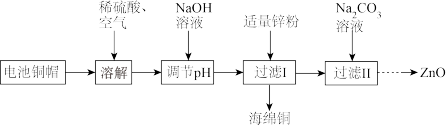

| A.“溶解”过程中发生的反应有2Cu+O2+4H+=2Cu2++2H2O |
| B.“溶解”操作中的空气可以用双氧水代替 |
| C.“调节pH”过程中NaOH溶液的作用是使Cu2+转化为Cu(OH)2 |
| D.“过滤II”所得滤渣只需洗涤,无需干燥 |
您最近一年使用:0次
2021-05-11更新
|
925次组卷
|
5卷引用:湖南省株洲市九方中学2022届高三下学期第二次模拟考试化学试题
湖南省株洲市九方中学2022届高三下学期第二次模拟考试化学试题山西省晋中市2021届高三下学期5月统一模拟考试(三模) 理综化学试题(已下线)专题14物质的反应和转化-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题13物质的反应和转化-2022年高考真题+模拟题汇编(全国卷)(已下线)专题14物质的反应和转化-五年(2018~2022)高考真题汇编(全国卷)
名校
6 . 实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)酸溶过程中主要反应的热化学方程式为MgCO3(s)+2H+(aq)=Mg2+(aq)+CO2(g)+H2O(l)ΔH=-50.4kJ·mol-1;Mg2SiO4(s)+4H+(aq)=2Mg2+(aq)+H2SiO3(s)+H2O(l)ΔH=-225.4kJ·mol-1,酸溶需加热的目的是___________ ;
(2)加入H2O2氧化时发生反应的离子方程式为___________ 。
(3)用如图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。

①实验装置图中仪器A的名称为___________ 。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,___________ 、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,___________ ,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。

(1)酸溶过程中主要反应的热化学方程式为MgCO3(s)+2H+(aq)=Mg2+(aq)+CO2(g)+H2O(l)ΔH=-50.4kJ·mol-1;Mg2SiO4(s)+4H+(aq)=2Mg2+(aq)+H2SiO3(s)+H2O(l)ΔH=-225.4kJ·mol-1,酸溶需加热的目的是
(2)加入H2O2氧化时发生反应的离子方程式为
(3)用如图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。

①实验装置图中仪器A的名称为
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,
您最近一年使用:0次
2021-05-01更新
|
180次组卷
|
4卷引用:湖南省株洲市第一中学2021届高三下学期第三次模拟检测化学试题
名校
解题方法
7 . 以铁镍合金(含少量铜)为原料,生产电极材料 的部分工艺流程如下:
的部分工艺流程如下:
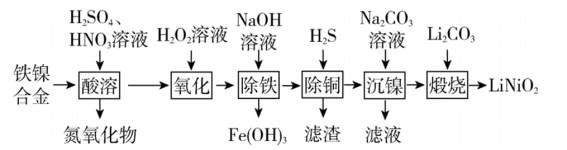
已知:(1)表中列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 计算)。
计算)。
(2)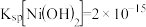 ;
;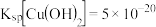 。
。
回答下列问题。
(1) 中
中 的化合价为
的化合价为__ 。“酸溶”时 转化为
转化为 ,该过程中温度控制在70~80℃的原因是
,该过程中温度控制在70~80℃的原因是__ 。
(2)“酸溶”时镍生成 ,写出铁镍合金中镍参与反应的离子方程式:
,写出铁镍合金中镍参与反应的离子方程式:____ 。
(3)“除铜”时若选用 ,会导致部分
,会导致部分 也产生沉淀,当溶液中
也产生沉淀,当溶液中 、
、 沉淀同时存在时,溶液中
沉淀同时存在时,溶液中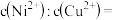
__ 。
(4)“沉镍”时得到碳酸镍( )沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得
)沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得 ,该反应的化学方程式为
,该反应的化学方程式为____ 。
(5)“沉镍”后的滤液中主要是 和
和 ,当溶液中二者的物质的量之比为1:1时,溶液中离子浓度由大到小的顺序是
,当溶液中二者的物质的量之比为1:1时,溶液中离子浓度由大到小的顺序是__ 。
(6)已知铁镍合金中镍的质量分数为29.5%,称取10.0g合金,最终制得4.7g ,则合金中
,则合金中 的利用率为
的利用率为____ (保留两位有效数字)。
 的部分工艺流程如下:
的部分工艺流程如下:
已知:(1)表中列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0
 计算)。
计算)。| 开始沉淀的pH | 沉淀完全的pH | |
 | 6.7 | 9.5 |
 | 1.1 | 3.2 |
 | 5.8 | 8.8 |
 | 4.2 | 7.2 |
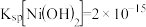 ;
;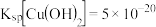 。
。回答下列问题。
(1)
 中
中 的化合价为
的化合价为 转化为
转化为 ,该过程中温度控制在70~80℃的原因是
,该过程中温度控制在70~80℃的原因是(2)“酸溶”时镍生成
 ,写出铁镍合金中镍参与反应的离子方程式:
,写出铁镍合金中镍参与反应的离子方程式:(3)“除铜”时若选用
 ,会导致部分
,会导致部分 也产生沉淀,当溶液中
也产生沉淀,当溶液中 、
、 沉淀同时存在时,溶液中
沉淀同时存在时,溶液中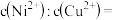
(4)“沉镍”时得到碳酸镍(
 )沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得
)沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得 ,该反应的化学方程式为
,该反应的化学方程式为(5)“沉镍”后的滤液中主要是
 和
和 ,当溶液中二者的物质的量之比为1:1时,溶液中离子浓度由大到小的顺序是
,当溶液中二者的物质的量之比为1:1时,溶液中离子浓度由大到小的顺序是(6)已知铁镍合金中镍的质量分数为29.5%,称取10.0g合金,最终制得4.7g
 ,则合金中
,则合金中 的利用率为
的利用率为
您最近一年使用:0次
2021-04-19更新
|
278次组卷
|
4卷引用:湖南省株洲市南方中学2021-2022学年高三下学期4月月考化学试题
湖南省株洲市南方中学2021-2022学年高三下学期4月月考化学试题辽宁省“决胜新高考·名校交流“2021届高三3月联考化学试题(已下线)微专题18 金属及其化合物制备流程(Ni)-备战2022年高考化学考点微专题内蒙古海拉尔第二中学2021-2022学年高三上学期期末考试理科综合化学试题
8 . 锌灰是热镀锌厂和电解锌厂在生产过程中产生的一种副产品,主要成分为ZnO、ZnCl2,还含有SiO2、CuO、PbO和FeO。工业上利用锌灰制ZnSO4·7H2O晶体,进而获取ZnO,并探索氢电极增压还原氧化锌电解法制锌的方法,工艺流程如图所示:
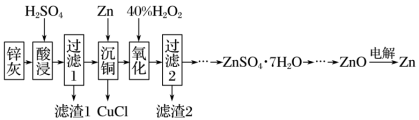
已知:Cu++Cl-=CuCl↓。回答下列问题:
(1)酸浸时,H2SO4应选用____ (填“浓硫酸”或“稀硫酸”)。
(2)滤渣1的主要成分有____ 。
(3)写出“沉铜”时的离子方程式:_____ 。
(4)“氧化”后,加入聚丙烯酰胺絮凝剂并加热搅拌,其目的是___ 。
(5)氢电极增压还原氧化锌的装置如图所示,储罐内ZnO溶解后形成Zn(OH) 离子,每溶解1molZnO需消耗
离子,每溶解1molZnO需消耗___ molKOH。电解池中的总反应离子方程式为____ 。
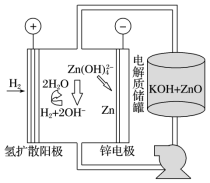
(6)该工艺废水中含有Zn2+,排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2S⇌ZnS(s)+2H+。处理后的废水中部分微粒浓度为
处理后的废水的pH=____ ,c(Zn2+)=____ 。[已知:Ksp(ZnS)=1.0×10-23,Ka1(H2S)=1.0×10-7,Ka2(H2S)=1.0×10-14,Ka(CH3COOH)=2.0×10-5]

已知:Cu++Cl-=CuCl↓。回答下列问题:
(1)酸浸时,H2SO4应选用
(2)滤渣1的主要成分有
(3)写出“沉铜”时的离子方程式:
(4)“氧化”后,加入聚丙烯酰胺絮凝剂并加热搅拌,其目的是
(5)氢电极增压还原氧化锌的装置如图所示,储罐内ZnO溶解后形成Zn(OH)
 离子,每溶解1molZnO需消耗
离子,每溶解1molZnO需消耗
(6)该工艺废水中含有Zn2+,排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2S⇌ZnS(s)+2H+。处理后的废水中部分微粒浓度为
| 微粒 | H2S | CH3COOH | CH3COO- |
| 浓度/(mol·L-1) | 0.10 | 0.05 | 0.10 |
处理后的废水的pH=
您最近一年使用:0次
2021-04-08更新
|
413次组卷
|
7卷引用:湖南省株洲市第二中学2022届高三下学期期中考试化学试题
9 . 下列实验操作和事实与对应结论描述正确的是
| 选项 | 实验操作和事实 | 结论 |
| A | 将C和 的固体混合物高温加热 的固体混合物高温加热 | 氧化性: |
| B | 用洁净铁丝蘸取溶液进行焰色试验,火焰呈黄色 | 溶液中存在 ,不存在 ,不存在 |
| C | 室温下,向浓度均为0.01 的 的 和 和 混合溶液中滴加 混合溶液中滴加 溶液出现白色沉淀 溶液出现白色沉淀 | 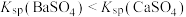 |
| D | 向溶有 的 的 溶液中通入气体X,出现白色沉淀 溶液中通入气体X,出现白色沉淀 | X可能是 或 或 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-03-28更新
|
347次组卷
|
2卷引用:湖南省株洲市第二中学2022届高三下学期期中考试化学试题
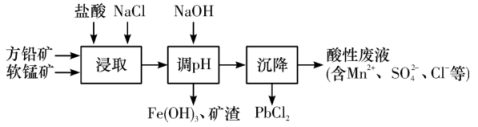
10 . PbCl2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如图所示。
已知:
ⅰ.PbCl2微溶于水
ⅱ.PbCl2(s)+2Cl-(aq) PbCl
PbCl (aq)ΔH>0
(aq)ΔH>0
(1)浸取过程中MnO2与PbS发生反应的离子反应方程式为__ 。
(2)由于PbCl2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加入饱和NaCl溶液可有效避免这一现象,原因是__ 。
(3)调pH的目的是__ 。
(4)沉降池中获得PbCl2采取的两种措施是__ 。(根据平衡的观点)
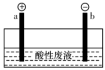
(5)通过电解酸性废液可重新获得MnO2,装置示意图如图,获得MnO2的电极反应式为__ 。

已知:
ⅰ.PbCl2微溶于水
ⅱ.PbCl2(s)+2Cl-(aq)
 PbCl
PbCl (aq)ΔH>0
(aq)ΔH>0(1)浸取过程中MnO2与PbS发生反应的离子反应方程式为
(2)由于PbCl2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加入饱和NaCl溶液可有效避免这一现象,原因是
(3)调pH的目的是
(4)沉降池中获得PbCl2采取的两种措施是
(5)通过电解酸性废液可重新获得MnO2,装置示意图如图,获得MnO2的电极反应式为

您最近一年使用:0次



