名校
1 . 钪(Sc)是一种功能强大但产量稀少的稀土金属,广泛用于航天、激光、导弹等尖端科学领域。钛铁矿主要成分为钛酸亚铁(FeTiO3),还含有少量Sc2O3、MgO、SiO2等杂质,从钛铁矿中提取钪的流程如图:

已知:①室温下TiO2+完全沉淀的pH为1.05,Fe3+完全沉淀的pH为3.2
②Ksp[Sc(OH)3]=1.25×10-33,lg2=0.3
回答下列问题:
(1)“酸浸”后钛主要以TiOSO4的形式存在于溶液中,TiOSO4中Ti元素的化合价为___ 。
(2)“滤渣1”的主要成分是___ 。
(3)氢氧化钪[Sc(OH)3]是白色固体,不溶于水,化学性质与Al(OH)3相似,能与NaOH溶液反应生成Na3[Sc(OH)6],写出该反应的离子方程式___ 。
(4)探讨影响钪的萃取率的因素:
①钪的萃取率(E%)与O/A值[萃取剂体积(O)和废酸液体积(A)之比]的关系如图,应选择最合适的O/A值为___ 。
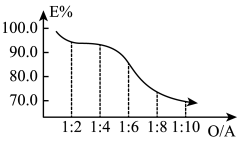
②温度对钪、钛的萃取率影响情况见表,合适的萃取温度为10~15℃,其理由是___ 。
(5)“酸溶”后滤液中存在的金属阳离子Sc3+、TiO2+、Fe3+浓度均小于0.01mol·L-1,再用氨水调节溶液pH使TiO2+、Fe3+沉淀完全而Sc3+不沉淀,则调pH应控制的范围是___ 。
(6)“沉钪”得到草酸钪[Sc(C2O4)3],将其置于___ (填仪器名称)中,在空气中充分灼烧得到Sc2O3和一种无毒气体,则该反应的氧化剂与还原剂物质的量之比为___ 。

已知:①室温下TiO2+完全沉淀的pH为1.05,Fe3+完全沉淀的pH为3.2
②Ksp[Sc(OH)3]=1.25×10-33,lg2=0.3
回答下列问题:
(1)“酸浸”后钛主要以TiOSO4的形式存在于溶液中,TiOSO4中Ti元素的化合价为
(2)“滤渣1”的主要成分是
(3)氢氧化钪[Sc(OH)3]是白色固体,不溶于水,化学性质与Al(OH)3相似,能与NaOH溶液反应生成Na3[Sc(OH)6],写出该反应的离子方程式
(4)探讨影响钪的萃取率的因素:
①钪的萃取率(E%)与O/A值[萃取剂体积(O)和废酸液体积(A)之比]的关系如图,应选择最合适的O/A值为

②温度对钪、钛的萃取率影响情况见表,合适的萃取温度为10~15℃,其理由是
| T/℃ | 5 | 10 | 15 | 25 | 30 |
| 钪的萃取率/% | 91.3 | 96 | 97.1 | 97.3 | 98.0 |
| 钛的萃取率/% | 0.94 | 0.95 | 2.10 | 3.01 | 4.20 |
(5)“酸溶”后滤液中存在的金属阳离子Sc3+、TiO2+、Fe3+浓度均小于0.01mol·L-1,再用氨水调节溶液pH使TiO2+、Fe3+沉淀完全而Sc3+不沉淀,则调pH应控制的范围是
(6)“沉钪”得到草酸钪[Sc(C2O4)3],将其置于
您最近一年使用:0次
2022-02-19更新
|
378次组卷
|
2卷引用:湖南省株洲市茶陵县第一中学2022届高三下学期期中考试化学试题
名校
2 . 某温度下,向体积均为20.00mL、浓度均为0.1mol•L-1的NaCl溶液、Na2CrO4溶液中分别滴加0.1mol•L-1的AgNO3溶液,滴定过程中的pX(PX=-lgX,X=Cl-、CrO )与滴加AgNO3溶液体积的关系如图所示。(已知:lg3=0.47)下列说法错误的是
)与滴加AgNO3溶液体积的关系如图所示。(已知:lg3=0.47)下列说法错误的是
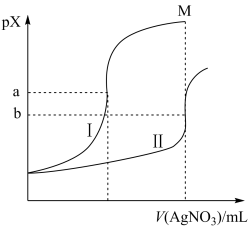
 )与滴加AgNO3溶液体积的关系如图所示。(已知:lg3=0.47)下列说法错误的是
)与滴加AgNO3溶液体积的关系如图所示。(已知:lg3=0.47)下列说法错误的是
| A.曲线Ⅰ表示AgNO3溶液滴定NaCl溶液的过程 |
| B.Ksp(Ag2CrO4)=4.0×10-3b |
| C.其他条件不变,如果NaCl溶液浓度改为0.05mol•L-1,则滴定终点向上移动 |
| D.M点的纵坐标约为2a-1.47 |
您最近一年使用:0次
2022-01-12更新
|
664次组卷
|
7卷引用:湖南省攸县第一中学2023届高三第七次月考化学试题
湖南省攸县第一中学2023届高三第七次月考化学试题安徽省淮北市2022届高三第一次模拟考试化学试题(已下线)专题19 沉淀溶解平衡的图像问题分析-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)专项13 水溶液中的离子平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)进阶训练7湖南省娄底市双峰县第一中学2023届高三第七次月考化学试题湖北省十堰市郧阳中学、恩施高中、随州二中、襄阳三中2022-2023学年高二下学期5月联考化学试题
名校
解题方法
3 . HX为一元弱酸,YOH为一元强碱。常温下,向难溶强电解质(YX)的悬浊液中加入某酸,测得c(Y+)与c(H+)的变化关系如图实线所示。下列说法错误的是
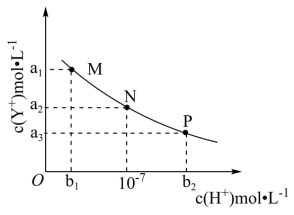

| A.M点时,c(X-)<c(Y+) |
| B.水的电离程度:N>P |
| C.实验时可加入的酸为盐酸 |
| D.难溶物YX的溶度积K为a22 |
您最近一年使用:0次
2021-12-30更新
|
1297次组卷
|
8卷引用:湖南省株洲市第二中学2023届高三第七次月考化学试题
湖南省株洲市第二中学2023届高三第七次月考化学试题湖南省株洲市第一中学2023届高三第七次月考化学试题四川省成都市2021-2022学年高三上学期第一次诊断性检测理综化学试题(已下线)卷02 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)宁夏回族自治区石嘴山市平罗中学2022届高三第三次模拟理科综合化学试题(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型142 有关沉淀溶解平衡图像四川省双流棠湖中学2023-2024学年高三上学期10月月考理综化学试题
2021·全国·模拟预测
名校
解题方法
4 . T℃时,CdCO3和Cd(OH)2的沉淀溶解平衡曲线如图所示,已知pCd2+为Cd2+浓度的负对数,pN为阴离子浓度的负对数,下列说法正确的是
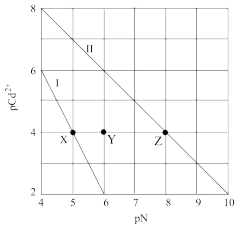

A.X点:c(Cd2+)<c(OH-);Z点:c(CO )<c(Cd2+) )<c(Cd2+) |
| B.溶度积的负对数:pKsp(CdCO3)<pKsp[Cd(OH)2] |
| C.Y点对应的CdCO3溶液为不饱和溶液,可以继续溶解CdCO3 |
D.T℃时,Cd(OH)2(s)+ (aq)⇌CdCO3(s)+2OH-(aq)的平衡常数K为102 (aq)⇌CdCO3(s)+2OH-(aq)的平衡常数K为102 |
您最近一年使用:0次
2021-12-17更新
|
1368次组卷
|
6卷引用:湖南省株洲市攸县第一中学2022届高三下学期四月月考化学试题
湖南省株洲市攸县第一中学2022届高三下学期四月月考化学试题(已下线)第16周 周测卷-备战2022年高考化学周测与晚练(新高考专用)河南省商城县观庙高级中学2021-2022学年高二上学期12月月考化学试题福建省福州高级中学2021-2022学年高二上学期期末化学考试题(已下线)【直击双一流】02-备战2022年高考化学名校进阶模拟卷(通用版)(已下线)押江苏卷第13题 水溶液中的离子平衡 -备战2022年高考化学临考题号押题(江苏卷)
名校
解题方法
5 . 钒广泛应用于钢铁工业,钒的氧化物在化学工业常用作催化剂。某沉钒废水(含Al3+、Fe2+、VO2+)钒含量约为2%。从该沉钒废水中分离出铁元素并制备V2O5的流程如下所示:
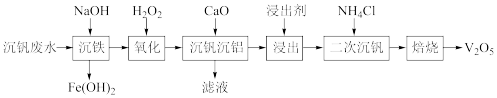
已知:①钒元素的存在形态较多,部分四价钒和五价钒物种的分布分数与pH的关系如图所示。
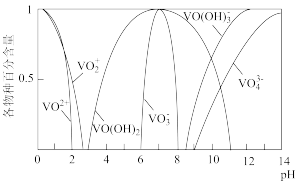
②Fe(OH)2完全沉淀的pH为8.4;VO(OH)2完全溶解的pH约为11。
③吉布斯自由能(∆G)可以用来判断反应进行的方向。一个反应的∆G越小,反应发生的可能性越大。
(1)写出基态V原子的核外电子排布式___________ 。
(2)“沉铁”时调节pH时不能用氨水代替氢氧化钠的原因是___________ 。
(3)写出“氧化'‘时发生的离子方程式___________ 。
(4)①“沉钒沉铝”中所得沉淀物与浸出剂反应∆G与温度的关系如图所示。“浸出”时应控制温度低于60℃,原因是___________ 。

②若“浸出”时浸出剂中添加NaOH固体,并边浸出边通入CO2,可大大提高钒的浸出率,原因是___________ 。
(5)“二次沉钒”时,先调节pH约为6〜8,得到含钒铵盐沉淀,写出“焙烧”时该铵盐沉淀发生分解的化学方程式___________ 。

已知:①钒元素的存在形态较多,部分四价钒和五价钒物种的分布分数与pH的关系如图所示。

②Fe(OH)2完全沉淀的pH为8.4;VO(OH)2完全溶解的pH约为11。
③吉布斯自由能(∆G)可以用来判断反应进行的方向。一个反应的∆G越小,反应发生的可能性越大。
(1)写出基态V原子的核外电子排布式
(2)“沉铁”时调节pH时不能用氨水代替氢氧化钠的原因是
(3)写出“氧化'‘时发生的离子方程式
(4)①“沉钒沉铝”中所得沉淀物与浸出剂反应∆G与温度的关系如图所示。“浸出”时应控制温度低于60℃,原因是

②若“浸出”时浸出剂中添加NaOH固体,并边浸出边通入CO2,可大大提高钒的浸出率,原因是
(5)“二次沉钒”时,先调节pH约为6〜8,得到含钒铵盐沉淀,写出“焙烧”时该铵盐沉淀发生分解的化学方程式
您最近一年使用:0次
2021-12-14更新
|
1099次组卷
|
6卷引用:湖南省株洲市醴陵市第一中学2023届高三第四次月考化学试题
解题方法
6 . 冶炼废水中砷元素主要以亚砷酸和砷酸的形式存在,工业中酸性废水中回收再利用砷的工业流程如下,请回答下列问题。
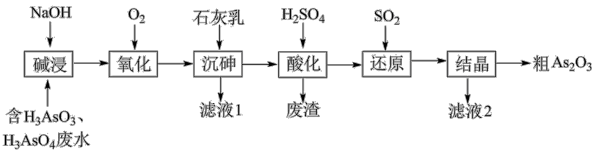
(1)废水中 中砷元素的化合价为
中砷元素的化合价为___________ 价。
(2)“沉砷”选择石灰乳实现沉淀转化。存在两个溶解平衡:

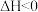
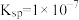
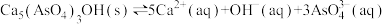
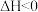
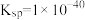
实验表明,“沉砷”选择的最佳温度为85℃,请用化学平衡原理解释温度高于85℃后,随着温度的升高,沉淀率下降的原因为___________ ,室温时,当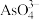 沉淀完全(溶液的离子浓度
沉淀完全(溶液的离子浓度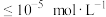 ,沉淀完全),则溶液的pH最大约为
,沉淀完全),则溶液的pH最大约为___________ 。
(3)“酸化”发生的离子反应方程式为___________ 。
(4)整个流程中可以循环使用的物质有___________ 。
(5)下图是“结晶”加热 分解,不同硫酸的浓度和温度
分解,不同硫酸的浓度和温度 的溶解度曲线,结晶过程应选择的最佳条件为
的溶解度曲线,结晶过程应选择的最佳条件为___________ 。
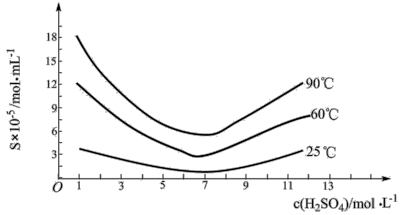
As2O3溶解度曲线

(1)废水中
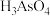 中砷元素的化合价为
中砷元素的化合价为(2)“沉砷”选择石灰乳实现沉淀转化。存在两个溶解平衡:

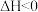
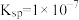
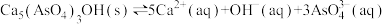
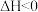
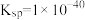
实验表明,“沉砷”选择的最佳温度为85℃,请用化学平衡原理解释温度高于85℃后,随着温度的升高,沉淀率下降的原因为
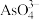 沉淀完全(溶液的离子浓度
沉淀完全(溶液的离子浓度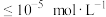 ,沉淀完全),则溶液的pH最大约为
,沉淀完全),则溶液的pH最大约为(3)“酸化”发生的离子反应方程式为
(4)整个流程中可以循环使用的物质有
(5)下图是“结晶”加热
 分解,不同硫酸的浓度和温度
分解,不同硫酸的浓度和温度 的溶解度曲线,结晶过程应选择的最佳条件为
的溶解度曲线,结晶过程应选择的最佳条件为
As2O3溶解度曲线
您最近一年使用:0次
2021-11-06更新
|
173次组卷
|
2卷引用:湖南省株洲市攸县第四中学2022-2023学年高三上学期第四次月考化学试题
名校
解题方法
7 . 锗是一种重要的半导体材料,其有机化合物在治疗癌症方面有着独特的功效,二氧化锗( )可用于光谱分析和制备催化剂、制硅锗合金等。对火法炼锌工艺所得锗渣(主要成分
)可用于光谱分析和制备催化剂、制硅锗合金等。对火法炼锌工艺所得锗渣(主要成分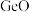 、
、 、
、 、
、 ,及少量
,及少量 等难溶物杂质)进行处理的流程如图:
等难溶物杂质)进行处理的流程如图:

已知: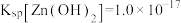 ,
, ,请回答下列问题:
,请回答下列问题:
(1)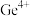 的离子结构示意图为
的离子结构示意图为_______ 。
(2)“酸溶”时,请写出两条提高酸溶速率的措施:_______ 。
(3)常温下,“调 ”时,滤液1中的所有金属离子恰好都沉淀完全时的
”时,滤液1中的所有金属离子恰好都沉淀完全时的 为
为_______ 。
(4)“氧化吸收”时,发生反应的离子方程式为_______ 。该过程中温度不宜太高的原因是_______ 。
(5)“水解”为四氯化锗与高纯水反应,其化学方程式为_______ ,为了让该反应趋于完全,制备时需_______ 。
(6)电解高纯 和
和 的混合物,可制得硅锗合金。反应原理如下:
的混合物,可制得硅锗合金。反应原理如下: ,生成硅锗合金的电极为
,生成硅锗合金的电极为_______ (填“阳极”或“阴极”)。写出生成 的电极反应式:
的电极反应式:_______ 。
 )可用于光谱分析和制备催化剂、制硅锗合金等。对火法炼锌工艺所得锗渣(主要成分
)可用于光谱分析和制备催化剂、制硅锗合金等。对火法炼锌工艺所得锗渣(主要成分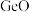 、
、 、
、 、
、 ,及少量
,及少量 等难溶物杂质)进行处理的流程如图:
等难溶物杂质)进行处理的流程如图:
已知:
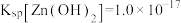 ,
, ,请回答下列问题:
,请回答下列问题:(1)
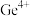 的离子结构示意图为
的离子结构示意图为(2)“酸溶”时,请写出两条提高酸溶速率的措施:
(3)常温下,“调
 ”时,滤液1中的所有金属离子恰好都沉淀完全时的
”时,滤液1中的所有金属离子恰好都沉淀完全时的 为
为(4)“氧化吸收”时,发生反应的离子方程式为
(5)“水解”为四氯化锗与高纯水反应,其化学方程式为
(6)电解高纯
 和
和 的混合物,可制得硅锗合金。反应原理如下:
的混合物,可制得硅锗合金。反应原理如下: ,生成硅锗合金的电极为
,生成硅锗合金的电极为 的电极反应式:
的电极反应式:
您最近一年使用:0次
2021-09-28更新
|
405次组卷
|
4卷引用:湖南省株洲市攸县第三中学2022-2023学年高三上学期第一次月考化学试题
名校
解题方法
8 . 已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7;p(Ni)=-lgc(Ni2+),p(B)=-lgc(S2-)或-lgc(CO )。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是
)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是
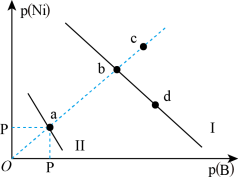
 )。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是
)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是
| A.常温下NiCO3的溶解度大于NiS的溶解度 |
| B.向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动 |
| C.对于曲线Ⅰ,在b点加热,b点向c点移动 |
D.P为3.5且对应的阴离子是CO |
您最近一年使用:0次
2021-09-05更新
|
3109次组卷
|
42卷引用:湖南省株洲市第一中学2021-2022学年高三下学期期中考试化学试题
湖南省株洲市第一中学2021-2022学年高三下学期期中考试化学试题四川省资阳市高中2018届高三第二次诊断性考试理科综合化学试题西北师大附中2018届下学期高三年级第二次模拟理综化学试卷西藏自治区拉萨中学2018届高三第七次月考理综化学试题【全国市级联考】河北省保定市2018届高三第二次模拟考试理科综合化学试题【全国市级联考】江西省南昌市2018届高三第三次模拟考试理综化学试题【全国百强校】广东省阳春市第一中学2018届高三第九次月考理综化学试题【市级联考】湖北省十堰市2019届高三下学期模拟化学试题四川省泸县第四中学2019届高三下学期三诊模拟理科综合化学试题辽宁省六校协作体2020届高三上学期期中考试化学试题步步为赢 高二化学寒假作业:综合检测(一)福建省厦门外国语学校2020届高三12月月考化学试题2020届高三化学化学二轮复习——常考题型:沉淀溶解平衡的曲线分析【精编25题】吉林省梅河口市第五中学2020届高三下学期模拟考试化学试题(已下线)考点13 沉淀溶解平衡-2020年高考化学命题预测与模拟试题分类精编鲁科版(2019)选择性必修1化学反应原理 综合训练高中必刷题高二选择性必修1化学反应原理综合训练(已下线)3.4+难溶电解质的溶解平衡-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)第三章 水溶液中的离子平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)(已下线)易错17 难溶电解质的溶解平衡及应用-备战2021年高考化学一轮复习易错题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 过素养 学科素养拓展训练人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 过素养 学科素养拓展训练山东省临朐县实验中学2020-2021学年高二上学期12月月结学情检测化学试题(已下线)专题12 水溶液中离子平衡(攻克各种图像问题)-2021年高考化学必做热点专题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)选择性必修1(SJ)专题3专题培优专练选择性必修1 化学反应原理综合训练(已下线)课时45 难溶电解质的溶解平衡-2022年高考化学一轮复习小题多维练(全国通用)(已下线)3.4.2 沉淀溶解平衡原理的应用-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)2021年高考全国乙卷化学试题变式题陕西省宝鸡市陈仓区2022届高三上学期第一次教学质量检测化学试题江西省九江市第一中学2021-2022学年高二上学期第二次月考化学试题(已下线)【直击双一流】06-备战2022年高考化学名校进阶模拟卷(通用版)陕西省汉中中学2021-2022学年高二上学期第四次月考化学试题吉林省长春市第五中学2022-2023学年高二上学期期中考试化学试题湖北省宜昌英杰学校2021-2022学年高三上学期10月月考化学试题(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型27 沉淀溶解平衡常数及其应用图象(已下线)T13-溶液中的离子平衡浙江省绍兴区上虞区2022-2023学年高三下学期第二次适应性考试(二模)化学试题浙江省绍兴区上虞区2022-2023学年高三下学期第二次适应性考试(二模)化学试题
名校
解题方法
9 . 下列离子方程式不能正确表示体系颜色变化的是
| A.向AgCl悬浊液中加Na2S溶液,有黑色难溶物生成:2AgCl(s)+S2-(aq)=Ag2S(s)+2Cl-(aq) |
B.向酸性KMnO4溶液中加入NaHSO3固体,溶液紫色褪去:2MnO +5SO +5SO +6H+=2Mn2++5SO +6H+=2Mn2++5SO +3H2O +3H2O |
C.向橙色K2Cr2O7溶液中加入NaOH溶液,溶液变黄色:Cr2O +2OH-=2CrO +2OH-=2CrO +H2O +H2O |
D.向稀硝酸中加入铜粉,溶液变蓝色:3Cu+8H++2NO =3Cu2++2NO↑+4H2O =3Cu2++2NO↑+4H2O |
您最近一年使用:0次
2021-08-12更新
|
170次组卷
|
2卷引用:湖南省株洲市第八中学021-2022学年高三下学期5月月考化学试题
10 . 25℃时,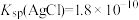 ,
,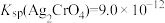 ,下列说法正确的是
,下列说法正确的是
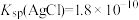 ,
,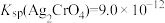 ,下列说法正确的是
,下列说法正确的是A.AgCl和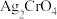 共存的悬浊液中, 共存的悬浊液中,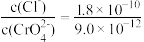 |
B.向 悬浊液中加入NaCl浓溶液, 悬浊液中加入NaCl浓溶液, 不可能转化为AgCl 不可能转化为AgCl |
C.向AgCl饱和溶液中加入NaCl固体,有AgCl析出且溶液中 |
D.向浓度均为0.1mol/L的 和NaCl混合溶液中滴加 和NaCl混合溶液中滴加 溶液,AgCl先析出 溶液,AgCl先析出 |
您最近一年使用:0次
2021-08-07更新
|
505次组卷
|
11卷引用:湖南省株洲市攸县第二中学2022-2023学年高二上学期期中考试化学试题
湖南省株洲市攸县第二中学2022-2023学年高二上学期期中考试化学试题山西省太原市2018届高三上学期期末考试化学试题福建省莆田第六中学2020届高三上学期期中考试化学试题福建省三明第一中学2020届高三上学期第二次月考化学试题2020届高三化学一轮复习 溶度积常数及溶解平衡常数的分析河北省石家庄市辛集市第一中学2019-2020学年高二第二次考试(二)化学试题课选择性必修1 专题3 第四单元 课时2 Ksp相关计算及其图像分析(已下线)第三章第四节 难溶电解的溶解平衡(备作业)-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)(已下线)第3章 水溶液中的离子反应与平衡(章末检测)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)湖南省隆回县第二中学2022-2023学年高二上学期线上课程摸底(期中)考试化学试题3.4.2沉淀溶解平衡原理的应用 课后



