名校
解题方法
1 . 氧化锌又称锌白,作为添加剂在多种材料和产品中有广泛应用。一种以锌精矿(主要成分是 ,还有
,还有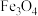 、
、 ,
, 等杂质)为原料制备锌白的工艺流程如下:
等杂质)为原料制备锌白的工艺流程如下:

已知:25℃时相关物质的 如下表:
如下表:
回答下列问题:
(1)滤渣I的主要成分除过量 外,还有S和
外,还有S和_______ (填化学式)。“浸出”时, 氧化
氧化 的离子方程式为
的离子方程式为_______ 。
(2)“沉铁”时,滴加氨水需要调节 最低为
最低为_______ (通常认为残留在溶液中离子浓度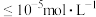 时,沉淀完全)。
时,沉淀完全)。
(3)“萃取,反萃取”时发生的反应是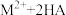 (有机萃取剂)
(有机萃取剂)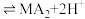 ,有机萃取剂能分离
,有机萃取剂能分离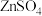 和
和 ,能分离出
,能分离出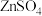 的原因是
的原因是_______ 。为了提高反萃取效率,反萃取剂应该呈_______ (填“酸”“碱”或“中”)性。
(4)“深度净化”中加 的目的是
的目的是_______ 。
(5)①“沉锌”时,充分反应,过滤,洗涤得到碱式碳酸锌[ ],其反应的离子方程式为
],其反应的离子方程式为_______ ,检验沉淀洗涤干净的方法是_______ 。
②为测定碱式碳酸锌[ ]的组成,称取一定量的碱式碳酸锌,充分加热分解,产生的气体依次通过足量浓硫酸和碱石灰,分别增重0.72g和0.88g,则该碱式碳酸锌的化学式为
]的组成,称取一定量的碱式碳酸锌,充分加热分解,产生的气体依次通过足量浓硫酸和碱石灰,分别增重0.72g和0.88g,则该碱式碳酸锌的化学式为_______ 。
 ,还有
,还有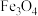 、
、 ,
, 等杂质)为原料制备锌白的工艺流程如下:
等杂质)为原料制备锌白的工艺流程如下:
已知:25℃时相关物质的
 如下表:
如下表:| 物质 |  |  |  | 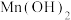 |  |
 | 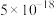 | 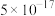 | 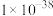 | 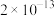 |  |
回答下列问题:
(1)滤渣I的主要成分除过量
 外,还有S和
外,还有S和 氧化
氧化 的离子方程式为
的离子方程式为(2)“沉铁”时,滴加氨水需要调节
 最低为
最低为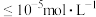 时,沉淀完全)。
时,沉淀完全)。(3)“萃取,反萃取”时发生的反应是
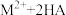 (有机萃取剂)
(有机萃取剂)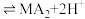 ,有机萃取剂能分离
,有机萃取剂能分离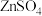 和
和 ,能分离出
,能分离出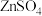 的原因是
的原因是(4)“深度净化”中加
 的目的是
的目的是(5)①“沉锌”时,充分反应,过滤,洗涤得到碱式碳酸锌[
 ],其反应的离子方程式为
],其反应的离子方程式为②为测定碱式碳酸锌[
 ]的组成,称取一定量的碱式碳酸锌,充分加热分解,产生的气体依次通过足量浓硫酸和碱石灰,分别增重0.72g和0.88g,则该碱式碳酸锌的化学式为
]的组成,称取一定量的碱式碳酸锌,充分加热分解,产生的气体依次通过足量浓硫酸和碱石灰,分别增重0.72g和0.88g,则该碱式碳酸锌的化学式为
您最近一年使用:0次
2022-04-13更新
|
2170次组卷
|
10卷引用:湖南省株洲市第二中学2022-2023学年高三上学期12月月考化学(B)试题
湖南省株洲市第二中学2022-2023学年高三上学期12月月考化学(B)试题湖南省株洲市第一中学2022-2023学年高三第六次月考化学试题河北省保定市2022届高三第一次模拟考试(一模)化学试题湖南省邵阳市洞口县第一中学2021-2022学年高三下学期四月月考化学试题(已下线)化学-2022年高考押题预测卷01(辽宁卷)(已下线)化学-2022年高考押题预测卷02(辽宁卷)(已下线)2022年全国乙卷高考变式题(非选择题)(已下线)专题15 工艺流程题-2022年高考真题模拟题分项汇编(已下线)微专题26 化学工艺流程题-----核心反应与条件控制-备战2023年高考化学一轮复习考点微专题河南省南阳一中2022-2023学年高三上学期第一次阶段性考试化学试题
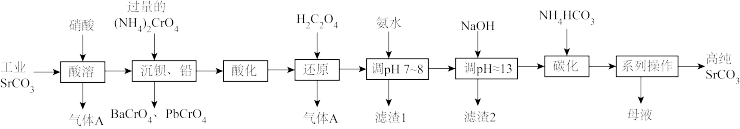
2 . 碳酸锶(SrCO3)难溶于水,主要用于电磁材料和金属冶炼。一种由工业碳酸锶(含少量Ba2+、Ca2+、Mg2+、 Pb2+等)制备高纯碳酸锶的工艺流程如下:
已知:I. Cr(OH)3为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
回答下列问题:
(1)气体A的电子式为_______ 。
(2)“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为_______ (用离子方程式解释);“还原”时发生反应的离子方程式为_______ 。
(3)“滤渣1”的主要成分为_______ (填化学式)。
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为_______ 。
(5)“调pH ≈13”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因为_______ 。
(6)已知:碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11,则“碳化”时,反应Sr2+(aq)+2HCO (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数K=
SrCO3(s)+H2CO3(aq)的平衡常数K=_______ (保留两位有效数字)。
(7)“系列操作”中包含“200°C烘干”操作,烘干过程中除蒸发水分外,还能够除去SrCO3中的微量可溶性杂质,该杂质除NH4HCO3外还可能为_______ (填化学式)。

已知:I. Cr(OH)3为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
| 化合物 | Cr(OH)3 | Ca(OH)2 | Mg(OH)2 | SrCO3 |
| Ksp近似值 | 1×10-31 | 5.5×10-6 | 1.8×10-11 | 5.6×10-10 |
(1)气体A的电子式为
(2)“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为
(3)“滤渣1”的主要成分为
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为
(5)“调pH ≈13”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因为
(6)已知:碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11,则“碳化”时,反应Sr2+(aq)+2HCO
 (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数K=
SrCO3(s)+H2CO3(aq)的平衡常数K=(7)“系列操作”中包含“200°C烘干”操作,烘干过程中除蒸发水分外,还能够除去SrCO3中的微量可溶性杂质,该杂质除NH4HCO3外还可能为
您最近一年使用:0次
2022-04-09更新
|
1205次组卷
|
13卷引用:湖南省株洲市九方中学2022-2023学年高三上学期第一次月考化学试题
湖南省株洲市九方中学2022-2023学年高三上学期第一次月考化学试题河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题(已下线)秘籍17 工艺流程的条件控制与计算-备战2022年高考化学抢分秘籍(全国通用)(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷01(山东卷)(已下线)化学-2022年高考考前押题密卷(湖南卷)(已下线)化学-2022年高考考前押题密卷(重庆卷)湖北省宜昌市夷陵中学2022届高三5月第二次限时训练(四模)化学试题辽宁省抚顺市第二中学2021-2022学年高三上学期10月月考化学试题山东省鄄城县第一中学2022-2023学年高二上学期期末考试化学试题湖北省宜昌英杰学校2021-2022学年高三上学期9月月考化学试题(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(工业流程题)湖南省邵阳市第一中学2023届高三第五次月考化学试题
名校
解题方法
3 . 下列方案设计、现象和结论都正确的是
| 实验目的 | 方案设计 | 现象和结论 | |
| A | 探究NO2生成N2O4反应的吸放热 | 将充有NO2的密闭烧瓶放入热水中 | 烧瓶内气体颜色变浅,NO2生成N2O4的反应为吸热反应 |
| B | 比较CH3COOH和HF的酸性强弱 | 相同条件下,分别用pH试纸测定0.lmol·L-1CH3COONa溶液、1.0mol·L-1NaF溶液的pH | NaF溶液的pH>CH3COONa溶液的pH,证明CH3COOH的酸性比HF的酸性强 |
| C | 比较氢氧化铜和氢氧化镁Ksp的大小 | 向浓度均为0.1mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入NaOH溶液 | 先出现蓝色沉淀,Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| D | 镀锌铁皮锌镀层厚度的测定 | 装有镀锌铁皮的烧杯中加入足量稀硫酸 | 产生气泡的速率突然减小,证明镀锌层完全反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-04-09更新
|
2683次组卷
|
10卷引用:湖南省株洲市第四中学2023届高三第六次月考化学试题
湖南省株洲市第四中学2023届高三第六次月考化学试题重庆市2022届高三模拟调研卷(三)化学试题(已下线)化学-2022年高考押题预测卷01(辽宁卷)(已下线)押江苏卷第11题 化学实验综合选择题 -备战2022年高考化学临考题号押题(江苏卷)(已下线)2022年全国甲卷高考真题变式题(选择题)(已下线)2022年全国乙卷高考变式题(选择题)(已下线)2022年浙江1月高考真题变式题(21-25)江苏省泰州中学2023-2024学年高三上学期期初调研考试化学试题宁夏石嘴山市光明中学2024届高三第一次模拟考试理综化学试题(已下线)FHgkyldyjhx09
4 . 常温下,Ksp(MnS)=2.5×10-13,Ksp(FeS)=6.3×10-18。FeS和MnS在水中的沉淀溶解平衡曲线如图所示(X2+表示Fe2+或Mn2+),下列说法错误的是

| A.曲线Ⅱ表示MnS的沉淀溶解平衡曲线 |
| B.升高温度,曲线Ⅱ上的c点可沿虚线平移至e点 |
C.常温下,反应MnS(s)+Fe2+(aq) FeS(s)+Mn2+(aq)的平衡常数K≈4×104 FeS(s)+Mn2+(aq)的平衡常数K≈4×104 |
| D.向b点溶液中加入少量Na2S固体,溶液组成由b点沿Ⅰ线向a点方向移动 |
您最近一年使用:0次
2022-03-29更新
|
701次组卷
|
7卷引用:湖南省株洲市攸县第二中学2023届高三上学期第一次月考化学试题
名校
5 . 某兴趣小组利用工业废弃的铁铜合金制备碳式碳酸铜的简易流程如图。下列叙述错误的是


| A.“沉降”反应中溶液与Na2CO3以不同方式或不同用量比混合不影响产品成分 |
| B.“过滤1”所得的滤液中的溶质主要为硫酸铜 |
| C.“滤渣”的主要成分为氢氧化铁 |
| D.“溶解”时发生了氧化还原反应 |
您最近一年使用:0次
2022-03-26更新
|
868次组卷
|
9卷引用:湖南省攸县第三中学2022-2023学年高三第六次月考化学试题
湖南省攸县第三中学2022-2023学年高三第六次月考化学试题河北省名校联盟2021-2022学年高三下学期联合调研化学试题(已下线)化学-2022年高考押题预测卷02(山东卷)上海交通大学附属中学2021-2022学年高三下学期期中考试化学试题湖北省襄阳市第五中学2022届高三下学期适应性考试(二模)化学试题湖南省长沙市长沙县第一中学2021-2022学年高三下学期期中考试化学试题湖南省长沙市望城区第一中学2022届高三下学期期中考试化学试题(已下线)专题14 物质的反应和转化-三年(2020-2022)高考真题分项汇编(已下线)第八章 水溶液中的离子平衡(测)-2023年高考化学一轮复习讲练测(全国通用)
名校
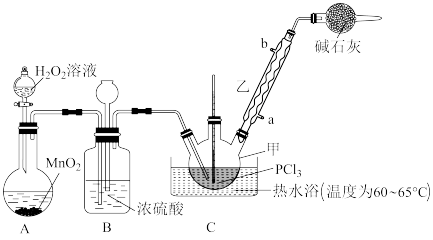
6 . 三氯氧磷POCl3是一种化工原料,可用于制取有机磷农药、长效磺胺药物等,还可用作染料中间体、有机合成的氯化剂和催化剂、阻燃剂等。利用O2和PCl3为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
已知 和三氯氧磷的性质如表:
和三氯氧磷的性质如表:
回答下列问题:
(1)装置A中的分液漏斗能否用长颈漏斗代替____ ?做出判断并分析原因:___________ 。
(2)装置B的作用是___________(填标号)。
(3)干燥管中碱石灰的作用___________ 。
(4)写出装置C中发生反应的化学方程式____ 。
(5)通过佛尔哈德法可以测定三氯氧磷产品中Cl素含量,实验步骤如下:
Ⅰ.取ag产品于锥形瓶中,加入足量NaOH溶液待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 的AgNO3溶液40.00 mL,使Cl-完全沉淀。
的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀面被有机物覆盖。
Ⅳ.加入指示剂,用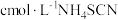 溶液滴过量
溶液滴过量 至终点,记下所用体积为
至终点,记下所用体积为 。
。
已知: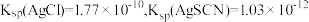
①滴定选用的指示剂是___________ (填标号),滴终点的现象为___________ 。
a. b.
b. c.淀粉 d.甲基橙
c.淀粉 d.甲基橙
②实验过程中加入硝基苯的目的是___________ ,如无此操作所测Cl元素含量将___________ (填“偏大”“偏小”或“不变”)。
③所测Cl元素含量为___________ 。

已知
 和三氯氧磷的性质如表:
和三氯氧磷的性质如表:| 熔点/℃ | 沸点/℃ | 其他物理或化学性质 | |
| PCl3 | -112.0 | 76.0 | PCl3和POCl3互溶,均为无色液体,遇水均剧烈水解,发生复分解反应生成磷的含氧酸和HCl |
| POCl3 | 1.25 | 106.0 |
(1)装置A中的分液漏斗能否用长颈漏斗代替
(2)装置B的作用是___________(填标号)。
| A.干燥气体 | B.加注浓硫酸 | C.观察气体流出速度 | D.调节气压 |
(4)写出装置C中发生反应的化学方程式
(5)通过佛尔哈德法可以测定三氯氧磷产品中Cl素含量,实验步骤如下:
Ⅰ.取ag产品于锥形瓶中,加入足量NaOH溶液待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000
 的AgNO3溶液40.00 mL,使Cl-完全沉淀。
的AgNO3溶液40.00 mL,使Cl-完全沉淀。Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀面被有机物覆盖。
Ⅳ.加入指示剂,用
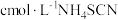 溶液滴过量
溶液滴过量 至终点,记下所用体积为
至终点,记下所用体积为 。
。已知:
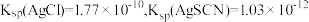
①滴定选用的指示剂是
a.
 b.
b.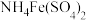 c.淀粉 d.甲基橙
c.淀粉 d.甲基橙②实验过程中加入硝基苯的目的是
③所测Cl元素含量为
您最近一年使用:0次
2022-03-26更新
|
669次组卷
|
3卷引用:湖南省株洲市第二中学2022-2023学年高二上学期期中考试化学试题
7 . 铜冶炼过程中,产生的粗硫酸镍废液中含有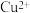 、
、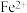 、
、 、
、 、
、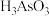 等杂质微粒,工业生产以此为原料,精制硫酸镍,主要流程如下:
等杂质微粒,工业生产以此为原料,精制硫酸镍,主要流程如下:

已知:常温下,
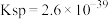


(1)步骤ⅰ的操作名称是___________ 。
(2)①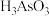 中As的化合价为
中As的化合价为___________ 。
②步骤ⅱ中 的作用是
的作用是___________ 。
(3)步骤ⅲ,加入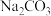 的目的是通过调pH进一步去除
的目的是通过调pH进一步去除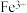 ,使
,使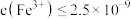
 。若溶液2中
。若溶液2中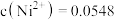
 ,则需控制pH的大致范围为
,则需控制pH的大致范围为___________ 。
(4)①步骤ⅳ,沉淀3的主要成分有___________ (填化学式)。
②在加入NaF的同时需调pH约为5,若pH过低,导致沉淀率下降,原因是___________ 。
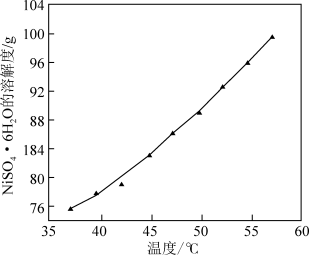
(5)结合下图说明由溶液4得到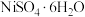 的操作是
的操作是___________ 。
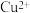 、
、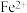 、
、 、
、 、
、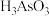 等杂质微粒,工业生产以此为原料,精制硫酸镍,主要流程如下:
等杂质微粒,工业生产以此为原料,精制硫酸镍,主要流程如下:
已知:常温下,

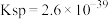


(1)步骤ⅰ的操作名称是
(2)①
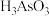 中As的化合价为
中As的化合价为②步骤ⅱ中
 的作用是
的作用是(3)步骤ⅲ,加入
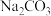 的目的是通过调pH进一步去除
的目的是通过调pH进一步去除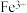 ,使
,使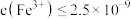
 。若溶液2中
。若溶液2中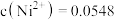
 ,则需控制pH的大致范围为
,则需控制pH的大致范围为(4)①步骤ⅳ,沉淀3的主要成分有
②在加入NaF的同时需调pH约为5,若pH过低,导致沉淀率下降,原因是
(5)结合下图说明由溶液4得到
 的操作是
的操作是
您最近一年使用:0次
2022-03-25更新
|
499次组卷
|
5卷引用:湖南省株洲市第一中学2022-2023学年高二上学期期中考试化学试题
名校
8 . SO2虽是大气污染物之一,但也是重要的工业原料。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜。镍等金属化合物)作燃煤尾气脱硫剂,简化流程如图所示。下列说法错误的是


| A.软锰矿浆吸收SO2反应的主要化学方程式为MnO2+SO2=MnSO4 |
| B.MnCO3的作用是通过调节pH沉淀铁离子和铝离子,若换为KOH可以达到更好的效果 |
| C.MnS除铜、镍过程是将Cu2+转化为Cu2S,Ni2+转化为NiS |
| D.该流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2,达到变废为宝的目的 |
您最近一年使用:0次
2022-03-17更新
|
220次组卷
|
3卷引用:湖南省株洲市第一中学2022-2023学年高三下学期开学考试化学试题
名校
9 . 下列说法正确的是
A.NaClO溶液中,离子浓度大小关系为: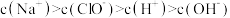 |
B.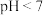 的溶液一定呈酸性 的溶液一定呈酸性 |
| C.可溶性正盐BA的溶液呈中性,可以推测BA为强酸强碱盐 |
D.常温下,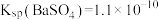 ,则 ,则 饱和溶液中 饱和溶液中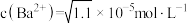 |
您最近一年使用:0次
2022-03-10更新
|
825次组卷
|
6卷引用:湖南省攸县第一中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
10 . 常温下,由下列实验操作和现象不能推出相应结论的是
| 实验操作和现象 | 结论 | |
| A | 测得0.1mol·L-1NaHSO3溶液的pH约为5 | Ka1(H2SO3)·Ka2(H2SO3)>Kw |
| B | 向NaCl和NaBr的混合溶液中滴入少量稀AgNO3溶液,产生白色沉淀 | Ksp(AgBr)>Ksp(AgCl) |
| C | 用pH计测定饱和NaHCO3溶液和饱和CH3COONa溶液的pH,前者pH大 | 水解程度:CH3COO—>HCO |
| D | 等体积、pH均为3的两种非氧化性酸HA和HB,分别与足量的Zn反应,酸HA放出的氢气多 | 酸性:HB>HA |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-03更新
|
732次组卷
|
5卷引用:湖南省株洲市九方中学2022-2023学年高三上学期第二次月考化学试题



