名校
1 . 运用溶液中离子平衡的相关知识,解决下列问题。
(1)含酚酞的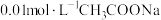 溶液显浅红色的原因为
溶液显浅红色的原因为_______ (用离子方程式)。
(2)室温下,用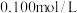 盐酸溶液滴定
盐酸溶液滴定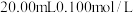 的某氨水溶液,滴定曲线如图所示。
的某氨水溶液,滴定曲线如图所示。
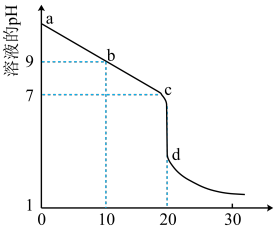
①d点所示的溶液中离子浓度由大到小的顺序依次为_______ 。
②b点所示的溶液中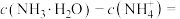
_______ (用溶液中的其它离子浓度表示)。
③ 的氨水与
的氨水与 的
的 溶液中,由水电离出的
溶液中,由水电离出的 之比为
之比为_______ 。
(3)已知 ,
, 。向含有
。向含有 固体的溶液中滴加
固体的溶液中滴加 溶液,当有
溶液,当有 沉淀生成时,溶液中
沉淀生成时,溶液中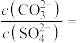
_______ (保留三位有效数字)。
我国国标推荐的食品药品中Ca元素含量的测定方法之一:利用 将处理后的样品中的
将处理后的样品中的 沉淀,过滤洗涤,然后将所得
沉淀,过滤洗涤,然后将所得 固体溶于过量的强酸,最后使用已知浓度的
固体溶于过量的强酸,最后使用已知浓度的 溶液通过滴定来测定溶液中
溶液通过滴定来测定溶液中 的含量。针对该实验中的滴定过程,回答以下问题:
的含量。针对该实验中的滴定过程,回答以下问题:
(4) 溶液应该用
溶液应该用_______ (填“酸式”或“碱式”)滴定管盛装。
(5)写出滴定过程中反应的离子方程式_______ 。
(6)滴定终点的现象:_______ 。
(7)以下哪些操作会导致测定的结果偏高_______ (填字母编号)。
a.装入 溶液前未润洗滴定管
溶液前未润洗滴定管
b.滴定结束后俯视读数
c.滴定结束后,滴定管尖端悬有一滴溶液
d.滴定过程中,振荡时将待测液洒出
(1)含酚酞的
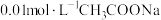 溶液显浅红色的原因为
溶液显浅红色的原因为(2)室温下,用
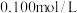 盐酸溶液滴定
盐酸溶液滴定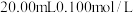 的某氨水溶液,滴定曲线如图所示。
的某氨水溶液,滴定曲线如图所示。
①d点所示的溶液中离子浓度由大到小的顺序依次为
②b点所示的溶液中
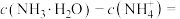
③
 的氨水与
的氨水与 的
的 溶液中,由水电离出的
溶液中,由水电离出的 之比为
之比为(3)已知
 ,
, 。向含有
。向含有 固体的溶液中滴加
固体的溶液中滴加 溶液,当有
溶液,当有 沉淀生成时,溶液中
沉淀生成时,溶液中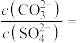
我国国标推荐的食品药品中Ca元素含量的测定方法之一:利用
 将处理后的样品中的
将处理后的样品中的 沉淀,过滤洗涤,然后将所得
沉淀,过滤洗涤,然后将所得 固体溶于过量的强酸,最后使用已知浓度的
固体溶于过量的强酸,最后使用已知浓度的 溶液通过滴定来测定溶液中
溶液通过滴定来测定溶液中 的含量。针对该实验中的滴定过程,回答以下问题:
的含量。针对该实验中的滴定过程,回答以下问题:(4)
 溶液应该用
溶液应该用(5)写出滴定过程中反应的离子方程式
(6)滴定终点的现象:
(7)以下哪些操作会导致测定的结果偏高
a.装入
 溶液前未润洗滴定管
溶液前未润洗滴定管b.滴定结束后俯视读数
c.滴定结束后,滴定管尖端悬有一滴溶液
d.滴定过程中,振荡时将待测液洒出
您最近一年使用:0次
2022-09-13更新
|
154次组卷
|
2卷引用:湖南省株洲市第二中学2022-2023学年高三上学期12月月考化学(B)试题
解题方法
2 . 25℃时, 饱和溶液中,
饱和溶液中, 与
与 的物质的量浓度的负对数关系如图所示。对于图中的a点,下列说法正确的是
的物质的量浓度的负对数关系如图所示。对于图中的a点,下列说法正确的是

 饱和溶液中,
饱和溶液中, 与
与 的物质的量浓度的负对数关系如图所示。对于图中的a点,下列说法正确的是
的物质的量浓度的负对数关系如图所示。对于图中的a点,下列说法正确的是
A.a点表示 的饱和溶液,且 的饱和溶液,且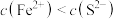 |
B.a点表示 的饱和溶液。且 的饱和溶液。且 |
C.a点表示 的不饱和溶液,且 的不饱和溶液,且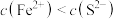 |
D.a点表示 的不饱和溶液,且 的不饱和溶液,且 |
您最近一年使用:0次
2022-09-11更新
|
145次组卷
|
2卷引用:湖南省株洲市五雅中学2022-2023学年高二上学期11月期中考试化学试题
名校
解题方法
3 . 以软锰矿(主要含有MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备KMnO4的工艺流程如图所示:

回答下列问题:
(1)“浸取”时MnO2转化为Mn2+,反应的离子方程式为____ 。
(2)“除Fe、Al、Si”时,需将Fe2+氧化为Fe3+,最适宜的氧化剂为____ (填标号)。
a.H2O2 b.HNO3 c.Cl2
(3)“除Ca、Mg时,所得溶液中 =
=____ [Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]。
(4)“沉锰”时不宜在较高温度下进行的原因是____ 。
(5)“焙烧”时,由MnCO3生成MnO2的化学方程式为____ 。
(6)“加热氧化”时,MnO2发生反应生成KMnO4,该反应的化学方程式为____ ;提高“水浸”速率可以采取的措施为____ (写两条);“系列操作”包括____ ,过滤、洗涤、干燥。

回答下列问题:
(1)“浸取”时MnO2转化为Mn2+,反应的离子方程式为
(2)“除Fe、Al、Si”时,需将Fe2+氧化为Fe3+,最适宜的氧化剂为
a.H2O2 b.HNO3 c.Cl2
(3)“除Ca、Mg时,所得溶液中
 =
=(4)“沉锰”时不宜在较高温度下进行的原因是
(5)“焙烧”时,由MnCO3生成MnO2的化学方程式为
(6)“加热氧化”时,MnO2发生反应生成KMnO4,该反应的化学方程式为
您最近一年使用:0次
2022-09-06更新
|
1274次组卷
|
11卷引用:湖南攸县第四中学2022-2023学年高三上学期第一次月考化学试题
湖南攸县第四中学2022-2023学年高三上学期第一次月考化学试题河北省保定市曲阳县第一高级中学2022-2023学年高三上学期9月考试化学试题(已下线)2022年辽宁省高考真题变式题(11-15)广东省河源中学2022-2023学年高三10月教学质量检测化学试题(已下线)2022年辽宁高考真题化学试题变式题(工业流程题)作业(二十一) 沉淀溶解平衡的应用(已下线)工业流程题(已下线)工业流程题贵州省部分中学2023-2024学年高三上学期第四次月考化学试题贵州省部分中学2023-2024学年高三上学期第四次月考化学试题(已下线)T16-工业流程题
4 . 草酸钴用途广泛,可用于指示剂和催化剂的制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4的工艺流程如图:
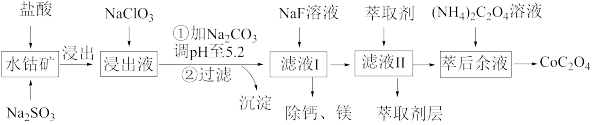
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中加入Na2SO3的目的是____ 。
(2)将氯气通入热的氢氧化钠溶液可以来制取NaClO3,请写出该反应的离子方程式____ ;实验需要制取10.65gNaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为____ (标准状况下)。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是____ ;使用萃取剂最适宜的pH是____ (填选项序号)。
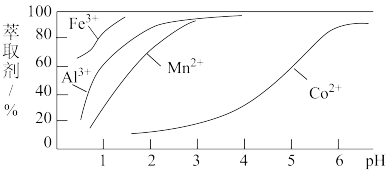
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液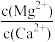 =
=____ 。

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是
(2)将氯气通入热的氢氧化钠溶液可以来制取NaClO3,请写出该反应的离子方程式
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是

A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液
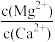 =
=
您最近一年使用:0次
2022-08-31更新
|
280次组卷
|
2卷引用:湖南攸县长鸿实验中学2022-2023学年高三上学期第二次月考化学试题
名校
解题方法
5 . 下列操作所涉及的离子方程式正确的是
A.向 浊液中通入 浊液中通入 气体: 气体: |
B.向酸性 溶液中加入足量铜粉: 溶液中加入足量铜粉: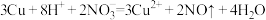 |
C.向 溶液中通入过量 溶液中通入过量 : :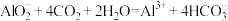 |
D.用 水溶液吸收溴蒸气: 水溶液吸收溴蒸气: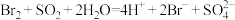 |
您最近一年使用:0次
2022-08-25更新
|
820次组卷
|
7卷引用:湖南省株洲市攸县第三中学2022-2023学年高三上学期第二次月考化学试题
名校
解题方法
6 . 下列实验操作、现象与结论正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 将Na[Al(OH)4]溶液与NaHCO3溶液混合 | 产生白色絮状沉淀 | 结合质子能力:[Al(OH)4]->CO |
| B | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | 溶液变黄色 | 氧化性:H2O2>Fe3+ |
| C | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色 | 制得气体为乙烯 |
| D | 向1mL 0.1mol/LKCl溶液中加入过量AgNO3溶液,再加入1mL0.1mol/LKI溶液 | 先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI)) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 下列离子方程式书写错误的是
A.向碘化亚铁溶液中滴加少量稀硝酸: |
B.(NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应:Fe2++ +Ba2++2OH-=BaSO4↓+Fe(OH)2↓ +Ba2++2OH-=BaSO4↓+Fe(OH)2↓ |
C.乙酰水杨酸 与NaOH溶液共热: 与NaOH溶液共热: +3OH- +3OH-  +CH3COO-+2H2O +CH3COO-+2H2O |
D.AgCl溶于过量浓氨水中: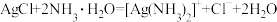 |
您最近一年使用:0次
8 . 氯氧化法制备NaBrO3的工艺流程如图所示:
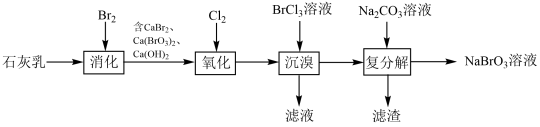
下列说法错误的是

下列说法错误的是
| A.“消化”反应中氧化剂与还原剂的物质的量之比为5:1 |
| B.“氧化”时,Cl2将CaBr2氧化为Ca(BrO3)2 |
| C.“沉溴”时发生反应:Ca(BrO3)2+BaCl2=Ba(BrO3)2↓+CaCl2 |
| D.BaCO3的溶解度大于Ba(BrO3)2 |
您最近一年使用:0次
2022-06-18更新
|
133次组卷
|
3卷引用:湖南省株洲市第八中学2021-2022学年高二下学期期末考试化学试题
名校
解题方法
9 . 锂辉石矿[主要含有LiAlSi2O6,还有少量Fe2+、Mg2+]是主要锂源,现利用锂辉石矿制取LiBr,用于高级电池的电解质、医用镇静剂等。工艺流程如下:
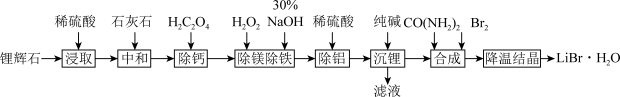
(1)锂辉石中主要成分LiAlSi2O6改写为氧化物形式为_______ 。
(2)工业选择石灰石进行“中和”而不选择纯碱的主要考虑是_______ ;在“除镁除铁(调节pH≈11)”步骤中得到的滤渣中含铁成分是_______ ;写出“除铝”所发生的离子反应方程式_______ 。
(3)碳酸锂在水中的溶解度较小,其-lgKsp与温度t关系如下:
由此可知碳酸锂在水中的溶解热效应ΔH_______ 0(填“>”或者“<”);加入纯碱试剂进行“沉锂”后,依次进行保温静置、_______ (填写正确的顺序)。
①洗涤 ②趁热过滤 ③离心分离
(4)在“合成”中,碳酸锂粉末分次少量加入到冰水中溶解,再加入尿素搅拌得到“料液”,料液中徐徐加入溴,控制pH=5.0,反应生成LiBr和两种无色无味气体,写出化学方程式_______ 。

(1)锂辉石中主要成分LiAlSi2O6改写为氧化物形式为
(2)工业选择石灰石进行“中和”而不选择纯碱的主要考虑是
(3)碳酸锂在水中的溶解度较小,其-lgKsp与温度t关系如下:
| t/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| -1gKsp | 1.44 | 1.53 | 1.63 | 1.71 | 1.80 | 1.90 | 2.00 | 2.21 | 2.43 |
由此可知碳酸锂在水中的溶解热效应ΔH
①洗涤 ②趁热过滤 ③离心分离
(4)在“合成”中,碳酸锂粉末分次少量加入到冰水中溶解,再加入尿素搅拌得到“料液”,料液中徐徐加入溴,控制pH=5.0,反应生成LiBr和两种无色无味气体,写出化学方程式
您最近一年使用:0次
2022-06-02更新
|
491次组卷
|
3卷引用:湖南省攸县第一中学2022-2023学年高三第五次月考化学试题
名校
解题方法
10 . 工业上用含三价钒( )为主的某石煤为原料(含有
)为主的某石煤为原料(含有 、CaO等杂质),钙化法焙烧制备
、CaO等杂质),钙化法焙烧制备 ,其流程如下:
,其流程如下:

【资料】:+5价钒在溶液中的主要存在形式与溶液pH的关系:
(1)焙烧:向石煤中加生石灰焙烧,将 转化为
转化为 的化学方程式是
的化学方程式是_______ 。
(2)酸浸:
① 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的
难溶于水,可溶于盐酸。若焙砂酸浸时溶液的 ,
, 溶于盐酸的离子方程式是
溶于盐酸的离子方程式是_______ 。
②酸度对钒和铝的溶解量的影响如图所示:
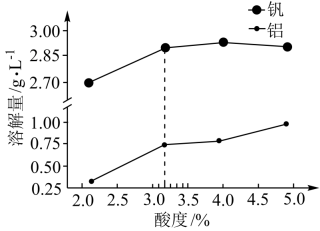
酸浸时溶液的酸度控制在大约3.2%,根据图推测,酸浸时不选择更高酸度的原因是_______ 。
(3)转沉:将浸出液中的钒转化为 固体,其流程如下:
固体,其流程如下:

①浸出液中加入石灰乳的作用是_______ 。
②已知 的溶解度小于
的溶解度小于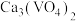 。向
。向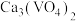 沉淀中加入
沉淀中加入 溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:
溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:_______ 。
③向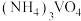 溶液中加入
溶液中加入 溶液,控制溶液的
溶液,控制溶液的 。当
。当 时,
时, 的产量明显降低,原因是
的产量明显降低,原因是_______ 。
(4)测定产品中 的纯度:称取ag产品,先用硫酸溶解,得到
的纯度:称取ag产品,先用硫酸溶解,得到 溶液。再加入
溶液。再加入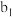 mL
mL 
 溶液(
溶液(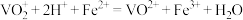 )。最后用
)。最后用 溶液滴定过量的
溶液滴定过量的 至终点,消耗
至终点,消耗 溶液的体积为
溶液的体积为 mL。已知
mL。已知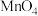 被还原为
被还原为 ,假设杂质不参与反应。则产品中
,假设杂质不参与反应。则产品中 的质量分数是
的质量分数是_______ 。( 的摩尔质量:
的摩尔质量: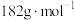 )
)
(5)全钒液流电池是具有发展前景的、用作储能系统的蓄电池,已知放电时 发生氧化反应,电池原理(电解液中含
发生氧化反应,电池原理(电解液中含 )如图:
)如图:
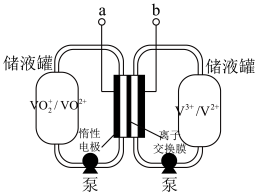
①a是_______ (填“正极”或“负极”)。
②该蓄电池反应方程式为_______ (标出“充电”“放电”方向)。
 )为主的某石煤为原料(含有
)为主的某石煤为原料(含有 、CaO等杂质),钙化法焙烧制备
、CaO等杂质),钙化法焙烧制备 ,其流程如下:
,其流程如下:
【资料】:+5价钒在溶液中的主要存在形式与溶液pH的关系:
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 |  |  |  |  |
 转化为
转化为 的化学方程式是
的化学方程式是(2)酸浸:
①
 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的
难溶于水,可溶于盐酸。若焙砂酸浸时溶液的 ,
, 溶于盐酸的离子方程式是
溶于盐酸的离子方程式是②酸度对钒和铝的溶解量的影响如图所示:

酸浸时溶液的酸度控制在大约3.2%,根据图推测,酸浸时不选择更高酸度的原因是
(3)转沉:将浸出液中的钒转化为
 固体,其流程如下:
固体,其流程如下:
①浸出液中加入石灰乳的作用是
②已知
 的溶解度小于
的溶解度小于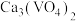 。向
。向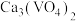 沉淀中加入
沉淀中加入 溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:
溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:③向
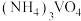 溶液中加入
溶液中加入 溶液,控制溶液的
溶液,控制溶液的 。当
。当 时,
时, 的产量明显降低,原因是
的产量明显降低,原因是(4)测定产品中
 的纯度:称取ag产品,先用硫酸溶解,得到
的纯度:称取ag产品,先用硫酸溶解,得到 溶液。再加入
溶液。再加入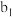 mL
mL 
 溶液(
溶液(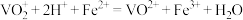 )。最后用
)。最后用 溶液滴定过量的
溶液滴定过量的 至终点,消耗
至终点,消耗 溶液的体积为
溶液的体积为 mL。已知
mL。已知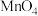 被还原为
被还原为 ,假设杂质不参与反应。则产品中
,假设杂质不参与反应。则产品中 的质量分数是
的质量分数是 的摩尔质量:
的摩尔质量: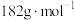 )
)(5)全钒液流电池是具有发展前景的、用作储能系统的蓄电池,已知放电时
 发生氧化反应,电池原理(电解液中含
发生氧化反应,电池原理(电解液中含 )如图:
)如图:
①a是
②该蓄电池反应方程式为
您最近一年使用:0次
2022-05-30更新
|
390次组卷
|
3卷引用:湖南省株洲市九方中学2021-2022学年高二下学期期末考试化学试题



