1 . 工业上以钛铁矿为原料,制备钛白(TiO2)和铁红两种重要产品的工艺流程如图:

已知:①钛铁矿的主要成分为钛酸亚铁(FeTiO3),含有 MgO、Al2O3、SiO2等杂质。
②酸浸时,FeTiO3转化为 Fe2+和 TiO2+;
③本实验温度下,Ksp[Mg(OH)2]=1.0×10–11;
④溶液中离子浓度小于 1×10–5 mo/L 时,认为该离子沉淀完全。
请回答下列问题:
(1)FeTiO3中 Ti 元素的化合价为___________ ;操作 1 所需要的玻璃仪器有烧杯、玻璃棒、___________ 。
(2)“水解”生成 H2TiO3的离子方程式为___________ ;该反应需要加热,加热的目的是___________ 。
(3)“沉铁”过程中,反应的离子方程式为___________ 。
(4)滤液2可用于制备 Mg(OH)2若滤液 2 中 c(Mg2+)=1.0×10-3mol/L,向其中加入NaOH 固体,调整溶液 pH 大于___________ 时,可使 Mg2+沉淀完全。
(5)在制备钛白(TiO2)过程中,需要测定钛液中 TiO2+的物质的量浓度:测定时首先取10 mL钛液用水冲稀10倍。加入一定量铝粉,充分振荡,使其完全反应:TiO2++Al→Ti3++Al3+(未配平)。过滤后,取出滤液20mL,向其中滴加2~3 滴KSCN溶液,再加入5 mL蒸馏水振荡,用酸式滴定管滴加0.1mol/LFeCl3溶液(Fe3+能将Ti3+氧化成四价钛的化合物)至终点,用去了30.00 mLFeCl3溶液。则原钛液中 TiO2+的物质的量浓度为___________ 。

已知:①钛铁矿的主要成分为钛酸亚铁(FeTiO3),含有 MgO、Al2O3、SiO2等杂质。
②酸浸时,FeTiO3转化为 Fe2+和 TiO2+;
③本实验温度下,Ksp[Mg(OH)2]=1.0×10–11;
④溶液中离子浓度小于 1×10–5 mo/L 时,认为该离子沉淀完全。
请回答下列问题:
(1)FeTiO3中 Ti 元素的化合价为
(2)“水解”生成 H2TiO3的离子方程式为
(3)“沉铁”过程中,反应的离子方程式为
(4)滤液2可用于制备 Mg(OH)2若滤液 2 中 c(Mg2+)=1.0×10-3mol/L,向其中加入NaOH 固体,调整溶液 pH 大于
(5)在制备钛白(TiO2)过程中,需要测定钛液中 TiO2+的物质的量浓度:测定时首先取10 mL钛液用水冲稀10倍。加入一定量铝粉,充分振荡,使其完全反应:TiO2++Al→Ti3++Al3+(未配平)。过滤后,取出滤液20mL,向其中滴加2~3 滴KSCN溶液,再加入5 mL蒸馏水振荡,用酸式滴定管滴加0.1mol/LFeCl3溶液(Fe3+能将Ti3+氧化成四价钛的化合物)至终点,用去了30.00 mLFeCl3溶液。则原钛液中 TiO2+的物质的量浓度为
您最近一年使用:0次
2 . 化学与生产生活紧密相关,下列有关说法中不正确的是
| A.侯氏制碱法中为提高气体利用率,向饱和食盐水中先通入 CO2 后通入氨气 |
| B.生产医用口罩的熔喷布主要原料是聚丙烯,聚丙烯是一种有机高分子材料 |
| C.除去锅炉中的水垢时,可先用碳酸钠溶液处理,使水垢蓬松,再加入酸去除 |
| D.醴陵釉下五彩瓷烧制温度达 1380℃,该过程中发生了复杂的物理、化学变化 |
您最近一年使用:0次
名校
解题方法
3 . 磷化镉(Cd3P2)常用作杀虫剂,湿法炼锌产生的铜镉渣(主要含铜、铁、镉等单质)用于生产磷化镉的工艺流程如下:
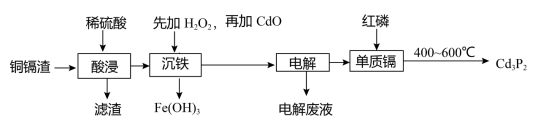
回答下列问题:
(1)“酸浸”前粉碎铜镉渣的目的是_______ 。
(2)“酸浸”产生的滤渣主要成分为_______ (填化学式)。
(3)“沉铁”中先加入适量H2O2,发生反应的离子方程式为_______ ,再加入CdO的作用是_______ 。
(4)处理含Cd2+废水常用加入碳酸钙的方法实现沉淀转化,该沉淀转化的离子方程式为_______ ,若反应达到平衡后溶液中c(Ca2+)=0.1mol/L,溶液中c(Cd2+)=_______ mol/L(已知25℃,Ksp(CdCO3)=5.6×10-12,Ksp(CaCO3)=5.6×10-9)。

回答下列问题:
(1)“酸浸”前粉碎铜镉渣的目的是
(2)“酸浸”产生的滤渣主要成分为
(3)“沉铁”中先加入适量H2O2,发生反应的离子方程式为
(4)处理含Cd2+废水常用加入碳酸钙的方法实现沉淀转化,该沉淀转化的离子方程式为
您最近一年使用:0次
2021-01-11更新
|
85次组卷
|
3卷引用:湖南省株洲市第四中学2022-2023学年高三上学期第三次月考化学试题
名校
解题方法
4 . 根据25℃下列实验操作和现象所得出的结论不正确的是
| 选项 | 实验操作和现象 | 结论 |
| A. | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | X具有强氧化性 |
| B. | 将稀HClO4溶液滴入硅酸钠溶液中,充分振荡,有白色沉淀产生 | 非金属性:Cl>Si |
| C. | 常温下,分别测定浓度均为0.1mol/L的NaF溶液和NaClO溶液的pH,后者的pH大 | 酸性:HF>HClO |
| D. | 向3mL0.1mol/LAgNO3溶液中先加入4-5滴0.1mol/LNaCl溶液,再滴加4-5滴0.1mol/LNaI溶液,先出现白色沉淀,后出现黄色沉淀 | 25℃Ksp(AgC1)>Ksp(AgI) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-01-06更新
|
234次组卷
|
4卷引用:湖南省株洲世纪星高级中学2022-2023学年高二上学期期末考试化学试题
5 . 下列图象与描述相符的是


A.图甲表示反应 ,保持其他条件不变,改变CO的物质的量,平衡时 ,保持其他条件不变,改变CO的物质的量,平衡时 的体积分数变化情况。由图可知, 的体积分数变化情况。由图可知, 的转化率: 的转化率: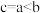 |
B.图乙表示 氧化反应分别在有、无催化剂的情况下反应过程中的能量变化 氧化反应分别在有、无催化剂的情况下反应过程中的能量变化 |
C.图丙是室温下 和 和 的饱和溶液中离子浓度的关系曲线,说明该温度下反应 的饱和溶液中离子浓度的关系曲线,说明该温度下反应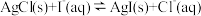 的平衡常数 的平衡常数 |
D.图丁表示炭黑作用下 生成活化氧过程中能量变化情况,说明每活化一个氧分子吸收 生成活化氧过程中能量变化情况,说明每活化一个氧分子吸收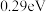 的能量 的能量 |
您最近一年使用:0次
2020-12-17更新
|
558次组卷
|
6卷引用:湖南省株洲市第一中学2022-2023学年高二下学期第一次月考化学试题
湖南省株洲市第一中学2022-2023学年高二下学期第一次月考化学试题江苏省2021届高三百校第二次联考化学试题福建省福州市第三中学2021届高三下学期第八次质量检测化学试题江苏省百校联考2021届高三第二次考试化学试题(已下线)押山东卷第14题 化学反应速率和平衡-备战2021年高考化学临考题号押题(山东卷)江苏省盐城市阜宁中学2021-2022学年高三上学期第二次阶段检测化学试题
名校
解题方法
6 . 氮和硫的氧化物的综合利用是目前研究的热点之一,回答下列问题。
已知: i. N2(g)+O2(g) 2NO(g)△H=+180.0 kJ·mol-1
2NO(g)△H=+180.0 kJ·mol-1
ii. 2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
iii. 2NO(g)+O2(g) 2NO2(g) △H=-113.0 kJ·mol-1
2NO2(g) △H=-113.0 kJ·mol-1
(1)反应 iV:2NO2(g)+2SO2(g) 2SO3(g)+N2(g)+O2(g)的△H=
2SO3(g)+N2(g)+O2(g)的△H=______ ; 该反应在密闭容器中达到平衡后,只改变下列条件,一定能使 N2的平衡体积分数增大的是______ (填选项字母)。
A 缩小容器容积 B 再充入 SO2 C 降低温度 D 分离出 SO3
(2)T1°C 时,容积相等的密闭容器中分别充入 NO2和 SO2的混合气体 4 mol,发生反应 iV。NO2或 SO2的平衡转化率(a)与起始充入的 系如图所示。
系如图所示。

①图中能表示平衡时 a(SO2)与起始充入的 系的曲线为
系的曲线为_____ (填“L1”或“L2”);
②反应的平衡常数K=_____ 。
(3)利用下图所示装置(电极均为惰性电极)也可吸收 SO2,并用阴极排出的溶液吸收 NO2。
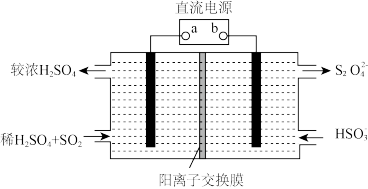
①阳极的电极反应式为______ 。
②在碱性条件下,用阴极排出的溶液吸收 NO2,使其转化为无害气体 N2,同时有 SO 生成,该反应的离子方程式为
生成,该反应的离子方程式为______ 。
(4)SO2可用钙基固硫反应除去,反应生成的 CaSO4是一种微溶物质,其Ksp=9.0×10-6。若将浓度为 2×10-3mol/L 的 Na2SO4溶液与等体积的 CaCl2溶液混合,则生成沉淀所需 CaCl2溶液的最小浓度为_____ mol/L。
已知: i. N2(g)+O2(g)
 2NO(g)△H=+180.0 kJ·mol-1
2NO(g)△H=+180.0 kJ·mol-1ii. 2SO2(g)+O2(g)
 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1iii. 2NO(g)+O2(g)
 2NO2(g) △H=-113.0 kJ·mol-1
2NO2(g) △H=-113.0 kJ·mol-1(1)反应 iV:2NO2(g)+2SO2(g)
 2SO3(g)+N2(g)+O2(g)的△H=
2SO3(g)+N2(g)+O2(g)的△H=A 缩小容器容积 B 再充入 SO2 C 降低温度 D 分离出 SO3
(2)T1°C 时,容积相等的密闭容器中分别充入 NO2和 SO2的混合气体 4 mol,发生反应 iV。NO2或 SO2的平衡转化率(a)与起始充入的
 系如图所示。
系如图所示。
①图中能表示平衡时 a(SO2)与起始充入的
 系的曲线为
系的曲线为②反应的平衡常数K=
(3)利用下图所示装置(电极均为惰性电极)也可吸收 SO2,并用阴极排出的溶液吸收 NO2。

①阳极的电极反应式为
②在碱性条件下,用阴极排出的溶液吸收 NO2,使其转化为无害气体 N2,同时有 SO
 生成,该反应的离子方程式为
生成,该反应的离子方程式为(4)SO2可用钙基固硫反应除去,反应生成的 CaSO4是一种微溶物质,其Ksp=9.0×10-6。若将浓度为 2×10-3mol/L 的 Na2SO4溶液与等体积的 CaCl2溶液混合,则生成沉淀所需 CaCl2溶液的最小浓度为
您最近一年使用:0次
2020-09-04更新
|
181次组卷
|
2卷引用:湖南省株洲市第八中学2023届高三上学期第一次月考化学试题
名校
解题方法
7 . 下列化学用语表示不正确的是( )
A.醋酸的电离:CH3COOH CH3COO-+H+ CH3COO-+H+ |
B.碳酸氢钠在水溶液中的电离:NaHCO3=Na++HCO |
C.氯化铵的水解:NH +H2O +H2O NH4OH+H+ NH4OH+H+ |
D.碳酸钙的溶解平衡:CaCO3(s) Ca2+(aq)+CO Ca2+(aq)+CO (aq) (aq) |
您最近一年使用:0次
2020-08-15更新
|
641次组卷
|
15卷引用:湖南省株洲市五雅中学2022-2023学年高二上学期11月期中考试化学试题
湖南省株洲市五雅中学2022-2023学年高二上学期11月期中考试化学试题黑龙江省伊春市伊美区第二中学2019-2020学年高二上学期第一次月考化学试题四川省成都市郫都区川科外国语学校2020-2021学年高二11月月考化学试题河北省任丘市第一中学2020-2021学年高二上学期第二次阶段考试化学试题陕西省西安中学2020-2021学年高二上学期期末考试化学试题云南省玉溪第二中学2020-2021学年高二下学期第一次月考化学试题云南省玉溪市江川区第二中学2020-2021学年高二下学期第一次月考化学试题江西省贵溪市实验中学2020-2021学年高二下学期第二次月考化学试题湖南省长沙市南雅中学2021-2022学年高二下学期期中考试化学试题广东省广州市第一中学2022-2023学年高二上学期期末考试化学试题浙江省杭州市长河高级中学2022-2023学年高二上学期期中考试化学试题广东省河源市龙川县第一中学2022-2023学年高二上学期期末考试化学试题广东省化州市第一中学2023-2024学年高二上学期12月质量检测化学试卷 内蒙古自治区第二地质中学2023-2024学年高二上学期12月期中考试化学试题青海省西宁市海湖中学2023-2024学年高二下学期开学考试化学试卷
名校
解题方法
8 . 工业上以钒炉渣(主要含V2O3还有少量SiO2、P2O5等杂质)为原料可以制备氧钒碱式碳酸铵晶体[(NH4)a(VO)b(CO3)c(OH)d•nH2O),其中V为+4价。其生产工艺流程如下:
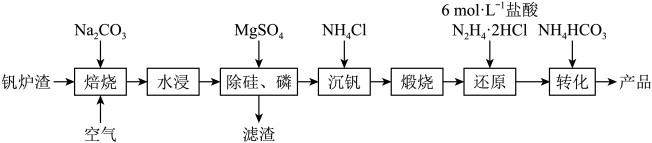
(1)“沉钒”得到偏钒酸铵(NH4VO3),若滤液中c( )=0.lmol•L-1,为使钒元素的沉降率达到98%,至少应调节c(
)=0.lmol•L-1,为使钒元素的沉降率达到98%,至少应调节c( )为
)为_______ mol•L-1。已知:Ksp(NH4VO3)=1.6×10-3。
(2)“还原”V2O5过程中,生成VOCl2和一种无色无污染的气体,该反应的化学方程为式_________ 。用浓盐酸与V2O5反应也可以制得VOCl2,该方法的缺点是________ 。
(3)为测定氧钒碱式碳酸铵样品的组成,进行下列实验:
①准确称量1.0650g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加水稀释至100.00mL得到溶液A。将溶解过程产生的气体全部通入足量澄清石灰水,生成白色沉淀0.4000g。
②准确量取20.00mL溶液A,加足量的NaOH溶液并充分加热,生成NH322.4mL(标准状况)。
③准确量取20.00mL溶液A,加入0.l000mol•L-1KMnO4溶液将VO2+恰好氧化成 ,然后用0.l000mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为12.00mL。已知滴定反应为:
,然后用0.l000mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为12.00mL。已知滴定反应为: +Fe2++2H+=VO2++Fe3++H2O。
+Fe2++2H+=VO2++Fe3++H2O。
通过计算确定该氧钒碱式碳酸铵晶体样品的化学式(写出计算过程)__________ 。

(1)“沉钒”得到偏钒酸铵(NH4VO3),若滤液中c(
 )=0.lmol•L-1,为使钒元素的沉降率达到98%,至少应调节c(
)=0.lmol•L-1,为使钒元素的沉降率达到98%,至少应调节c( )为
)为(2)“还原”V2O5过程中,生成VOCl2和一种无色无污染的气体,该反应的化学方程为式
(3)为测定氧钒碱式碳酸铵样品的组成,进行下列实验:
①准确称量1.0650g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加水稀释至100.00mL得到溶液A。将溶解过程产生的气体全部通入足量澄清石灰水,生成白色沉淀0.4000g。
②准确量取20.00mL溶液A,加足量的NaOH溶液并充分加热,生成NH322.4mL(标准状况)。
③准确量取20.00mL溶液A,加入0.l000mol•L-1KMnO4溶液将VO2+恰好氧化成
 ,然后用0.l000mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为12.00mL。已知滴定反应为:
,然后用0.l000mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为12.00mL。已知滴定反应为: +Fe2++2H+=VO2++Fe3++H2O。
+Fe2++2H+=VO2++Fe3++H2O。通过计算确定该氧钒碱式碳酸铵晶体样品的化学式(写出计算过程)
您最近一年使用:0次
2020-07-31更新
|
236次组卷
|
3卷引用:湖南省攸县长鸿实验中学2022-2023学年高三第四次月考化学试题
9 . 硫酸锰在电解锰、染料、造纸以及陶瓷等工业生产中有广泛的应用。利用软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分ZnS)制得硫酸锰的流程如下:

已知:常温下,Ksp(ZnS) =1.2×l0-24、Ksp(MnS)=1.5×10-15
关于该流程说法错误的是

已知:常温下,Ksp(ZnS) =1.2×l0-24、Ksp(MnS)=1.5×10-15
关于该流程说法错误的是
| A.“酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是作催化剂。 |
B.“沉锌”反应为:Zn2+(aq)+MnS(s) ZnS(s)+Mn2+(aq),该反应的平衡常数K为1.25×109 ZnS(s)+Mn2+(aq),该反应的平衡常数K为1.25×109 |
| C.“除铁”时加二氧化锰是为了氧化Fe2+,然后向溶液加适量氨水将溶液pH调节为3~4 |
| D.该流程中可以循环利用的物质是ZnS |
您最近一年使用:0次
名校
10 . 污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
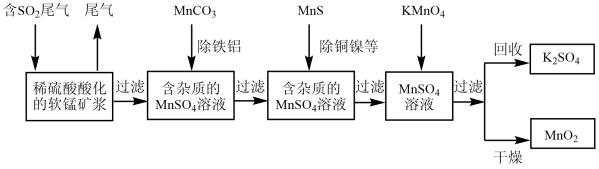
请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、漏斗以及___ 。
(2)上述流程脱硫实现了___ (选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(3)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是调节溶液的pH,消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀,若25℃时,Ksp[Fe(OH)3]=8.0×10-38,lg2=0.3,要使溶液中的Fe3+完全沉淀,至少要把溶液pH调至___ 。
(4)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀(此时溶液中c(Ni2+)=1.0×10-5mol·L-1),溶液中c(Cu2+)=___ mol·L-1。
(5)已知:25℃、101kpa时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ·mol-1
S(s)+O2(g)=SO2(g) △H=-297kJ·mol-1
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是___ 。
(6)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极,请写出阳极的电极反应式___ 。

请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、漏斗以及
(2)上述流程脱硫实现了
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(3)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是调节溶液的pH,消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀,若25℃时,Ksp[Fe(OH)3]=8.0×10-38,lg2=0.3,要使溶液中的Fe3+完全沉淀,至少要把溶液pH调至
(4)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀(此时溶液中c(Ni2+)=1.0×10-5mol·L-1),溶液中c(Cu2+)=
(5)已知:25℃、101kpa时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ·mol-1
S(s)+O2(g)=SO2(g) △H=-297kJ·mol-1
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是
(6)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极,请写出阳极的电极反应式
您最近一年使用:0次



