名校
1 . 一种银铟矿主要成分为Au、Ag2S、CuS、ZnS、PbS、FeS、In2O3、Ga2O3等物质,从该矿获得稀有金属的工艺流程如图所示:

该工艺条件下,金属离子开始沉淀和完全沉淀的pH如表:
(1)“浸出”过程中金、银分别转化为AuCl 、AgCl
、AgCl 进入溶液,同时生成硫,写出Ag2S发生反应的离子方程式
进入溶液,同时生成硫,写出Ag2S发生反应的离子方程式____ 。
(2)高温水蒸气除铁利用了FeCl3易水解的性质,写出该反应的化学方程式____ 。
(3)“二次还原”得到的滤液中主要的阳离子有H+、Na+、Ca2+、Zn2+、Pb3+、In3+、____ 。
(4)“二次中和”得到的滤渣除少量Fe(OH)3外,主要成分还有____ (写化学式)。
(5)“分铅锌”步骤中,维持H2S饱和水溶液的浓度为0.1mol·L-1,为使Zn2+沉淀完全,需控制溶液的pH不小于____ 已知:lg3≈0.48;Ksp(ZnS)=3.0×10-25,Ka1(H2S)=1.0×10-7,Ka2(H2S)=1.0×10-13]。
(6)已知:氧化还原反应可看成由两个半反应组成,每个半反应具有一定的电极电势(用“φ”表示),φ越大则该物质的氧化性越强,φ越低则该物质的还原性越强。浸出步骤中金反应的两个半反应如下:
HClO+H++2e-=C1-+H2O φ=1.49+ lg
lg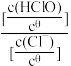
AuCl4-+3e-=4C1-+Au φ=0.994+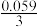 lg
lg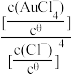
(φ与半反应式的系数无关,仅与浓度有关,cθ=1mol·L-1)
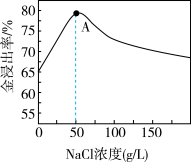
如图是Au的浸出率与NaCl溶液浓度的关系,请解释A点以后,金浸出率减小的原因是____ 。

该工艺条件下,金属离子开始沉淀和完全沉淀的pH如表:
| 金属离子 | Fe3+ | In3+ | Ga3+ | Cu2+ | Zn2+ | Pb2+ |
| 开始沉淀的pH | 2.2 | 2.1 | 2.6 | 4.6 | 6.24 | 7.1 |
| 完全沉淀(c=1.0×10-5mol·L-1)的pH | 3.2 | 3.4 | 4.3 | 6.6 | 8.24 | 9.1 |
(1)“浸出”过程中金、银分别转化为AuCl
 、AgCl
、AgCl 进入溶液,同时生成硫,写出Ag2S发生反应的离子方程式
进入溶液,同时生成硫,写出Ag2S发生反应的离子方程式(2)高温水蒸气除铁利用了FeCl3易水解的性质,写出该反应的化学方程式
(3)“二次还原”得到的滤液中主要的阳离子有H+、Na+、Ca2+、Zn2+、Pb3+、In3+、
(4)“二次中和”得到的滤渣除少量Fe(OH)3外,主要成分还有
(5)“分铅锌”步骤中,维持H2S饱和水溶液的浓度为0.1mol·L-1,为使Zn2+沉淀完全,需控制溶液的pH不小于
(6)已知:氧化还原反应可看成由两个半反应组成,每个半反应具有一定的电极电势(用“φ”表示),φ越大则该物质的氧化性越强,φ越低则该物质的还原性越强。浸出步骤中金反应的两个半反应如下:
HClO+H++2e-=C1-+H2O φ=1.49+
 lg
lg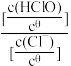
AuCl4-+3e-=4C1-+Au φ=0.994+
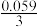 lg
lg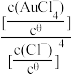
(φ与半反应式的系数无关,仅与浓度有关,cθ=1mol·L-1)
如图是Au的浸出率与NaCl溶液浓度的关系,请解释A点以后,金浸出率减小的原因是

您最近一年使用:0次
2022-04-27更新
|
716次组卷
|
5卷引用:湖南省岳阳市一中2021-2022学年高三下学期第三次模拟考试试题
湖南省岳阳市一中2021-2022学年高三下学期第三次模拟考试试题湖南省永州市2022届高三高考第三次适应性考试化学试题江西省南昌市八一中学2022届高三下学期第三次模拟考试理科综合化学试题福建省厦门外国语学校2023届高三上学期期末检测化学试题(已下线)湖北省七市(州)2023届高三3月联合统一调研测试化学试题变式题(工业流程题)
名校
解题方法
2 .  是锂离子电池的活性材料。某小组以含锰矿料(主要成分是
是锂离子电池的活性材料。某小组以含锰矿料(主要成分是 ,含少量
,含少量 、
、 、FeO、CoO和
、FeO、CoO和 )为原料制备
)为原料制备 的流程如图所示(部分条件和产物省略)。
的流程如图所示(部分条件和产物省略)。

已知几种金属氢氧化物沉淀的pH如表所示:
请回答下列问题:
(1)写出一条提高“酸浸”速率的措施:_______ 。
(2)“除杂1”时,加入 的作用是
的作用是_______ (用离子方程式表示)。
(3)“固体1”中除了含有 外,还只含有另外一种固体,其化学式为
外,还只含有另外一种固体,其化学式为_______ ,则“除杂1”过程调节pH范围为_______ 。
(4)在高温下“合成” ,反应的化学方程式为
,反应的化学方程式为_______ 。
(5)已知:常温下,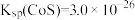 。为了使残液中
。为了使残液中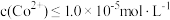 ,必须控制
,必须控制 ≥
≥_______ mol/L。
(6)“浸渣”中含少量锰元素,其测定方法如下:
第1步:称取W g“浸渣”,加酸将锰元素以 形式全部溶出,过滤,将滤液加入250mL容量瓶中,定容;
形式全部溶出,过滤,将滤液加入250mL容量瓶中,定容;
第2步:取25.00mL上述定容后的溶液于锥形瓶中,加入少量催化剂和过量 溶液,加热,充分反应后,煮沸溶液;
溶液,加热,充分反应后,煮沸溶液;
第3步:用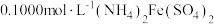 溶液滴定至终点,消耗滴定液V mL,使
溶液滴定至终点,消耗滴定液V mL,使 重新变为
重新变为 。
。
已知: 具有强氧化性,受热易分解。
具有强氧化性,受热易分解。
①“浸渣”中锰元素的质量分数为_______ (用含W、V的代数式表示)。
②如果省略第2步“煮沸溶液”,测得结果将_______ (填“偏高”、“偏低”或“无影响”)。
 是锂离子电池的活性材料。某小组以含锰矿料(主要成分是
是锂离子电池的活性材料。某小组以含锰矿料(主要成分是 ,含少量
,含少量 、
、 、FeO、CoO和
、FeO、CoO和 )为原料制备
)为原料制备 的流程如图所示(部分条件和产物省略)。
的流程如图所示(部分条件和产物省略)。
已知几种金属氢氧化物沉淀的pH如表所示:
| 金属氢氧化物 |  |  |  |  |
| 开始沉淀的pH | 2.7 | 7.6 | 7.6 | 7.7 |
| 完全沉淀的pH | 3.7 | 9.1 | 9.1 | 9.2 |
请回答下列问题:
(1)写出一条提高“酸浸”速率的措施:
(2)“除杂1”时,加入
 的作用是
的作用是(3)“固体1”中除了含有
 外,还只含有另外一种固体,其化学式为
外,还只含有另外一种固体,其化学式为(4)在高温下“合成”
 ,反应的化学方程式为
,反应的化学方程式为(5)已知:常温下,
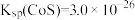 。为了使残液中
。为了使残液中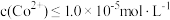 ,必须控制
,必须控制 ≥
≥(6)“浸渣”中含少量锰元素,其测定方法如下:
第1步:称取W g“浸渣”,加酸将锰元素以
 形式全部溶出,过滤,将滤液加入250mL容量瓶中,定容;
形式全部溶出,过滤,将滤液加入250mL容量瓶中,定容;第2步:取25.00mL上述定容后的溶液于锥形瓶中,加入少量催化剂和过量
 溶液,加热,充分反应后,煮沸溶液;
溶液,加热,充分反应后,煮沸溶液;第3步:用
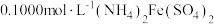 溶液滴定至终点,消耗滴定液V mL,使
溶液滴定至终点,消耗滴定液V mL,使 重新变为
重新变为 。
。已知:
 具有强氧化性,受热易分解。
具有强氧化性,受热易分解。①“浸渣”中锰元素的质量分数为
②如果省略第2步“煮沸溶液”,测得结果将
您最近一年使用:0次
2022-04-18更新
|
350次组卷
|
4卷引用:湖南省岳阳市第一中学2023届高三下学期第五次月考化学试题
解题方法
3 . 下列实验操作、现象和结论均正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 溴乙烷与NaOH的乙醇溶液混合加热,将产生的气体通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色 | 溴乙烷在NaOH的乙醇溶液中发生的是消去反应生成乙烯 |
| B | 向NaCl和NaI的混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgI)<Ksp(AgCl) |
| C | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液 | 前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在I2和I- |
| D | 室温下,将一定浓度的KI溶液和稀硫酸混合,取等量混合液分别加入两支试管中,其中一支试管置于盛有冰水的烧杯中。一段时间后,同时向两试管中加入淀粉溶液 | 室温下的试管中溶液先变蓝,冰水浴的试管中溶液后变蓝 | 升高温度能加快反应速率 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
4 . 下列实验操作、对应的现象及结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向淀粉水解后的溶液中加入碘水 | 溶液变蓝 | 淀粉没有水解 |
| B | 将SO2通入BaCl2溶液中,然后滴加FeCl3饱和溶液 | 先无沉淀生成,滴加FeCl3溶液后有白色沉淀生成 | SO2有还原性 |
| C | 向盛有2mL0.1mol/LAgNO3溶液的试管中滴加1mL0.1mol/LNaCl溶液,再向其中滴加4~5滴0.1mol/LKI溶液 | 先有白色沉淀生成,后又产生黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | A、B两试管中均盛有4mL0.1mol/LKMnO4溶液。A中加入2mL0.01mol/L草酸溶液,B中加入2mL0.02mol/L草酸溶液,分别记录溶液褪色所需时间 | B中溶液褪色比A中溶液褪色所需时间短 | 反应物的浓度越大,化学反应速率越快 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 常温下,用 溶液分别滴定浓度均为
溶液分别滴定浓度均为 的
的 、
、 溶液,所得的沉淀溶解平衡图象如下图所示(不考虑
溶液,所得的沉淀溶解平衡图象如下图所示(不考虑 的水解)。下列叙述正确的是
的水解)。下列叙述正确的是

 溶液分别滴定浓度均为
溶液分别滴定浓度均为 的
的 、
、 溶液,所得的沉淀溶解平衡图象如下图所示(不考虑
溶液,所得的沉淀溶解平衡图象如下图所示(不考虑 的水解)。下列叙述正确的是
的水解)。下列叙述正确的是
A. 为 为 |
B.n点表示 的不饱和溶液 的不饱和溶液 |
C.在 、 、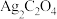 共存的悬浊液中, 共存的悬浊液中, |
D.向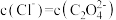 的混合溶液中滴入 的混合溶液中滴入 溶液时,先生成 溶液时,先生成 沉淀 沉淀 |
您最近一年使用:0次
2022-03-20更新
|
567次组卷
|
8卷引用:湖南省岳阳县第一中学2022-2023学年高二上学期11月期中测试化学试题
湖南省岳阳县第一中学2022-2023学年高二上学期11月期中测试化学试题北京市第二中学2021-2022学年高三12月月考化学试题(已下线)三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)化学-2022年高考押题预测卷02(北京卷)(含考试版、全解全析、参考答案、答题卡)北京市第二中学2022-2023学年高三上学期12月考化学试题辽宁省抚顺市第一中学2022-2023学年高三上学期期末线上阶段验收化学试题(已下线)T15-溶液中的离子平衡湖北省孝感市2023-2024学年高二上学期11月期中考试化学试题
解题方法
6 . 下列对实验现象的解释或结论正确的是
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 向蔗糖中加入浓硫酸 | 蔗糖变黑,体积膨胀,放出有刺激性气味气体 | 浓硫酸具有脱水性和强氧化性,反应中生成C、SO2和CO2等 |
| B | 向某溶液中加入盐酸酸化的BaCl2溶液 | 有白色沉淀产生 | 该溶液中一定含有 |
| C | 向苯中滴入少量浓溴水,振荡,静置 | 溶液分层;上层呈橙红色,下层几乎无色, | 苯和溴水发生取代反应,使溴水褪色 |
| D | 向浓度均为 和 和 混合溶液中滴加少量 混合溶液中滴加少量 溶液 溶液 | 出现黑色沉淀 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-15更新
|
631次组卷
|
2卷引用:湖南省岳阳市华容县普通高中2023届高三新高考适应性考试化学试题
名校
7 . 室温下,通过下列实验探究亚硫酸盐的性质。已知: 、
、 。
。
下列说法正确的是
 、
、 。
。| 实验 | 实验操作和现象 |
| 1 | 向 溶液通入11.2mL(标准状况)SO2,测得pH约为9(不考虑溶液体积变化) 溶液通入11.2mL(标准状况)SO2,测得pH约为9(不考虑溶液体积变化) |
| 2 | 向 溶液通入SO2至溶液pH=7(不考虑溶液体积变化) 溶液通入SO2至溶液pH=7(不考虑溶液体积变化) |
| 3 | 向 溶液通入22.4mL(标准状况)SO2,测得pH约为3(不考虑溶液体积变化) 溶液通入22.4mL(标准状况)SO2,测得pH约为3(不考虑溶液体积变化) |
| 4 | 取实验3所得溶液1mL,加入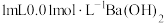 溶液,产生白色沉淀(假设反应后溶液体积为反应前两溶液之和) 溶液,产生白色沉淀(假设反应后溶液体积为反应前两溶液之和) |
A.实验1得到的溶液中有: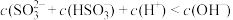 |
B.实验2得到的溶液中有: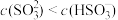 |
C.实验3得到的溶液中有: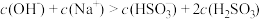 |
D.实验4中可知: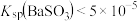 |
您最近一年使用:0次
2022-03-10更新
|
216次组卷
|
2卷引用:湖南省岳阳市岳汨联考2023-2024学年高三下学期5月月考化学试题
名校
8 . 下列说法正确的是
A.NaClO溶液中,离子浓度大小关系为: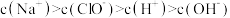 |
B. 的溶液一定呈酸性 的溶液一定呈酸性 |
| C.可溶性正盐BA的溶液呈中性,可以推测BA为强酸强碱盐 |
D.常温下,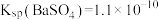 ,则 ,则 饱和溶液中 饱和溶液中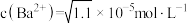 |
您最近一年使用:0次
2022-03-10更新
|
825次组卷
|
6卷引用:湖南省岳阳县第一中学2022-2023学年高二上学期11月期中测试化学试题
名校
解题方法
9 . 锰( )最早是由瑞典化学家、氯气的发现者舍勒从软锰矿中发现的,锰常用于制造合金锰钢。某化工厂以软锰矿(主要成分是
)最早是由瑞典化学家、氯气的发现者舍勒从软锰矿中发现的,锰常用于制造合金锰钢。某化工厂以软锰矿(主要成分是 ,含有
,含有 、
、 、
、 等少量杂质)为主要原料制取金属锰的工艺流程如下图所示:
等少量杂质)为主要原料制取金属锰的工艺流程如下图所示:
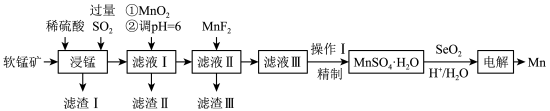
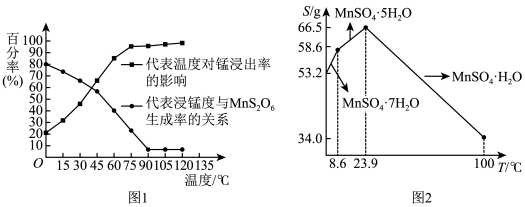
(1)“浸锰”步骤中往往有副产物 生成,温度对“浸锰”反应的影响如图1所示。为减少
生成,温度对“浸锰”反应的影响如图1所示。为减少 的生成,“浸锰”的适宜温度是
的生成,“浸锰”的适宜温度是___________ ,滤渣Ⅰ的成分是___________ 。该步骤中可以再加入 以促进“滤渣”析出,结合平衡移动原理分析其原因:
以促进“滤渣”析出,结合平衡移动原理分析其原因:___________ 。
(2)滤液Ⅰ中需要先加入 充分反应后再调
充分反应后再调 ,写出加入
,写出加入 时发生反应的离子方程式:
时发生反应的离子方程式:___________ 。
(3)滤液Ⅱ中加入 的目的是除去溶液中的
的目的是除去溶液中的 ,已知
,已知 时,
时,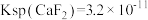 ,则常温下
,则常温下 在纯水中的溶解度=
在纯水中的溶解度=___________ g。
(4)由滤液Ⅲ可制得 ,已知硫酸锰在不同温度下的溶解度和析出晶体的组成如图2所示。则从滤液Ⅲ中获得较高纯度
,已知硫酸锰在不同温度下的溶解度和析出晶体的组成如图2所示。则从滤液Ⅲ中获得较高纯度 的操作Ⅰ是:控制温度在
的操作Ⅰ是:控制温度在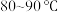 蒸发结晶,
蒸发结晶,___________ ,用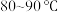 的蒸馏水洗涤2~3次、真空干燥。
的蒸馏水洗涤2~3次、真空干燥。
(5)电解时加入适量的 有利于
有利于 在电极上析出,
在电极上析出, 与水反应生成的
与水反应生成的 (二元弱酸)在阴极放电生成
(二元弱酸)在阴极放电生成 单质,该电极反应为
单质,该电极反应为___________ 。电极上生成的 对
对 有特殊的吸附能力,有利于
有特殊的吸附能力,有利于 电还原沉积。
电还原沉积。
 )最早是由瑞典化学家、氯气的发现者舍勒从软锰矿中发现的,锰常用于制造合金锰钢。某化工厂以软锰矿(主要成分是
)最早是由瑞典化学家、氯气的发现者舍勒从软锰矿中发现的,锰常用于制造合金锰钢。某化工厂以软锰矿(主要成分是 ,含有
,含有 、
、 、
、 等少量杂质)为主要原料制取金属锰的工艺流程如下图所示:
等少量杂质)为主要原料制取金属锰的工艺流程如下图所示:
(1)“浸锰”步骤中往往有副产物
 生成,温度对“浸锰”反应的影响如图1所示。为减少
生成,温度对“浸锰”反应的影响如图1所示。为减少 的生成,“浸锰”的适宜温度是
的生成,“浸锰”的适宜温度是 以促进“滤渣”析出,结合平衡移动原理分析其原因:
以促进“滤渣”析出,结合平衡移动原理分析其原因:(2)滤液Ⅰ中需要先加入
 充分反应后再调
充分反应后再调 ,写出加入
,写出加入 时发生反应的离子方程式:
时发生反应的离子方程式:
(3)滤液Ⅱ中加入
 的目的是除去溶液中的
的目的是除去溶液中的 ,已知
,已知 时,
时,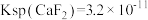 ,则常温下
,则常温下 在纯水中的溶解度=
在纯水中的溶解度=(4)由滤液Ⅲ可制得
 ,已知硫酸锰在不同温度下的溶解度和析出晶体的组成如图2所示。则从滤液Ⅲ中获得较高纯度
,已知硫酸锰在不同温度下的溶解度和析出晶体的组成如图2所示。则从滤液Ⅲ中获得较高纯度 的操作Ⅰ是:控制温度在
的操作Ⅰ是:控制温度在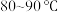 蒸发结晶,
蒸发结晶,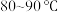 的蒸馏水洗涤2~3次、真空干燥。
的蒸馏水洗涤2~3次、真空干燥。(5)电解时加入适量的
 有利于
有利于 在电极上析出,
在电极上析出, 与水反应生成的
与水反应生成的 (二元弱酸)在阴极放电生成
(二元弱酸)在阴极放电生成 单质,该电极反应为
单质,该电极反应为 对
对 有特殊的吸附能力,有利于
有特殊的吸附能力,有利于 电还原沉积。
电还原沉积。
您最近一年使用:0次
2022-01-23更新
|
319次组卷
|
2卷引用:湖南省岳阳市2021-2022学年高三上学期质量监测化学试题
10 . 化学与生活密切相关,下列说法中正确的是
| A.海水淡化可以缓解淡水供应危机,海水淡化的方法主要有蒸馏法、电渗析法和离子交换法等 |
| B.牙膏中添加氟化物用于预防龋齿是利用了氧化还原反应的原理 |
C.嫦娥五号上使用的碳纤维属于新型有机高分子材料,国产飞机 用到的氮化硅陶瓷属于新型无机非金属材料 用到的氮化硅陶瓷属于新型无机非金属材料 |
| D.高纤维食物是富含膳食纤维的食物,在人体内都可以通过水解反应提供能量 |
您最近一年使用:0次
2022-01-23更新
|
477次组卷
|
3卷引用:湖南省岳阳市2021-2022学年高三上学期质量监测化学试题
湖南省岳阳市2021-2022学年高三上学期质量监测化学试题(已下线)专项01 化学与STSE-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)黑龙江省佳木斯市第一中学2022届高三下学期验收测试化学试题



