名校
解题方法
1 . 下列图示实验正确的是
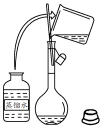 |  |
| A.洗涤烧杯并将洗涤液转入容量瓶 | B.实验室快速制备 |
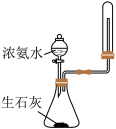
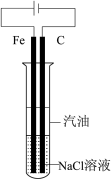 |  |
C.制备并观察 的颜色 的颜色 | D.证明溶解度: |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱 。用电离方程式表示
。用电离方程式表示 显碱性的原因
显碱性的原因_______ 。
(2)亚硝酸的电离平衡常数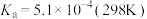 。它的性质和硝酸很类似。
。它的性质和硝酸很类似。
①已知 时,
时, 的
的 ;
; 。向含有
。向含有 碳酸钠的溶液中加入
碳酸钠的溶液中加入 的
的 后,则溶液中
后,则溶液中 、
、 和
和 的离子浓度由大到小是
的离子浓度由大到小是_______ 。
②将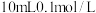 的亚硝酸溶液加入到
的亚硝酸溶液加入到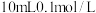 氨水(已知在25℃时,一水合氨的
氨水(已知在25℃时,一水合氨的 )中,最后所得溶液为
)中,最后所得溶液为_______ (填“酸性”、“碱性”或者“中性”)。
(3) 气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在
气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在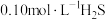 溶液中,通入
溶液中,通入 气体或加入
气体或加入 固体以调节溶液
固体以调节溶液 ,溶液
,溶液 与
与 关系如图所示(忽略溶液体积的变化、
关系如图所示(忽略溶液体积的变化、 的挥发)。
的挥发)。
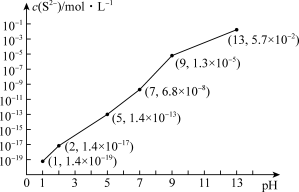
① 时,溶液中的
时,溶液中的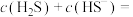
_______  ;
;
②某溶液含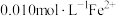 和
和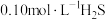 ,当溶液
,当溶液
_______ 时, 开始沉淀。[已知:
开始沉淀。[已知: ]
]
(4) 可用作处理含
可用作处理含 的污水的沉淀剂,已知25℃时,反应
的污水的沉淀剂,已知25℃时,反应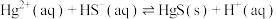 的平衡常数
的平衡常数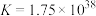 ,
, 的电离平衡常数
的电离平衡常数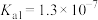 ,
,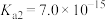 ,则
,则
_______ 。
(1)航天领域中常用
 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱 。用电离方程式表示
。用电离方程式表示 显碱性的原因
显碱性的原因(2)亚硝酸的电离平衡常数
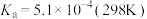 。它的性质和硝酸很类似。
。它的性质和硝酸很类似。①已知
 时,
时, 的
的 ;
; 。向含有
。向含有 碳酸钠的溶液中加入
碳酸钠的溶液中加入 的
的 后,则溶液中
后,则溶液中 、
、 和
和 的离子浓度由大到小是
的离子浓度由大到小是②将
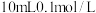 的亚硝酸溶液加入到
的亚硝酸溶液加入到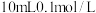 氨水(已知在25℃时,一水合氨的
氨水(已知在25℃时,一水合氨的 )中,最后所得溶液为
)中,最后所得溶液为(3)
 气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在
气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在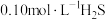 溶液中,通入
溶液中,通入 气体或加入
气体或加入 固体以调节溶液
固体以调节溶液 ,溶液
,溶液 与
与 关系如图所示(忽略溶液体积的变化、
关系如图所示(忽略溶液体积的变化、 的挥发)。
的挥发)。
①
 时,溶液中的
时,溶液中的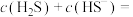
 ;
;②某溶液含
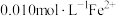 和
和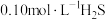 ,当溶液
,当溶液
 开始沉淀。[已知:
开始沉淀。[已知: ]
](4)
 可用作处理含
可用作处理含 的污水的沉淀剂,已知25℃时,反应
的污水的沉淀剂,已知25℃时,反应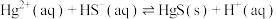 的平衡常数
的平衡常数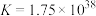 ,
, 的电离平衡常数
的电离平衡常数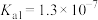 ,
,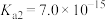 ,则
,则
您最近一年使用:0次
2022-12-12更新
|
133次组卷
|
2卷引用:湖南省岳阳教研联盟2022-2023学年高二上学期期中联考化学试题
名校
3 . 硫酸镍一般用于电镀印染媒染剂、金属着色剂等。电镀污泥中主要含有 、
、 、
、 、
、 、
、 和
和 等化合物。一种从电镀污泥中回收金属铜和制备硫酸镍的工艺流程如图1,回答下列问题:
等化合物。一种从电镀污泥中回收金属铜和制备硫酸镍的工艺流程如图1,回答下列问题:

已知:①焙烧时 和
和 ,分别转化为
,分别转化为 、
、 。
。
②几种金属离子开始沉淀和沉淀完全的 如表:
如表:
(1)镍具有优良的物理和化学特性。羰基法提纯粗镍涉及反应:
 。已知
。已知 (忽略
(忽略 、
、 随温度的变化),当
随温度的变化),当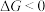 时,反应可以自发进行。若要提高反应中
时,反应可以自发进行。若要提高反应中 的产率且使反应自发进行,采取的反应条件为_______。
的产率且使反应自发进行,采取的反应条件为_______。
(2)“焙烧”时, 参与反应的化学方程式为
参与反应的化学方程式为_______ 。
(3)“滤液”的主要成分是含有少量重金属阳离子的 溶液,除杂装置如图2所示,
溶液,除杂装置如图2所示,
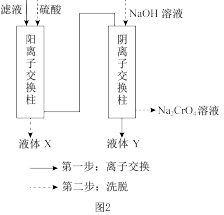
离子交换柱原理为: ;
;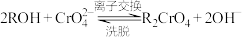
液体X的溶质主要是_______ (填化学式),液体Y是_______ (填名称)。
(4)“沉铁”时_______ (填“能”或“不能”)一并除去含铝杂质,理由是_______ 。
(5)下列金属的冶炼原理与本工艺流程中制Cu的方法相似的是_______(填标号)。
 、
、 、
、 、
、 、
、 和
和 等化合物。一种从电镀污泥中回收金属铜和制备硫酸镍的工艺流程如图1,回答下列问题:
等化合物。一种从电镀污泥中回收金属铜和制备硫酸镍的工艺流程如图1,回答下列问题:
已知:①焙烧时
 和
和 ,分别转化为
,分别转化为 、
、 。
。②几种金属离子开始沉淀和沉淀完全的
 如表:
如表:| 金属离子 |  |  |  |  |
开始沉淀的 | 1.1 | 4.1 | 6.7 | 4.2 |
完全沉淀的 | 3.2 | 5.4 | 9.5 | 6.7 |

 。已知
。已知 (忽略
(忽略 、
、 随温度的变化),当
随温度的变化),当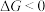 时,反应可以自发进行。若要提高反应中
时,反应可以自发进行。若要提高反应中 的产率且使反应自发进行,采取的反应条件为_______。
的产率且使反应自发进行,采取的反应条件为_______。| A.高温高压 | B.低温高压 | C.低温低压 | D.高温低压 |
 参与反应的化学方程式为
参与反应的化学方程式为(3)“滤液”的主要成分是含有少量重金属阳离子的
 溶液,除杂装置如图2所示,
溶液,除杂装置如图2所示,
离子交换柱原理为:
 ;
;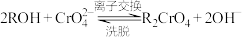
液体X的溶质主要是
(4)“沉铁”时
(5)下列金属的冶炼原理与本工艺流程中制Cu的方法相似的是_______(填标号)。
| A.加热氧化银制银 | B.四氯化钛中加镁冶炼钛 |
| C.焙烧辰砂(HgS)制汞 | D.电解硫酸锰制锰 |
您最近一年使用:0次
2022-12-12更新
|
123次组卷
|
2卷引用:湖南省岳阳教研联盟2022-2023学年高二上学期期中联考化学试题
名校
4 . 下列实验方案能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
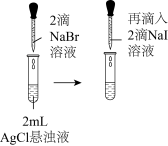
| A | 证明 沉淀可以转化为 沉淀可以转化为 沉淀 沉淀 | 向 溶液中先加入3滴 溶液中先加入3滴 溶液,再加入3滴 溶液,再加入3滴 溶液 溶液 |
| B | 测定中和反应的反应热 | 酸碱中和滴定的同时,用温度传感器采集锥形瓶内溶液的温度 |
| C | 测定未知浓度的NaOH溶液 | 用甲基橙作指示剂,标准盐酸溶液滴定NaOH溶液时,当溶液颜色由黄色变为橙色,且半分钟内不视色即为滴定终点 |
| D | 验证可溶性MR为强酸强碱盐 | 25℃,测得可溶性正盐MR的 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-12-06更新
|
263次组卷
|
4卷引用:湖南省岳阳县第一中学2022-2023学年高二下学期开学考试化学试题
5 . 锰酸锂( )是锂电池的正极材料。以软锰矿粉(主要成分是
)是锂电池的正极材料。以软锰矿粉(主要成分是 ,含少量
,含少量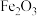 、
、 、
、 、CaO、MgO等)为原料制备锰酸锂的流程如下:
、CaO、MgO等)为原料制备锰酸锂的流程如下:
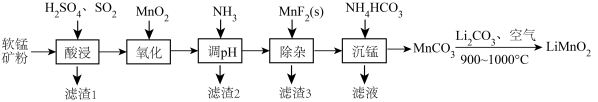
常温下,几种难溶物质的溶度积数据如下表:
请回答下列问题:
(1)“酸浸”时,常在高压下充入 ,使用高压条件的目的是
,使用高压条件的目的是_______ 。
(2)滤渣1的主要成分是_______ 。
(3)“氧化”时发生反应的离子方程式为_______ 。
(4)“调pH”后取1.0L滤液,测得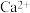 浓度为0.02mol/L,
浓度为0.02mol/L,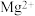 浓度为0.01mol/L,则至少需加入
浓度为0.01mol/L,则至少需加入_______ g,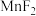 才能使废液中
才能使废液中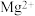 沉淀完全(当离子浓度
沉淀完全(当离子浓度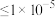 mol/L-1,可认为沉淀完全)。(保留两位小数)
mol/L-1,可认为沉淀完全)。(保留两位小数)
(5)写出由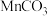 制备
制备 的化学方程式
的化学方程式_______ 。
(6)镍钴锰酸锂是锂电池的关键三元正极材料,化学式为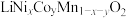 。
。
①基态Ni原子的价电子排布式为_______ 。
②锰和铁处于同一周期,锰、铁电离能数据如表所示:
请解释I3(Mn)>I3(Fe)的主要原因:_______ 。
 )是锂电池的正极材料。以软锰矿粉(主要成分是
)是锂电池的正极材料。以软锰矿粉(主要成分是 ,含少量
,含少量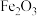 、
、 、
、 、CaO、MgO等)为原料制备锰酸锂的流程如下:
、CaO、MgO等)为原料制备锰酸锂的流程如下:
常温下,几种难溶物质的溶度积数据如下表:
| 物质 | 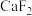 | 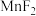 | 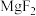 |  |  |  |
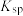 | 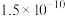 | 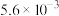 | 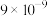 | 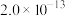 | 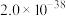 | 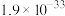 |
(1)“酸浸”时,常在高压下充入
 ,使用高压条件的目的是
,使用高压条件的目的是(2)滤渣1的主要成分是
(3)“氧化”时发生反应的离子方程式为
(4)“调pH”后取1.0L滤液,测得
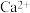 浓度为0.02mol/L,
浓度为0.02mol/L,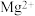 浓度为0.01mol/L,则至少需加入
浓度为0.01mol/L,则至少需加入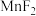 才能使废液中
才能使废液中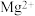 沉淀完全(当离子浓度
沉淀完全(当离子浓度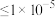 mol/L-1,可认为沉淀完全)。(保留两位小数)
mol/L-1,可认为沉淀完全)。(保留两位小数)(5)写出由
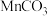 制备
制备 的化学方程式
的化学方程式(6)镍钴锰酸锂是锂电池的关键三元正极材料,化学式为
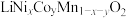 。
。①基态Ni原子的价电子排布式为
②锰和铁处于同一周期,锰、铁电离能数据如表所示:
| 元素 | I1/(kJ·mol-1) | I2/(kJ·mol-1) | I3/(kJ·mol-1) |
| Mn | 717.3 | 1509.9 | 3248 |
| Fe | 762.5 | 1561.9 | 2953 |
您最近一年使用:0次
解题方法
6 . 2019年诺贝尔化学奖颁给了日本化学家吉野彰等三人,以表彰他们对锂离子电池研发的卓越贡献。工业中利用锂辉石(主要成分为LiAl(SiO3)2,还含有Fe2O3、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如下:
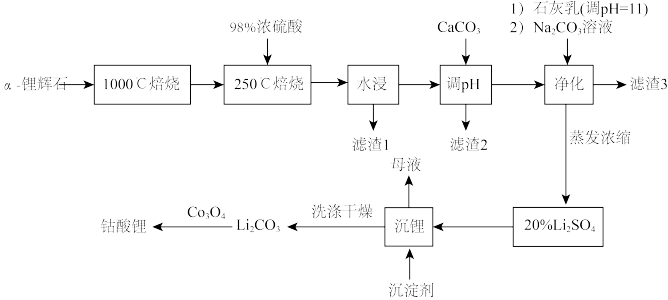
已知:
①α-锂辉石化学惰性较大,除HF外,几乎不与任何酸碱反应,α—锂辉石在高温下可转化为β-锂辉石,β—锂辉石具有更高的化学活性;
②β-锂辉石可与浓硫酸发生反应:2β-LiAl(SiO3)2 + H2SO4→Li2SO4 +Al2O3·4SiO2·H2O;
③部分金属氢氧化物pKsp(pKsp=—lgKsp)的柱状图。

回答下列问题:
(1)1000℃焙烧α—锂辉石的目的为_______ ;锂辉石的主要成分为LiAl(SiO3)2,其氧化物的形式为_______ 。
(2)向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为_______ (保留小数点后一位有效数字,已知:完全沉淀后离子浓度低于1×l0-5mol/L);“滤渣3”的主要成分为 _______ 。
(3)“沉锂”过程中加入的沉淀剂为饱和的Na2CO3溶液,判断该过程中所获得的沉淀是否洗涤干净的操作为:_______ 。
(4)Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为_______ 。
(5)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池总反应为LiCoO2+C6 LixC6 + Li1-xCoO2,充电时,阳极发生的电极反应为:
LixC6 + Li1-xCoO2,充电时,阳极发生的电极反应为:_______ 。

已知:
①α-锂辉石化学惰性较大,除HF外,几乎不与任何酸碱反应,α—锂辉石在高温下可转化为β-锂辉石,β—锂辉石具有更高的化学活性;
②β-锂辉石可与浓硫酸发生反应:2β-LiAl(SiO3)2 + H2SO4→Li2SO4 +Al2O3·4SiO2·H2O;
③部分金属氢氧化物pKsp(pKsp=—lgKsp)的柱状图。

回答下列问题:
(1)1000℃焙烧α—锂辉石的目的为
(2)向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为
(3)“沉锂”过程中加入的沉淀剂为饱和的Na2CO3溶液,判断该过程中所获得的沉淀是否洗涤干净的操作为:
(4)Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为
(5)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池总反应为LiCoO2+C6
 LixC6 + Li1-xCoO2,充电时,阳极发生的电极反应为:
LixC6 + Li1-xCoO2,充电时,阳极发生的电极反应为:
您最近一年使用:0次
7 . 物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡,请根据所学知识回答:
(1)某温度下,纯水中的c(H+)=1.5×10-7,则纯水中的
_______ mol/L,该温度时的水的离子积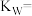
_______ 。保持温度不变,滴入稀盐酸使溶液中的 ,则溶液中的
,则溶液中的 为
为_______  。
。
(2)常温中,一定浓度的CH3COONa溶液的pH=8,已知CH3COOH的电离平衡常数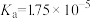 ,则该CH3COONa溶液中:
,则该CH3COONa溶液中: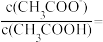
_______ 。
(3)甲酸钠(HCOONa)溶液呈碱性的原因是_______ (用离子方程式表示)。0.02mol/L的HCOONa溶液中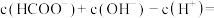
_______ mol/L。
(4)25℃,在0.10mol•L1硫酸铜溶液中加入氢氧化钠稀溶液充分反应,有蓝色氢氧化铜沉淀生成,当溶液的pH=9时,c(Cu2+)=_______ molL1(Ksp[Cu(OH)2]=2.2×1020)。
(1)某温度下,纯水中的c(H+)=1.5×10-7,则纯水中的

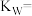
 ,则溶液中的
,则溶液中的 为
为 。
。(2)常温中,一定浓度的CH3COONa溶液的pH=8,已知CH3COOH的电离平衡常数
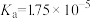 ,则该CH3COONa溶液中:
,则该CH3COONa溶液中: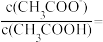
(3)甲酸钠(HCOONa)溶液呈碱性的原因是
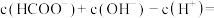
(4)25℃,在0.10mol•L1硫酸铜溶液中加入氢氧化钠稀溶液充分反应,有蓝色氢氧化铜沉淀生成,当溶液的pH=9时,c(Cu2+)=
您最近一年使用:0次
2022-09-14更新
|
308次组卷
|
2卷引用:湖南省岳阳市华容县2021-2022学年高二上学期期末教学质量监测化学试题
8 . 下列实验事实不能用平衡移动原理解释的是
| A.利用TiCl4水解制备TiO2时,需加入大量水并加热 |
| B.将氯化铝溶液加热蒸干并灼烧,最终得到氧化铝固体 |
C.对2HI(g) H2(g)+I2(g),减小容器体积,气体颜色变深 H2(g)+I2(g),减小容器体积,气体颜色变深 |
| D.水垢中含有CaSO4,可先用Na2CO3溶液浸泡处理,而后用盐酸去除 |
您最近一年使用:0次
名校
解题方法
9 . 钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:

已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9。
下列说法错误的是

已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9。
下列说法错误的是
| A.BaTiO3中Ti元素的化合价为+4 |
| B.在“酸浸”过程中为加快反应速率可用浓硫酸代替浓盐酸 |
| C.流程中可以通过分液得到草酸氧化钛钡晶体 |
D.若浸出液中c(Ba2+)=0.1 mol/L,则c(CO )在浸出液中的最大浓度为2.58×10-8 mol/L )在浸出液中的最大浓度为2.58×10-8 mol/L |
您最近一年使用:0次
名校
解题方法
10 . 下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将NaOH溶液逐滴滴加到 溶液中至过量 溶液中至过量 | 先产生白色胶状沉淀,后沉淀溶解 |  是两性氢氧化物 是两性氢氧化物 |
| B | 测定等浓度的 和 和 的溶液的pH 的溶液的pH | 前者pH比后者大 | 非金属性:S>C |
| C | 向2.0mL浓度均为 的KCl、KI混合溶液中滴加1~2滴 的KCl、KI混合溶液中滴加1~2滴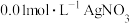 溶液,振荡 溶液,振荡 | 沉淀呈黄色 |  |
| D | 分别向两支盛有 醋酸和 醋酸和 饱和硼酸溶液的试管中滴加等浓度 饱和硼酸溶液的试管中滴加等浓度 溶液 溶液 | 前者产生无色气泡,后者无明显现象 | 酸性:醋酸>碳酸>硼酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-08-16更新
|
211次组卷
|
3卷引用:湖南省岳阳市岳阳县第一中学2023-2024学年高三下学期3月月考化学试题



