名校
解题方法
1 . 任何物质的水溶液都存在水的电离平衡。下表是不同温度下水的离子积数据:
完成下列填空:
(1)25℃时,向100mL纯水中加入0.01mol的NH4Cl固体,___ (选填“促进”或“抑制”)了水的电离平衡,所得溶液呈___ 性(选填“酸”、“碱”或“中”),原因是(用离子反应方程式表示)__ 。
(2)若25<t1<t2,则a___ 1×10-14(选填“>”、“<”或“=”),理由是___ 。
(3)t1℃时,测得纯水的c(H+)=2.4×10-7mol/L,则c(OH-)=__ mol/L;该温度下某盐酸溶液的c(Cl-)=0.01mol/L,该溶液的c(OH-)=___ mol/L。
(4)t2℃时,0.01mol/L的NaOH溶液的pH=___ 。
| 温度(℃) | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
完成下列填空:
(1)25℃时,向100mL纯水中加入0.01mol的NH4Cl固体,
(2)若25<t1<t2,则a
(3)t1℃时,测得纯水的c(H+)=2.4×10-7mol/L,则c(OH-)=
(4)t2℃时,0.01mol/L的NaOH溶液的pH=
您最近一年使用:0次
名校
解题方法
2 . T℃时,向 pH = 6.5 的纯水中加入 NaHSO4晶体,保持温度不变,测得溶液的 pH = 2。下列叙述中不正确的是
| A.纯水中加入NaHSO4晶体,水的电离程度增大 | B.水电离出的 c(H+) = 1×10-11 mol·L-1 |
| C.此时水的离子积 Kw = 1×10-13 | D.溶液中 c(Na+) = c( ) ) |
您最近一年使用:0次
2020-10-27更新
|
269次组卷
|
3卷引用:内蒙古包头市第四中学2020-2021学年高二上学期期中考试化学试题
2010·福建泉州·一模
名校
3 . 一定温度下,用水稀释0.1mol/L的一元弱酸HA,随着稀释的进行,下列数值一定增大的是(KW表示水的离子积)( )
| A.KW | B.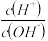 | C. | D.c(OH-) |
您最近一年使用:0次
2020-09-14更新
|
633次组卷
|
14卷引用:内蒙古呼和浩特市土默特左旗第一中学2019-2020学年高二上学期第二次月考化学试题
内蒙古呼和浩特市土默特左旗第一中学2019-2020学年高二上学期第二次月考化学试题(已下线)福建省泉州市2010年高中毕业班五月质量检测理综化学部分四川省成都市实验中学2017-2018学年高二上学期期中考试化学试题【全国百强校】福建省三明市第一中学2018-2019学年高二上学期第二次月考化学试题山西省实验中学2020届高三化学复习针对性试题集(三)鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第1节 水与水溶液 课时2 溶液的酸碱性与pH高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 课时1 水的电离 溶液的酸碱性与pH(已下线)练习6 电离平衡与溶液的PH-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)黑龙江省大庆市大庆铁人中学2021-2022学年高二上学期第一次月考化学试题吉林省长春北师大附属学校2021-2022学年高二上学期第一次月考化学试题吉林省吉林市第五十五中学2021-2022学年高二上学期期中考试化学试题新疆和田地区皮山县高级中学2021-2022学年高二上学期期末考试化学试题天津市第二十一中学2022-2023学年高二上学期期中调研化学试题上海市建平世纪中学2023-2024学年高二上学期阶段练习二 化学(等级)试题
2020高三·全国·专题练习
名校
解题方法
4 . 常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.能使石蕊显红色的溶液:K+、Mg2+、HCO 、SO 、SO |
B.水电离出来的c(H+)=10-13mol·L-1的溶液:NH 、Fe2+、NO 、Fe2+、NO 、Cl- 、Cl- |
C. =1012的溶液:K+、Fe3+、Cl-、SO =1012的溶液:K+、Fe3+、Cl-、SO |
D.加入铝片能放出H2的溶液:Na+、CH3COO-、Cu2+、SO |
您最近一年使用:0次
2020-08-15更新
|
332次组卷
|
5卷引用:内蒙古包头市第一中学2020-2021学年高二上学期期中考试化学试题
内蒙古包头市第一中学2020-2021学年高二上学期期中考试化学试题(已下线)第07讲 离子共存 离子的检验和推断(精练)——2021年高考化学一轮复习讲练测甘肃省武威第六中学2021届高三上学期第二次过关考试化学试题湖南省岳阳市华容县第一中学2021-2022学年高三下学期期中考试化学试题安徽省肥东县圣泉中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
5 . 室温下,已知某溶液中由水电离生成的H+和OH-的物质的量浓度的乘积为10-24mol2·L-2,则在该溶液中,一定不能大量存在的离子是( )
A.SO | B.NH | C.NO | D.HCO |
您最近一年使用:0次
2020-08-15更新
|
200次组卷
|
6卷引用:内蒙古北京八中乌兰察布分校2019-2020学年高二下学期期末考试化学试题
内蒙古北京八中乌兰察布分校2019-2020学年高二下学期期末考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 盐类水解的应用(提升练习)黑龙江省伊春市伊美区第二中学2019-2020学年高二上学期第一次月考化学试题(已下线)练习9 水的电离和溶液的酸碱性-2020-2021学年【补习教材·寒假作业】高二化学(人教版)(已下线)3.2.1 水的电离 溶液的酸碱性(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)云南省曲靖市宣威市第七中学2021-2022学年高二下学期2月考试化学试题
名校
解题方法
6 . 回答下列问题:
(1)某温度(t℃)时,水的电离图象如下图所示,a点水的离子积Kw=_____ 该温度下,pH=11的NaOH溶液与pH=2的H2SO4溶液等体积混合,溶液显_____ (填“酸”或“碱”)性。

(2)25℃时,向0.1mol•L-1的氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH_____ (填“增大”“减小”或“不变”,下同), 的物质的量浓度
的物质的量浓度_____
(3)将体积相等的NaOH稀溶液和CH3COOH溶液混合,若溶液中c(Na+)=c(CH3COO-),则该溶液显_____ (填“酸性”“碱性”或“中性”),则混合前c(NaOH)_____ (填“>”“<”或“=”)c(CH3COOH)
(4)常温下,Ksp[Fe(OH)3]=1×10-38,要使溶液中的Fe3+沉淀完全[残留在溶液中的c(Fe3+)<10-5mol•L-1],则溶液的pH应大于_____
(5)用可溶性碳酸盐,可以浸取CaSO4固体,在溶液浸取过程中会发生反应:CaSO4(s)+ (ag)⇌CaCO3(s)+
(ag)⇌CaCO3(s)+ (aq)。已知:298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为
(aq)。已知:298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为_____ (计算结果保留三位有效数字)。
(1)某温度(t℃)时,水的电离图象如下图所示,a点水的离子积Kw=

(2)25℃时,向0.1mol•L-1的氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH
 的物质的量浓度
的物质的量浓度(3)将体积相等的NaOH稀溶液和CH3COOH溶液混合,若溶液中c(Na+)=c(CH3COO-),则该溶液显
(4)常温下,Ksp[Fe(OH)3]=1×10-38,要使溶液中的Fe3+沉淀完全[残留在溶液中的c(Fe3+)<10-5mol•L-1],则溶液的pH应大于
(5)用可溶性碳酸盐,可以浸取CaSO4固体,在溶液浸取过程中会发生反应:CaSO4(s)+
 (ag)⇌CaCO3(s)+
(ag)⇌CaCO3(s)+ (aq)。已知:298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为
(aq)。已知:298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为
您最近一年使用:0次
2020-07-11更新
|
185次组卷
|
4卷引用:内蒙古兴安盟乌兰浩特市第一中学2022-2023学年高二上学期期中考试化学试题
内蒙古兴安盟乌兰浩特市第一中学2022-2023学年高二上学期期中考试化学试题河北省石家庄市元氏县第四中学2019-2020学年高二上学期期末考试化学试题(已下线)第19讲 水的电离和溶液的酸碱性-2021年高考化学一轮复习名师精讲练湖北省黄冈市麻城市第二中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
7 . 常温下,向1 mol·L-1NH4C1溶液中加入足量的镁条,该体系pH随时间变化的曲线如图所示。实验观察到b点开始溶液中有白色沉淀生成。下列说法错误的是(已知Ksp[Mg(OH)2]=1.8×10-11)
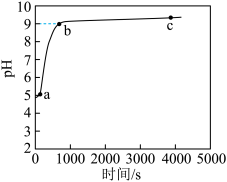

| A.a点溶液中,c(NH4+)+c(H+)<c(C1-)+c(OH-) |
| B.b点时,溶液中c(Mg2+)=0.18 mol·L-1 |
| C.体系中,水的电离程度大小关系为a>c>b |
| D.常温下,NH4C1的水解平衡常数数量级为10-10 |
您最近一年使用:0次
2020-06-28更新
|
453次组卷
|
9卷引用:内蒙古赤峰二中2020-2021学年高二上学期第二次月考化学试题
解题方法
8 . 下列有关说法正确的是
| A.锌与稀硫酸反应时加入少量硫酸铜,反应加快的原因是Cu2+水解增大了H+浓度 |
| B.增大醋酸溶液的浓度,溶液中c(OH-)减小的原因是水的离子积Kw 减小 |
| C.pH=3的盐酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为强碱 |
| D.TATP(C8H18O6)受撞击分解爆炸,且无明显热效应,说明该分解反应熵显著增加 |
您最近一年使用:0次
名校
解题方法
9 . 1909年,丹麦生理学家索仑生提出用pH表示水溶液的酸度:pH=-lg[H+],后来又定义pOH=-lg[OH-],pKW=-lgKW。对某水溶液的下列说法中错误的是
| A.pH+pOH=pKW | B.若为酸性溶液则pH>pOH |
| C.常温下pH+pOH=14 | D.溶液pH=7时未必呈中性 |
您最近一年使用:0次
2020-04-11更新
|
204次组卷
|
3卷引用:内蒙古赤峰市2019-2020学年高二下学期期末联考化学(A卷)试题
10 . 升高温度,下列数据不一定增大的是
| A.化学反应速率v | B.水的离子积常数KW |
| C.化学平衡常数K | D.醋酸钠的水解平衡常数Kb |
您最近一年使用:0次
2020-03-04更新
|
122次组卷
|
3卷引用:内蒙古自治区奈曼旗第一中学2020-2021学年高二上学期期中考试化学试题



