解题方法
1 . 磷酸亚铁锂( )电池是新能源汽车的动力电池之一,工作原理为LiFePO4+C=LixC+Li1-xFePO4。回答下列问题:
)电池是新能源汽车的动力电池之一,工作原理为LiFePO4+C=LixC+Li1-xFePO4。回答下列问题:
(1)下列关于Li原子电子排布图表示的状态中,能量最高的为___ (填标号)。
a.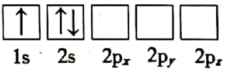
b.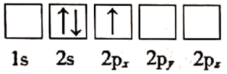
c.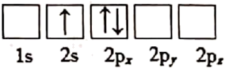
d.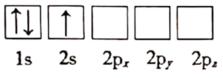
(2)LiFePO4中PO 的空间构型为
的空间构型为___ ,与其互为等电子体的分子有___ (填一种即可)。
(3)卤素与磷可形成多种磷化物PF3、PCl3、PBr3、PI3,则他们的熔点由高到低的顺序为___ ,键角由小到大的顺序为___ 。
(4)在元素周期表中,氮元素分别与磷、氧相邻,在N、O、P中,第一电离能最大的是___ (填元素符号),判断依据是___ 。
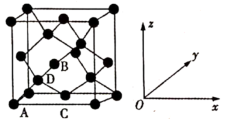
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,如图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为(0.5,0,0.5);C为(0.5,0.5,0)。则D原子的坐标参数为__ 。
②晶胞参数,描述晶胞的大小和形状,已知金刚石的晶胞参数a=xnm,其密度为__ g∙cm−3(用含x的式子表示)。
 )电池是新能源汽车的动力电池之一,工作原理为LiFePO4+C=LixC+Li1-xFePO4。回答下列问题:
)电池是新能源汽车的动力电池之一,工作原理为LiFePO4+C=LixC+Li1-xFePO4。回答下列问题:(1)下列关于Li原子电子排布图表示的状态中,能量最高的为
a.

b.

c.

d.

(2)LiFePO4中PO
 的空间构型为
的空间构型为(3)卤素与磷可形成多种磷化物PF3、PCl3、PBr3、PI3,则他们的熔点由高到低的顺序为
(4)在元素周期表中,氮元素分别与磷、氧相邻,在N、O、P中,第一电离能最大的是

(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,如图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为(0.5,0,0.5);C为(0.5,0.5,0)。则D原子的坐标参数为
②晶胞参数,描述晶胞的大小和形状,已知金刚石的晶胞参数a=xnm,其密度为
您最近一年使用:0次
名校
解题方法
2 . 金属元素及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)锰元素在周期表中的位置是___ ,基态锰原子的最外层电子排布式为___ 。
(2)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220℃。Cr(CO)6的晶体类型是___ ,Cr(CO)6中σ键与π键的个数比为___ 。
(3)[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是___ 。
(4)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用∆表示),它与中心离子的结构、电荷、配体有关。试判断分裂能△[Fe(H2O)6]2+__ △[Fe(H2O)6]3+(填<”或“=”),理由___ 。
(5)已知Pb(CH2CH3)4晶体的堆积方式如图。
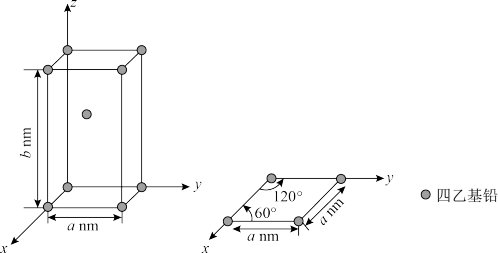
Pb(CH2CH3)4在晶体结构中的配位数是___ 。设阿伏加德罗常数为NAmol-1,Pb(CH2CH3)4的摩尔质量为Mg/mol,则Pb(CH2CH3)4晶体的密度是___ g/cm3(列出计算式即可)。
(1)锰元素在周期表中的位置是
(2)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220℃。Cr(CO)6的晶体类型是
(3)[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是
(4)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用∆表示),它与中心离子的结构、电荷、配体有关。试判断分裂能△[Fe(H2O)6]2+
(5)已知Pb(CH2CH3)4晶体的堆积方式如图。

Pb(CH2CH3)4在晶体结构中的配位数是
您最近一年使用:0次
2021-05-05更新
|
355次组卷
|
3卷引用:黑龙江省哈尔滨市第九中学2021届高三第二次模拟考试理科综合化学试题
名校
3 . “中国芯”的主要原材料是高纯单晶硅,反应 ,可用于纯硅的制备。下列有关说法正确的是
,可用于纯硅的制备。下列有关说法正确的是
 ,可用于纯硅的制备。下列有关说法正确的是
,可用于纯硅的制备。下列有关说法正确的是A. 中有非极性共价键 中有非极性共价键 |
B.HCl的电子式为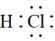 |
| C.碳的非金属性比硅强,所以自然界存在大量的硅单质 |
D.Si原子的结构示意图为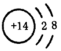 |
您最近一年使用:0次
2021-05-02更新
|
286次组卷
|
2卷引用:河南省洛阳市2020-2021学年高一下学期期中考试化学试题
4 . 秦兵马俑展现了我国古代科技文化的伟大成就。近年来人们研究发现秦俑彩绘所用的原料的主要成分为BaCuSi2O6,含有微量硫元素等。回答下列问题:
(1)原子轨道是指电子在原子核外的___________ 。Cu原子核外电子占据最高能级的符号是___________ ,Cu原子核外最外层电子的电子云轮廓图形状为___________ 。
(2)硫化硅为白色晶体,分子式为SiS2,遇水分解为SiO2及H2S气体,分解反应中所涉及的
所有元素的电负性由大到小的顺序为___________ (填元素符号);SiS2的结构与CS2类似,则SiS2分子的空间构型为___________ 。
(3)一种含Cu、S元素的有机物的结构简式如图1所示,该有机物中存在的作用力类型有_______ (填标号),N原子的杂化方式为___________ 。
a.极性键 b.离子键 c.非极性键 d.配位键 e.金属键

(4)TiO2与BaCO3一起熔融可制得钛酸钡(BaTiO3),晶胞结构如图2所示(O2−均与Ti4+、Ba2+相接触),已知O2−的半径为xpm,晶胞边长为ypm,则Ti4+、Ba2+的半径分别为___________ pm、_____ pm。
(1)原子轨道是指电子在原子核外的
(2)硫化硅为白色晶体,分子式为SiS2,遇水分解为SiO2及H2S气体,分解反应中所涉及的
所有元素的电负性由大到小的顺序为
(3)一种含Cu、S元素的有机物的结构简式如图1所示,该有机物中存在的作用力类型有
a.极性键 b.离子键 c.非极性键 d.配位键 e.金属键

(4)TiO2与BaCO3一起熔融可制得钛酸钡(BaTiO3),晶胞结构如图2所示(O2−均与Ti4+、Ba2+相接触),已知O2−的半径为xpm,晶胞边长为ypm,则Ti4+、Ba2+的半径分别为
您最近一年使用:0次
5 . 磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1)基态砷原子的核外子排布式为_______ 。
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为_______ ,电负性由大到小的顺序为_______ 。
(3)AsCl3分子的立体构型为_______ ,其中As的杂化轨道类型为_______ 。
(4)H2O与H2S为同族元素的氢化物,H2O可以形成H9O 或H3O+,而H2S几乎不能形成类似的H9S
或H3O+,而H2S几乎不能形成类似的H9S 或H3S+,其原因是
或H3S+,其原因是_______ 。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2 000 ℃,其晶胞结构如图所示。
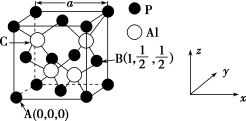
①磷化铝的晶体类型为_______ 。
②A、B点的原子坐标如图所示,则C点的原子坐标为_______ 。
③磷化铝的晶胞参数a=546.35 pm,其密度为_______ g·cm-3(列出计算式即可,用NA表示阿伏加德罗常数的值)。
(1)基态砷原子的核外子排布式为
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为
(3)AsCl3分子的立体构型为
(4)H2O与H2S为同族元素的氢化物,H2O可以形成H9O
 或H3O+,而H2S几乎不能形成类似的H9S
或H3O+,而H2S几乎不能形成类似的H9S 或H3S+,其原因是
或H3S+,其原因是(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2 000 ℃,其晶胞结构如图所示。

①磷化铝的晶体类型为
②A、B点的原子坐标如图所示,则C点的原子坐标为
③磷化铝的晶胞参数a=546.35 pm,其密度为
您最近一年使用:0次
2021-04-22更新
|
395次组卷
|
3卷引用:山东省泰安第四中学2020-2021学年高二下学期期中考试化学试题
6 . 下列说法中不正确的是
| A.IBr分子中,Br为-1价 |
| B.某元素原子的价电子排布为nsn-2npn+1,该元素位于第4周期ⅦA族 |
| C.基态18O原子中有8种运动状态完全不同的电子 |
| D.2p3表示2p能级有三个轨道 |
您最近一年使用:0次
名校
解题方法
7 . 元素周期表有许多有趣的编排方式,有同学将短周期元素按照原子序数递增的顺序进行排列得到如图所示的“蜗牛”元素周期表。图中每个“·”代表一种元素,其中P代表氢元素(图中字母不表示元素符号)。下列说法正确的是


| A.离P点越远的元素原子半径越大 |
| B.X、Z两元素组成的化合物可用于净水 |
| C.可用金属单质之间的置换反应证明L、M、X三元素的金属性强弱 |
| D.Y与Z形成的化合物中,原子的最外层电子均达到8电子稳定结构 |
您最近一年使用:0次
解题方法
8 . 尿素的结构简式可表示为 ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是A. 尿素分子中含有 尿素分子中含有 键 键 |
B.尿素分子中四种元素的电负性: |
C.尿素分子中四种元素的第一电离能: |
D.根据结构推测:尿素易溶于水,其熔、沸点低于丙酮( ) ) |
您最近一年使用:0次
2021-04-09更新
|
682次组卷
|
4卷引用:辽宁省锦州市2021届高考第一次模拟(普通高中高三质量检测)化学试题
辽宁省锦州市2021届高考第一次模拟(普通高中高三质量检测)化学试题(已下线)押山东卷第04题 物质结构与性质选择题-备战2021年高考化学临考题号押题(山东卷)(已下线)基础卷02-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)湖南省邵阳市新邵县2021-2022学年高二下学期期末质量检测化学试题
名校
9 . 电子数相等的微粒叫等电子体,下列微粒组是等电子体的是
| A.N2O4和NO2 | B.Na+和Cl- | C. 和 和 | D.NO和O2 |
您最近一年使用:0次
2021-04-08更新
|
137次组卷
|
4卷引用:山东省郓城高级中学2020-2021学年高二下学期收心考试化学试题
名校
10 . 如图所示是元素周期表的一部分,表中所列字母分别代表一种元素。

试回答下列问题:
(1)以上元素中,属于d区元素的是_______ (填元素符号),元素k在周期表的位置是_______ 。
(2)画出c的核外电子排布图_______ ,这样排布遵循了构造原理、_______ 原理和_______ 规则。
(3)元素c的电负性_______ 元素g的电负性(填“>”、“=”、“<”),元素b、c、e的第一电离能由大到小的顺序是_______ (用元素符号表示);第三周期元素最高价氧化物对应的水化物中,酸性最强的是_______ (填化合物的化学式)。

试回答下列问题:
(1)以上元素中,属于d区元素的是
(2)画出c的核外电子排布图
(3)元素c的电负性
您最近一年使用:0次



