1 . 下表列出了7种短周期元素在元素周期表中的相对位置,其中元素①的最低负化合价的绝对值与其原子最外层电子数相等,元素⑤是地壳中含量最多的金属元素。
请用相应的化学用语回答下列问题:
(1)元素①在元素周期表中所处的位置是_______ 。
(2)上述7中元素中,非金属性最强的是______ (填元素符号);最高价氧化物对应水化物中,碱性最强的物质的化学式是_______ 。
(3)③、⑥、⑦三种元素形成的简单气态氢化物的稳定性由强到弱的顺序是________ 。
(4)元素④和⑤各自的最高价氧化物对应水化物相互间发生反应的离子方程式是_______________ 。
(5)化合物甲是元素②形成的最简单氢化物,甲的电子式是_______ 。在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是_______ 。
| ① | ② | ③ | |||
| ④ | ⑤ | ⑥ | ⑦ |
请用相应的化学用语回答下列问题:
(1)元素①在元素周期表中所处的位置是
(2)上述7中元素中,非金属性最强的是
(3)③、⑥、⑦三种元素形成的简单气态氢化物的稳定性由强到弱的顺序是
(4)元素④和⑤各自的最高价氧化物对应水化物相互间发生反应的离子方程式是
(5)化合物甲是元素②形成的最简单氢化物,甲的电子式是
您最近一年使用:0次
11-12高一下·河北邢台·阶段练习
名校
2 . 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等。请回答下列问题:
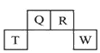
(1)T的原子结构示意图为______________________ 。
(2)元素的非金属性(原子的得电子能力):Q_______________ W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为__________________________________ 。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________________________________________________ 。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是______________ 。

(1)T的原子结构示意图为
(2)元素的非金属性(原子的得电子能力):Q
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是
您最近一年使用:0次
2016-12-09更新
|
241次组卷
|
10卷引用:江苏省泰州中学2016-2017学年高一5月月度检测化学试题
江苏省泰州中学2016-2017学年高一5月月度检测化学试题(已下线)2011-2012学年河北省邢台一中高一下学期第二次月考化学试卷2014-2015福建省福州市第八中学高一下学期期中化学试卷2015-2016学年海南琼海市嘉积中学高一下期中理科化学卷2016-2017学年河北省邯郸市大名县第一中学高一3月月考化学试卷2016-2017学年河南省林州市第一中学高一3月调研考试化学试卷江西省南昌市八一中学、洪都中学、麻丘中学、十七中、桑海中学2016-2017学年高一下学期期中考试化学试题山东省潍坊市临朐县实验中学2022届高三9月摸底考试化学试题四川省南充市白塔中学2021-2022学年高一下学期期中考试化学试题安徽省砀山县第四中学2021-2022学年高一下学期第一阶段教学质量检测 化学试题
3 . 下面是元素周期表的简略框架图。
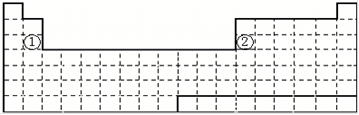
(1)请在元素周期表中画出金属元素与非金属元素的分界线______ 。按电子排布,可把元素划分成5个区,不全是金属元素的区为_______ 。
(2)表中元素①、②原子的最外层电子的电子排布式分别为_______ 、_______ ;比较元素①与元素②的下列性质(填写“>”或“<”)。
原子半径:①_______ ②、电负性:①_______ ②、金属性:①_______ ②。
(3)某短周期元素最高正价为+7,其原子结构示意图为_______ 。
(4)根据氢元素最高正价与最低负价的绝对值相等,你认为可把氢元素放在周期表中的_______ 族;有人建议将氢元素排在元素周期表的ⅦA族,请你写出支持这一观点的1个化学事实_______ 。

(1)请在元素周期表中画出金属元素与非金属元素的分界线
(2)表中元素①、②原子的最外层电子的电子排布式分别为
原子半径:①
(3)某短周期元素最高正价为+7,其原子结构示意图为
(4)根据氢元素最高正价与最低负价的绝对值相等,你认为可把氢元素放在周期表中的
您最近一年使用:0次
10-11高二下·江苏南通·期中
解题方法
4 . 下表是元素周期表的一部分,请回答下列问题:(用元素符号或对应化学式回答问题)
(1) ④⑤⑥的原子半径由大到小的顺序为______
(2) ②③⑦的最高价含氧酸的酸性由强到弱的顺序为______
(3) ⑦⑧⑨的第一电离能由小到大的顺序为______
(4)比较④和⑨的氢化物的稳定性大小______ ,沸点高低______
(5)写出元素⑩的+1价含氧酸的结构式______
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
(1) ④⑤⑥的原子半径由大到小的顺序为
(2) ②③⑦的最高价含氧酸的酸性由强到弱的顺序为
(3) ⑦⑧⑨的第一电离能由小到大的顺序为
(4)比较④和⑨的氢化物的稳定性大小
(5)写出元素⑩的+1价含氧酸的结构式
您最近一年使用:0次
9-10高二下·吉林·期中
5 . A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为: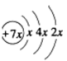 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A_________ B__________ C __________ D __________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________ ,碱性最强的是_________ 。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________ ,电负性最大的元素是__________ 。
(4)D的氢化物比C的氢化物的沸点__________ (填"高"或"低"),原因_____________
(5)E元素原子的核电荷数是__________ ,E元素在周期表的第_______ 周期,第________ 族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______ 区。
(6)A、B、C最高价氧化物的晶体类型是分别是______ 晶体、______ 晶体、_____ 晶体。
(7)画出D的核外电子排布图_____________________ ,这样排布遵循了_______ 规则。
(8)用电子式表示B的硫化物的形成过程:______________________________________
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:(1)写出下列元素的符号:A
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(4)D的氢化物比C的氢化物的沸点
(5)E元素原子的核电荷数是
(6)A、B、C最高价氧化物的晶体类型是分别是
(7)画出D的核外电子排布图
(8)用电子式表示B的硫化物的形成过程:
您最近一年使用:0次
11-12高二上·江苏淮安·期末
6 . 下图是元素周期表中的一部分。

在元素周期表中,同一周期(横行)中的元素,除0族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小,在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强。请回答:
(1)硅的相对原子质量为____ ;原子序数为8的元素位于元素周期表的第__ 周期,元素符号为___ ,它属于______ (填“金属”或“非金属”)元素。
(2)原子半径:钠__ 镁(填“>”或“=”或“<”,下同),原子得电子能力:硫__ 氯。

在元素周期表中,同一周期(横行)中的元素,除0族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小,在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强。请回答:
(1)硅的相对原子质量为
(2)原子半径:钠
您最近一年使用:0次



