1 . 下表列出了A~R九种元素在元素周期表中的位置:
(1)A的最高价氧化物对应水化物的电子式___________ ,核内有10个中子的F的核素表示为___________ ;H的最高价氧化物对应水化物的化学式___________ ,以上元素其中化学性质最不活泼的是___________ (填元素符号)。
(2)A、B、C三种元素按原子半径由大到小的顺序排列为___________ (用元素符号表示)。
(3)E、F元素最简单氢化物中稳定性最强的化学式是___________ ,该氢化物在常温下跟A发生反应的化学方程式是___________ 。
(4)D、B两种元素的最高价氧化物对应的水化物发生反应的离子方程式是___________ 。
(5)关于元素周期表、周期律,下列说法正确的是___________(填字号)
| 周期 | IA | IIA | IIIA | IV A | VA | VIA | VIIA | 0 | |
| 族 | |||||||||
| 2 | E | F | |||||||
| 3 | A | C | D | G | H | R | |||
| 4 | B |
(2)A、B、C三种元素按原子半径由大到小的顺序排列为
(3)E、F元素最简单氢化物中稳定性最强的化学式是
(4)D、B两种元素的最高价氧化物对应的水化物发生反应的离子方程式是
(5)关于元素周期表、周期律,下列说法正确的是___________(填字号)
| A.在金属和非金属分界处可以找到半导体材料 |
| B.在过渡元素中寻找制造催化剂和耐高温、耐腐蚀合金的元素 |
| C.通常农药所含有的元素位于元素周期表左下方区域 |
| D.稀有气体原子都满足8电子稳定结构 |
您最近一年使用:0次
2 . X、Y、Z、W、M、R、T七种短周期元素,周期表中位置如图:
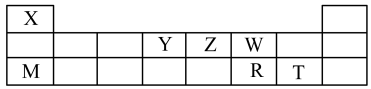
试回答下列问题:
(1)X、Z、W三种元素的原子半径由大到小的排列顺序是______ (用元素符号表示)。
(2)W的简单氢化物的电子式为_______ 。
(3)由X、Z、W三种元素可组成一种强酸,该强酸的稀溶液能与铜反应,则该反应的化学方程式为______ 。
(4)R、T两种元素简单氢化物的稳定性由强到弱的的顺序是______ (用化学式表示)。
(5)M和R最高价氧化物对应水化物反应的离子方程式为______ 。

试回答下列问题:
(1)X、Z、W三种元素的原子半径由大到小的排列顺序是
(2)W的简单氢化物的电子式为
(3)由X、Z、W三种元素可组成一种强酸,该强酸的稀溶液能与铜反应,则该反应的化学方程式为
(4)R、T两种元素简单氢化物的稳定性由强到弱的的顺序是
(5)M和R最高价氧化物对应水化物反应的离子方程式为
您最近一年使用:0次
名校
3 . 生活中处处有化学。请回答下列问题:
(1)苏打水是很多人喜爱的饮品,请写出小苏打在水中的电离方程式_______ 。
(2)“84消毒液”与洁厕灵(主要成分是浓盐酸)不能混用,混合会产生黄绿色的有毒气体,请用离子方程式解释原因_______ 。
(3)Na2O2常用作呼吸面罩供氧剂,请写出Na2O2的电子式_______ 。
(4)硅是太阳能电池板的主要原材料,请写出硅元素在周期表的位置_______ 。
(5)4gCO在氧气中燃烧生成CO2,放出9.6kJ热量,写出CO燃烧的热化学方程式_______ 。
(6)已知:①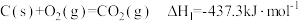
②H2(g)+1/2O2(g)=H2O(g) ∆H2=-285.8kJ·mol-1
③CO(g)+1/2O2(g)=CO2(g) ∆H3=-283.0kJ·mol-1
写出煤气化(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式_______ 。
(1)苏打水是很多人喜爱的饮品,请写出小苏打在水中的电离方程式
(2)“84消毒液”与洁厕灵(主要成分是浓盐酸)不能混用,混合会产生黄绿色的有毒气体,请用离子方程式解释原因
(3)Na2O2常用作呼吸面罩供氧剂,请写出Na2O2的电子式
(4)硅是太阳能电池板的主要原材料,请写出硅元素在周期表的位置
(5)4gCO在氧气中燃烧生成CO2,放出9.6kJ热量,写出CO燃烧的热化学方程式
(6)已知:①
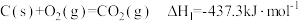
②H2(g)+1/2O2(g)=H2O(g) ∆H2=-285.8kJ·mol-1
③CO(g)+1/2O2(g)=CO2(g) ∆H3=-283.0kJ·mol-1
写出煤气化(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式
您最近一年使用:0次
名校
4 . 下表是元素周期表的一部分,回答相关问题。
(1)元素①和⑦形成的化合物的化学式为___________ 。
(2)元素⑥的过氧化物的电子式___________ ,其最高价氧化物对应的水化物中含有的化学键类型为___________ 。
(3)元素⑥、⑦、⑧、⑨的简单离子半径由大到小的顺序为___________ (用离子符号表示);元素④、⑤、⑧、⑨的最简单氢化物中稳定性最强的是___________ (填化学式)。
(4)最近,德国科学家实现了铷原子气体超流体态与绝缘体态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,相对原子质量是85。关于铷的下列说法不正确的是___________ (填序号)。
a.与水反应比钠反应更剧烈
b.单质具有很强的氧化性
c.Rb2O在空气中不会吸收水和二氧化碳
d.Rb2O2能与水剧烈反应并释放氧气
e.RbOH的碱性比同浓度的NaOH溶液弱
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(2)元素⑥的过氧化物的电子式
(3)元素⑥、⑦、⑧、⑨的简单离子半径由大到小的顺序为
(4)最近,德国科学家实现了铷原子气体超流体态与绝缘体态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,相对原子质量是85。关于铷的下列说法不正确的是
a.与水反应比钠反应更剧烈
b.单质具有很强的氧化性
c.Rb2O在空气中不会吸收水和二氧化碳
d.Rb2O2能与水剧烈反应并释放氧气
e.RbOH的碱性比同浓度的NaOH溶液弱
您最近一年使用:0次
2023-06-15更新
|
112次组卷
|
2卷引用:云南省开远市第一中学校2023-2024学年高一上学期12月月考化学试题
名校
5 . 元素在周期表中的位置,反映了元素的原子结构和性质。如图是元素周期表的一部分,请按照要求回答下列问题:
(1)①的元素符号是______ ,元素②位于周期表中的第______ 周期第______ 族。
(2)②、③两种元素中,非金属性较强的是______ (填元素符号)
(3)①、②、④三种元素中,原子半径最大的是______ (填元素符号)。
(4)④、⑤两种元素中最高价氧化物对应的水化物,属于两性氢氧化物的是______ (填化学式)。
(5)常温下,将元素⑥的单质通入 溶液中可制得漂白液,其有效成分是
溶液中可制得漂白液,其有效成分是 ,请写出该反应的离子方程式
,请写出该反应的离子方程式______
| 族 周期 | IA | 0 | ||||||
| 1 | IIA | IIIA | IVA | VA | VIA | VIIA | ||
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | |||||
(2)②、③两种元素中,非金属性较强的是
(3)①、②、④三种元素中,原子半径最大的是
(4)④、⑤两种元素中最高价氧化物对应的水化物,属于两性氢氧化物的是
(5)常温下,将元素⑥的单质通入
 溶液中可制得漂白液,其有效成分是
溶液中可制得漂白液,其有效成分是 ,请写出该反应的离子方程式
,请写出该反应的离子方程式
您最近一年使用:0次
2023-06-08更新
|
163次组卷
|
2卷引用:云南省普通高中2021-2022学年高一下学期期末学业水平考试化学试题
名校
6 . 下表显示了元素周期表中的一部分。
请回答下列问题。
(1)硫元素的原子序数是_______ 。
(2)氟元素的原子结构示意图为_______ (填写字母)。
A. B.
B.
(3)镁元素在元素周期表的第_______ (填“二”或“三”)周期第_______ (填“ⅡA”或“ⅢA”)族。
(4)已知同主族元素从上到下原子半径逐渐增大,原子半径大小:H_______ (填“<”或“>”)Na。
(5)雷雨天闪电时空气中有O3生成,O2转化为O3是_______ (填“物理变化”或“化学变化”)。
(6)SiO2可用于生产光导纤维,SiO2中硅元素的化合价为_______ 。
(7)海水中的重要元素——钠和氯,形成生活中常见调味品的化学式为_______ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 第一周期 | 1 H 氢 | 2 He 氦 | ||||||
| 第二周期 | 3 Li 锂 | 4 Be 镀 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 |
| 第三周期1 | 1 Na 钠 | 12 Mg 镁 | 33 Al 铝 | 14 Si 硅 | 15 P 磷 | 16 S 硫 | 17 C 氯 | 18 Ar 氩 |
(1)硫元素的原子序数是
(2)氟元素的原子结构示意图为
A.
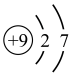 B.
B.
(3)镁元素在元素周期表的第
(4)已知同主族元素从上到下原子半径逐渐增大,原子半径大小:H
(5)雷雨天闪电时空气中有O3生成,O2转化为O3是
(6)SiO2可用于生产光导纤维,SiO2中硅元素的化合价为
(7)海水中的重要元素——钠和氯,形成生活中常见调味品的化学式为
您最近一年使用:0次
2023-05-11更新
|
148次组卷
|
2卷引用:云南省蒙自市第一高级中学2022-2023学年高一下学期5月期中考试化学试题
7 . 如图是元素周期表的一部分,回答下列问题。
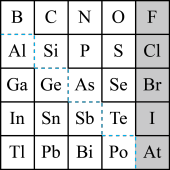
(1)元素 在元素周期表中的位置为
在元素周期表中的位置为_______ (写明周期数和族序数)。
(2) 的最高正价为
的最高正价为_______ , 的最高价氧化物为
的最高价氧化物为_______ (填化学式)。
(3)根据元素周期律推断:
①阴影部分元素最容易与氢气化合的是_______ (填元素符号)。
②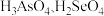 的酸性强弱:
的酸性强弱:
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③氢化物的还原性:
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)可在图中分界线(虚线部分)附近寻找_______(填序号)。
(5)① 常用作溶剂,其电子式为
常用作溶剂,其电子式为_______ 。
②镓( )的化合物氮化镓(
)的化合物氮化镓( )和砷化镓(
)和砷化镓( )作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是
)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是_______ (填序号)。
A.原子半径: B.N的非金属性比O强
B.N的非金属性比O强
C. 的金属性比
的金属性比 弱 D.
弱 D. 和
和 的氧化物可能是两性氧化物
的氧化物可能是两性氧化物
(6)用如图装置证明酸性: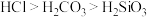 ,则溶液b为
,则溶液b为_______ 。下列事实可用于比较元素C与 非金属性相对强弱的是
非金属性相对强弱的是_______ (填序号)。
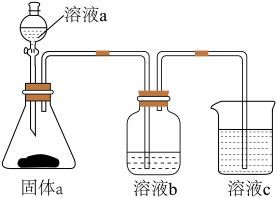
A.最高正化合价
B. 的氢化物比C的简单氢化物稳定
的氢化物比C的简单氢化物稳定
C. 的氢化物比C的简单氢化物沸点高
的氢化物比C的简单氢化物沸点高
D.最高价氧化物对应的水化物的酸性: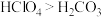

(1)元素
 在元素周期表中的位置为
在元素周期表中的位置为(2)
 的最高正价为
的最高正价为 的最高价氧化物为
的最高价氧化物为(3)根据元素周期律推断:
①阴影部分元素最容易与氢气化合的是
②
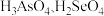 的酸性强弱:
的酸性强弱:
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③氢化物的还原性:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)可在图中分界线(虚线部分)附近寻找_______(填序号)。
| A.农药 | B.合金材料 | C.半导体材料 | D.优良的催化剂 |
 常用作溶剂,其电子式为
常用作溶剂,其电子式为②镓(
 )的化合物氮化镓(
)的化合物氮化镓( )和砷化镓(
)和砷化镓( )作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是
)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。下列说法正确的是A.原子半径:
 B.N的非金属性比O强
B.N的非金属性比O强C.
 的金属性比
的金属性比 弱 D.
弱 D. 和
和 的氧化物可能是两性氧化物
的氧化物可能是两性氧化物(6)用如图装置证明酸性:
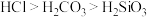 ,则溶液b为
,则溶液b为 非金属性相对强弱的是
非金属性相对强弱的是
A.最高正化合价

B.
 的氢化物比C的简单氢化物稳定
的氢化物比C的简单氢化物稳定C.
 的氢化物比C的简单氢化物沸点高
的氢化物比C的简单氢化物沸点高D.最高价氧化物对应的水化物的酸性:
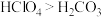
您最近一年使用:0次
名校
解题方法
8 . 请回答下列问题。
(1)在第三周期元素中,化学性质最不活泼的是_______ ,可用于制半导体材料的元素是_______ ,最高价氧化物的水化物碱性最强的是_______ ,酸性最强的是_______ ,具有两性的是_______ (以上均用化学式填空)。
(2)在C、N、O、F中,原子半径最大的是_______ 。
(3)第32号元素在元素周期表中的位置为_______ 。
(4)由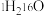 与
与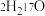 所代表的物质中,共有
所代表的物质中,共有_______ 种元素,_______ 种原子,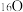 、
、 的关系是
的关系是_______ 。
(5)写出钠、铝最高价氧化物的水化物之间反应的化学方程式:_______ 。
(1)在第三周期元素中,化学性质最不活泼的是
(2)在C、N、O、F中,原子半径最大的是
(3)第32号元素在元素周期表中的位置为
(4)由
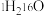 与
与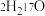 所代表的物质中,共有
所代表的物质中,共有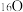 、
、 的关系是
的关系是(5)写出钠、铝最高价氧化物的水化物之间反应的化学方程式:
您最近一年使用:0次
9 . 联合国大会将 2019年定为“化学元素周期表国际年”,高度体现了元素周期表的重要性。下表显示了元素周期表中短周期的一部分,①~⑦代表七种短周期元素。
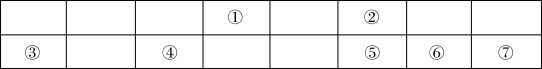
(1)七种元素中化学性质最不活泼的是_______ (填元素符号),形成化合物数目最多的元素是_______ (填元素符号)。
(2)元素②的最低价阴离子的离子结构示意图是_______ 。
(3)②、⑤两种元素的最简单氢化物中稳定性较强的是_______ (填化学式)。
(4)⑤、⑥两种元素的最高价氧化物对应的水化物中,酸性较弱的是_______ (填化学式)。
(5)元素③的最高价氧化物对应水化物与元素④的单质反应的离子方程式为_______ 。
(6)用电子式表示元素③和元素⑥形成化合物的过程_______ 。

(1)七种元素中化学性质最不活泼的是
(2)元素②的最低价阴离子的离子结构示意图是
(3)②、⑤两种元素的最简单氢化物中稳定性较强的是
(4)⑤、⑥两种元素的最高价氧化物对应的水化物中,酸性较弱的是
(5)元素③的最高价氧化物对应水化物与元素④的单质反应的离子方程式为
(6)用电子式表示元素③和元素⑥形成化合物的过程
您最近一年使用:0次
名校
解题方法
10 . 已知元素周期表中共有18纵行。如图所示实线表示元周期表的边界,按电子排布,可把元素周期表划分为s区、p区、d区、ds等,除ds区外,其他区的名称均按构造原理最后填入电子的能级符号来命名。
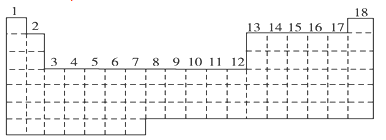
(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并标记分区_____ 。
(2)有的同学受这种划分的启示,认为d区内6、7纵行的部分元素可以排在另一区,你认为应排在___________ 区。
(3)请在元素周期表中标出4s轨道半充满的元素(用元素符号表示)_____ 。
(4)请利用电子排布的相关知识解释Fe3+比Fe2+稳定的原因:___________ 。
(5)随着科学技术的发展,不断有新的元素被发现。现在第七周期已经排满,则元素周期表共可以排布___________ 种元素。

(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并标记分区
(2)有的同学受这种划分的启示,认为d区内6、7纵行的部分元素可以排在另一区,你认为应排在
(3)请在元素周期表中标出4s轨道半充满的元素(用元素符号表示)
(4)请利用电子排布的相关知识解释Fe3+比Fe2+稳定的原因:
(5)随着科学技术的发展,不断有新的元素被发现。现在第七周期已经排满,则元素周期表共可以排布
您最近一年使用:0次
2022-10-20更新
|
155次组卷
|
2卷引用:云南省玉溪市华宁县第二中学2021-2022年高二下学期开学考试化学试题



