名校
1 . I、下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:
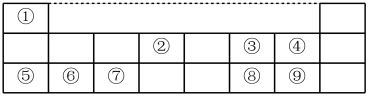
(1)元素⑧在周期表中的位置___________ ;
(2)在①~⑨元素中,某种元素的氧化物可用于呼吸面具中氧气来源,请写出该氧化物与二氧化碳反应的化学方程式___________ 。
(3)等质量的单质⑦分别与足量的稀硫酸和氢氧化钠溶液反应,相同条件下产生的气体体积之比为___________ 。
(4)元素⑨的单质可使湿润的淀粉-KI试纸变蓝,请写出离子方程式___________ 。
II、如图是某学校实验室从化学试剂商店采购的浓硫酸试剂标签上的部分内容。

(5)若实验室用该浓硫酸配制240mL0.5mol/L的稀硫酸,请计算需要该浓硫___________ mL(精确到小数点后1位)。
(6)配制过程中的正确操作顺序是:b、d___________ 、e(填“字母”)。
a、用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶。
b、用量筒量取所需体积浓硫酸注入盛有约50mL蒸馏水的烧杯。
c、用胶头滴管滴加蒸馏水,至溶液的凹液面与刻度线相切。
d、用玻璃棒慢慢搅动,混合均匀。
e、盖好容量瓶瓶塞,反复上下颠倒,摇匀。
f、将稀释后的H2SO4溶液沿玻璃棒注入250mL容量瓶。
g、往容量瓶中加入蒸馏水,直到液面在容量瓶刻度线下1~2cm处。
(7)下列操作将导致所配制的H2SO4溶液浓度偏大的是___________ 。
a、移液过程有H2SO4溶液溅出瓶外
b、移液后未洗涤烧杯和玻璃棒
c、定容时俯视容量瓶刻度线
d、加水超过刻度线,用胶头滴管吸出多余液体
e、洗涤时将量筒洗涤液也加入容量瓶

(1)元素⑧在周期表中的位置
(2)在①~⑨元素中,某种元素的氧化物可用于呼吸面具中氧气来源,请写出该氧化物与二氧化碳反应的化学方程式
(3)等质量的单质⑦分别与足量的稀硫酸和氢氧化钠溶液反应,相同条件下产生的气体体积之比为
(4)元素⑨的单质可使湿润的淀粉-KI试纸变蓝,请写出离子方程式
II、如图是某学校实验室从化学试剂商店采购的浓硫酸试剂标签上的部分内容。

(5)若实验室用该浓硫酸配制240mL0.5mol/L的稀硫酸,请计算需要该浓硫
(6)配制过程中的正确操作顺序是:b、d
a、用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶。
b、用量筒量取所需体积浓硫酸注入盛有约50mL蒸馏水的烧杯。
c、用胶头滴管滴加蒸馏水,至溶液的凹液面与刻度线相切。
d、用玻璃棒慢慢搅动,混合均匀。
e、盖好容量瓶瓶塞,反复上下颠倒,摇匀。
f、将稀释后的H2SO4溶液沿玻璃棒注入250mL容量瓶。
g、往容量瓶中加入蒸馏水,直到液面在容量瓶刻度线下1~2cm处。
(7)下列操作将导致所配制的H2SO4溶液浓度偏大的是
a、移液过程有H2SO4溶液溅出瓶外
b、移液后未洗涤烧杯和玻璃棒
c、定容时俯视容量瓶刻度线
d、加水超过刻度线,用胶头滴管吸出多余液体
e、洗涤时将量筒洗涤液也加入容量瓶
您最近一年使用:0次
名校
解题方法
2 . 下图是元素周期表的一部分。
(1)①-⑩元素中最稳定的原子是_______ (填元素符号);形成的气态氢化物稳定性最强的是_______ (填氢化物的化学式)。
(2)②的最高价氧化物的电子式为_______ ;用电子式表示⑤和⑥形成化合物的过程:_______ 。
(3)①和⑦金属性相似,①的最高价氧化物对应的水化物与KOH溶液反应的离子方程式为_______ 。
(4)某同学设计了如下实验证明非金属性③>②>⑧。已知 是不溶于水的白色胶状沉淀,
是不溶于水的白色胶状沉淀, 易挥发。
易挥发。
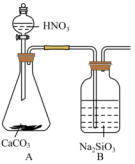
该同学打开分液漏斗活塞,观察到A中产生气泡,B中出现白色胶状沉淀即认为非金属性③>②>⑧。请问该同学的结论合理吗_______ (答“合理”或“不合理”),原因是_______ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)①-⑩元素中最稳定的原子是
(2)②的最高价氧化物的电子式为
(3)①和⑦金属性相似,①的最高价氧化物对应的水化物与KOH溶液反应的离子方程式为
(4)某同学设计了如下实验证明非金属性③>②>⑧。已知
 是不溶于水的白色胶状沉淀,
是不溶于水的白色胶状沉淀, 易挥发。
易挥发。
该同学打开分液漏斗活塞,观察到A中产生气泡,B中出现白色胶状沉淀即认为非金属性③>②>⑧。请问该同学的结论合理吗
您最近一年使用:0次
名校
解题方法
3 . 下表是元素周期表的一部分。表中所列的字母分别代表一种元素。
回答下列问题:
(1)D的简单气态氢化物分子的立体构型为___________ 。
(2)第一电离能H___________ X(填“>”、“<”或“=”)。
(3)DA3的沸点比D2E的沸点高,其原因是___________ 。
(4)YE 的立体构型为
的立体构型为___________ ,YE 的键角比YE
的键角比YE 的键角小的原因是
的键角小的原因是___________ 。
| A | R | ||||||||||||||||
| B | D | E | M | T | |||||||||||||
| G | H | X | J | Y | L | ||||||||||||
| N |
(1)D的简单气态氢化物分子的立体构型为
(2)第一电离能H
(3)DA3的沸点比D2E的沸点高,其原因是
(4)YE
 的立体构型为
的立体构型为 的键角比YE
的键角比YE 的键角小的原因是
的键角小的原因是
您最近一年使用:0次
2022-05-05更新
|
101次组卷
|
2卷引用:重庆市万州纯阳中学校2021-2022学年高二下学期5月月考化学试题
名校
4 . 门捷列夫预言的“类硅”,多年后被德国化学家文克勒发现,命名为锗(Ge)。加上之前发现的碳(C)、铅(Pb)、锡(Sn),这一主族的元素趋于完善。回答下列问题:
(1)①硅在元素周期表中的位置是_______ ;根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途是_______ 。
②硅和锗单质分别与H2反应生成的氢化物更稳定的是_______ (填“硅”或“锗”)。
(2)已知锡、铅两种元素的主要化合价是+2价和+4价,其中+2价锡元素和+4价铅元素的化合物均是不稳定的,+2价锡元素的化合物有强还原性,+4价铅元素的化合物有强氧化性,Sn2+还原性比Fe2+还原性强。
①氯气与锡共热的化学方程式_______ ;
②写出SnCl2溶液和FeCl3溶液反应的离子方程式_______ ;
③PbO2与浓盐酸共热能体现+4价Pb的强氧化性,写出离子方程式_______ 。
(1)①硅在元素周期表中的位置是
②硅和锗单质分别与H2反应生成的氢化物更稳定的是
(2)已知锡、铅两种元素的主要化合价是+2价和+4价,其中+2价锡元素和+4价铅元素的化合物均是不稳定的,+2价锡元素的化合物有强还原性,+4价铅元素的化合物有强氧化性,Sn2+还原性比Fe2+还原性强。
①氯气与锡共热的化学方程式
②写出SnCl2溶液和FeCl3溶液反应的离子方程式
③PbO2与浓盐酸共热能体现+4价Pb的强氧化性,写出离子方程式
您最近一年使用:0次
名校
5 . 如图是元素周期表的一部分,其中所列的字母分别代表某一化学元素。
(1)硒是人体的微量元素之一,可保护细胞组织,请在周期表中标出元素符号_______ 。
(2)比较元素c、d、e、f的离子半径,由大到小的顺序是_______ (填离子符号)。
(3)根据核外电子的排布分区,字母g属于_______ 区元素,该区的价层电子通式为_______ 。
(4)位于金属元素与非金属元素分界线上的元素常被称为半金属或类金属,其单质及化合物有一定特殊性,如ef3为_______ (填“离子化合物”或“共价化合物”),元素e的最高价氧化物对应的水化物与强碱反应的离子方程式是_______ 。
(5)第VIIA的元素组成的单质,从上到下熔沸点逐渐升高,其原因是_______ 。
| a | |||||||||||||||||
| b | c | ||||||||||||||||
| d | e | f | g | ||||||||||||||
(2)比较元素c、d、e、f的离子半径,由大到小的顺序是
(3)根据核外电子的排布分区,字母g属于
(4)位于金属元素与非金属元素分界线上的元素常被称为半金属或类金属,其单质及化合物有一定特殊性,如ef3为
(5)第VIIA的元素组成的单质,从上到下熔沸点逐渐升高,其原因是
您最近一年使用:0次
解题方法
6 . 下表是元素周期表的一部分。
请完成下列填空
(1) 的结构示意图为
的结构示意图为___________ 。
(2)第三周期中,最高价氧化物水化物酸性最强的是___________ (填化学式)。
(3)Mg、Cl和Ca中,离子半径由大到小的顺序是___________ (用离子符号表示)。
(4) 的电子式为
的电子式为___________ ; 结构式为
结构式为___________ 。
(5)写出一个能证明Cl的非金属性强于Br的离子方程式___________ 。
(6)硒(Se)被誉为“生命元素”,科学补硒可以减少疾病的发生。周期表中元素Se的位置在S的下方,下列推断正确的是___________(填字母序号)
(7)元素周期表中,某些主族元素与右下方的主族元素的性质具有相似性,如Be与Al,这种规律称为“对角线原则”。 与NaOH溶液反应的离子方程式为
与NaOH溶液反应的离子方程式为___________ 。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | Be | C | O | F | ||||
| 3 | Na | Mg | Al | S | Cl | |||
| 4 | Ca | Se | Br |
(1)
 的结构示意图为
的结构示意图为(2)第三周期中,最高价氧化物水化物酸性最强的是
(3)Mg、Cl和Ca中,离子半径由大到小的顺序是
(4)
 的电子式为
的电子式为 结构式为
结构式为(5)写出一个能证明Cl的非金属性强于Br的离子方程式
(6)硒(Se)被誉为“生命元素”,科学补硒可以减少疾病的发生。周期表中元素Se的位置在S的下方,下列推断正确的是___________(填字母序号)
A. 具有还原性 具有还原性 |
B. 的稳定性比 的稳定性比 强 强 |
C. 的酸性强于 的酸性强于 |
D. 在一定条件下可与NaOH溶液反应 在一定条件下可与NaOH溶液反应 |
 与NaOH溶液反应的离子方程式为
与NaOH溶液反应的离子方程式为
您最近一年使用:0次
7 . 下表是元素周期表的一部分。请按要求回答下列问题:
(1)③对应的元素符号是___________ 。⑥元素在周期表第___________ 列。
(2)上述所列元素最高价氧化物对应水化物酸性最强的是___________ (填化学式)。
(3)下列说法不正确 的是___________
(4)写出由上述所列元素形成的10电子分子的化学式___________ 。
(5) 属于卤素互化物,性质与
属于卤素互化物,性质与 相似。写出
相似。写出 与氢氧化钠溶液反应的化学方程式
与氢氧化钠溶液反应的化学方程式___________ 。
族 周期 | ⅠA | 0 | ||||||
| 1 | ④ | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ⑦ | |||||
| 4 | ② | ⑧ | ||||||
(2)上述所列元素最高价氧化物对应水化物酸性最强的是
(3)下列说法
| A.元素最高正价与最低负价绝对值相等的元素一定处于第ⅣA族 |
| B.第5周期第VA族元素的原子序数为65 |
| C.⑥形成的最简单氢化物比⑤形成的最简单氢化物的稳定性高 |
| D.周期表中当某元素的周期序数大于其族序数时,该元素可能属于金属或非金属 |
(5)
 属于卤素互化物,性质与
属于卤素互化物,性质与 相似。写出
相似。写出 与氢氧化钠溶液反应的化学方程式
与氢氧化钠溶液反应的化学方程式
您最近一年使用:0次
2022-01-22更新
|
468次组卷
|
2卷引用:重庆市缙云教育联盟2021-2022学年高三下学期3月质量检测化学试题
解题方法
8 . 下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。
针对元素①~⑩回答下列问题。
(1)元素①和②的单质化合形成的化合物NaH中H元素的化合价为_______ ;NaH能与水反应生成氢气,在反应后的溶液中滴入酚酞,溶液变红,其化学方程式为_______ 。
(2)元素④是人体必不可缺少的一种元素,缺乏会出现骨质疏松、易骨折等症状,请写出其原子结构示意图_______ 。
(3)由元素①和⑥形成的一种物质是天然气的主要成分,其电子式为_______ ;元素⑥还可以和⑦形成一种三原子直线型分子,其结构式为_______ ;元素②的单质在元素⑦的单质中点燃生成的淡黄色固体将其投入硫酸亚铁溶液中,预测主要的反应现象是_______ 。
(4)元素③、⑧、⑨的简单离子中半径最大是_______ (填离子符号),元素②和⑤的最高价氧化物对应的水化物之间可以发生反应,其反应的离子方程式为_______ 。
(5)表中元素⑨和⑩的气态氢化物中更稳定的是_______ (填化学式)。
| 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ⑤ | ⑧ | ⑨ | ||||
| 4 | ③ | ④ | ⑩ |
(1)元素①和②的单质化合形成的化合物NaH中H元素的化合价为
(2)元素④是人体必不可缺少的一种元素,缺乏会出现骨质疏松、易骨折等症状,请写出其原子结构示意图
(3)由元素①和⑥形成的一种物质是天然气的主要成分,其电子式为
(4)元素③、⑧、⑨的简单离子中半径最大是
(5)表中元素⑨和⑩的气态氢化物中更稳定的是
您最近一年使用:0次
名校
9 . 元素周期表在学习研究中有很重要的作用,如图是元素周期表的一部分。
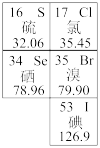
(1)市场上流行一种“富硒鸡蛋”,其中的硒是人体必需的微量元素,硒在元素周期表中的位置是:_______ 。
(2)写出硒元素中子数为46的核素的符号:_______ 。
(3)溴化硒(R)是一种重要的电子元件材料,其分子的球棍模型如图所示。
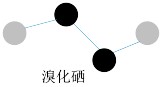
①写出该分子的电子式:_______ 。
②下列说法正确的是_______ (填标号)。
A.R属于离子化合物
B.离子半径:r(Se2-)>r(Cl-)
C.气态氢化物的还原性:H2Se<HCl
D.R分子中只有极性共价键
(4)下列事实不能说明溴元素的非金属性比硒元素强的是_______(填标号)。
(5) 和
和 均可作自来水消毒剂,且消毒时还原产物均为
均可作自来水消毒剂,且消毒时还原产物均为 ,则与8.7g
,则与8.7g 的氧化能力相当的
的氧化能力相当的 的质量为
的质量为_______ g。
(6)据报道, 还可通过
还可通过 与足量的潮湿
与足量的潮湿 固体反应制得,写出该反应的化学方程式
固体反应制得,写出该反应的化学方程式_______ 。
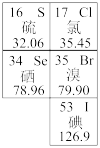
(1)市场上流行一种“富硒鸡蛋”,其中的硒是人体必需的微量元素,硒在元素周期表中的位置是:
(2)写出硒元素中子数为46的核素的符号:
(3)溴化硒(R)是一种重要的电子元件材料,其分子的球棍模型如图所示。

①写出该分子的电子式:
②下列说法正确的是
A.R属于离子化合物
B.离子半径:r(Se2-)>r(Cl-)
C.气态氢化物的还原性:H2Se<HCl
D.R分子中只有极性共价键
(4)下列事实不能说明溴元素的非金属性比硒元素强的是_______(填标号)。
| A.酸性:HBr>H2Se |
| B.化合物Se2Br2中硒显正价而溴显负价 |
| C.在溴水中通入H2Se,有沉淀生成 |
| D.稳定性:H2Se<HBr |
 和
和 均可作自来水消毒剂,且消毒时还原产物均为
均可作自来水消毒剂,且消毒时还原产物均为 ,则与8.7g
,则与8.7g 的氧化能力相当的
的氧化能力相当的 的质量为
的质量为(6)据报道,
 还可通过
还可通过 与足量的潮湿
与足量的潮湿 固体反应制得,写出该反应的化学方程式
固体反应制得,写出该反应的化学方程式
您最近一年使用:0次
10 . 某元素原子的电子排布式为[Ar]3d104s24p1,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
(1)该元素处于元素周期表的第_______ 周期,
(2)该元素处于元素周期表的第_______ 族,
(3)试推测该元素处于元素周期表的_______ 区,
(1)该元素处于元素周期表的第
(2)该元素处于元素周期表的第
(3)试推测该元素处于元素周期表的
您最近一年使用:0次
2021-05-30更新
|
845次组卷
|
4卷引用:重庆第二十三中学校2021-2022学年高二下学期第一次月考化学试题
重庆第二十三中学校2021-2022学年高二下学期第一次月考化学试题山西省浑源县第七中学2020-2021学年高二下学期第一次月考化学试题(已下线)1.2.1 原子结构与元素周期表(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)第1.2.1讲 原子结构与元素周期表-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)



