1 . 某元素原子的电子排布式为[Ar]3d104s24p1,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
(1)该元素处于元素周期表的第_______ 周期,
(2)该元素处于元素周期表的第_______ 族,
(3)试推测该元素处于元素周期表的_______ 区,
(1)该元素处于元素周期表的第
(2)该元素处于元素周期表的第
(3)试推测该元素处于元素周期表的
您最近一年使用:0次
2021-05-30更新
|
847次组卷
|
4卷引用:重庆第二十三中学校2021-2022学年高二下学期第一次月考化学试题
重庆第二十三中学校2021-2022学年高二下学期第一次月考化学试题山西省浑源县第七中学2020-2021学年高二下学期第一次月考化学试题(已下线)1.2.1 原子结构与元素周期表(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)第1.2.1讲 原子结构与元素周期表-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)
名校
解题方法
2 . 下表为元素周期表的一部分。回答下列问题:
(1)表中元素原子半径最小的是(写元素符号)_______ 。
(2)Y元素在周期表中的位置为_______ 。
(3)硫的气态氢化物的电子式为_______ ,其水溶液在空气中放置易变浑浊,该变化说明硫的非金属性比氧_______ (填“强”或“弱”)
(4)25℃,两种酸的电离平衡常数如下表。
①HSO 的电离平衡常数表达式K=
的电离平衡常数表达式K=_______ 。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______ 。
| 碳 | 氮 | Y | M |
| X | 硫 | Z |
(1)表中元素原子半径最小的是(写元素符号)
(2)Y元素在周期表中的位置为
(3)硫的气态氢化物的电子式为
(4)25℃,两种酸的电离平衡常数如下表。
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO
 的电离平衡常数表达式K=
的电离平衡常数表达式K=②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为
您最近一年使用:0次
解题方法
3 . 元素周期律是自然科学的基本规律,元素周期表是元素周期律的具体表现形式,它反映了元素之间的内在联系,是对元素的一种很好的自然分类。 我们可以利用元素的性质、它在周期表中的位置和它的原子结构三者之间的密切关系来指导化学学习研究。下图为元素周期表的一部分,请回答下列问题:
(1)A、B、C、D、E五种元素中原子半径最小的是_______ (填元素符号)。
(2)D在元素周期表中的位置是_______ 。
(3)E的最高价氧化物对应的水化物的化学式为_______ 。
(4)元素C与E形成的化合物电子式为_______ 。
(5)化合物C2B2中含有的化学键类型是_______ ,C2B2与CO2反应的化学方程式为_______ 。
(6)化合物A2B、A2D中热稳定性高的是_______ (填化学式),原因是_______ 。
A | |||||||
B | |||||||
C | D | E |
(1)A、B、C、D、E五种元素中原子半径最小的是
(2)D在元素周期表中的位置是
(3)E的最高价氧化物对应的水化物的化学式为
(4)元素C与E形成的化合物电子式为
(5)化合物C2B2中含有的化学键类型是
(6)化合物A2B、A2D中热稳定性高的是
您最近一年使用:0次
2021-02-09更新
|
441次组卷
|
3卷引用:重庆市2020-2021学年高一上学期期末联合检测化学试题
名校
解题方法
4 . 下表是元素周期表的一部分,表中的每个字母表示一种元素,用化学用语回答下列问题:
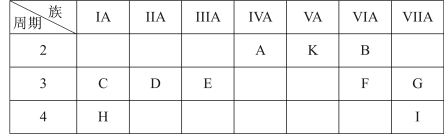
(1)写出上表中字母H对应的元素符号______ ,化合物CAK的电子式_______ 。
(2)E元素的最高价氧化物对应水化物与氢氧化钠反应的化学方程式是______ 。
(3)第ⅦA元素对应的简单氢化物的熔沸点较高的是_______ (填化学式),原因是___ 。
(4)C、D、H三种元素的原子半径由大到小顺序为______ 。
(5)F、G元素的最高价氧化物对应水化物的酸性较强的是___ (填化学式),A、B、F三种元素所形成的气态氢化物中稳定性较差的是_______ (填化学式)。
(6)联氨(N2H4)为二元弱碱,在水中的电离方式与氨相似,联氨与硫酸形成的酸式盐的化学式为______ 。

(1)写出上表中字母H对应的元素符号
(2)E元素的最高价氧化物对应水化物与氢氧化钠反应的化学方程式是
(3)第ⅦA元素对应的简单氢化物的熔沸点较高的是
(4)C、D、H三种元素的原子半径由大到小顺序为
(5)F、G元素的最高价氧化物对应水化物的酸性较强的是
(6)联氨(N2H4)为二元弱碱,在水中的电离方式与氨相似,联氨与硫酸形成的酸式盐的化学式为
您最近一年使用:0次
5 . 根据下表回答问题:
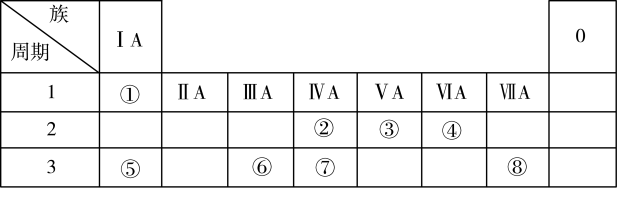
(1)元素⑦在周期表中的位置是___ 。
(2)元素①和⑤的原子序数相差___ 。
(3)写出元素⑤的最高价氧化物对应的水化物与元素⑧形成的单质反应的化学方程式___ 。
(4)写出元素③形成的不同化合价的化合物的化学式(写出四个)___ ,其中能与元素⑥形成的单质反应的化学方程式为___ 。

(1)元素⑦在周期表中的位置是
(2)元素①和⑤的原子序数相差
(3)写出元素⑤的最高价氧化物对应的水化物与元素⑧形成的单质反应的化学方程式
(4)写出元素③形成的不同化合价的化合物的化学式(写出四个)
您最近一年使用:0次
名校
解题方法
6 . 下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。回答问题:

(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界。并注明金属非金属的分界线___ 。
(2)有人认为在元素周期表中,有一种元素也可以放在第ⅦA族,你认为该元素为___ (填元素符号)。
(3)实验室制ca3的化学反应方程式为___ 。
(4)g的氧化物与e的最高价氧化物对应水化物反应的离子方程式为___ 。
(5)设计实验验证b、c非金属性的强弱,用离子方程式表示为___ 。
(6)i在周期表中的位置为___ 。i对应的单质与水反应的化学方程式为___ 。
(7)a2d2的电子式为___ ;用电子式表示fCl2的形成过程___ 。
(8)分别由a、d、e、h四种元素形成的两种盐反应的离子方程式为___ 。

(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界。并注明金属非金属的分界线
(2)有人认为在元素周期表中,有一种元素也可以放在第ⅦA族,你认为该元素为
(3)实验室制ca3的化学反应方程式为
(4)g的氧化物与e的最高价氧化物对应水化物反应的离子方程式为
(5)设计实验验证b、c非金属性的强弱,用离子方程式表示为
(6)i在周期表中的位置为
(7)a2d2的电子式为
(8)分别由a、d、e、h四种元素形成的两种盐反应的离子方程式为
您最近一年使用:0次
2020-04-23更新
|
63次组卷
|
2卷引用:重庆市黔江新华中学校2019-2020高一下学期期中考试化学试题
名校
7 . 下表列出了a~m13种元素在周期表(已省略了过渡元素)中的位置:
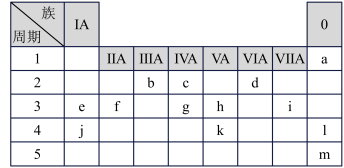
(1)元素b为___________ (填名称);画出g的原子结构示意图_____________ 。
(2)元素f、i、j的原子半径从大到小的顺序是____________ (用元素符号表示);这三种原子分别形成简单离子后,离子半径从大到小的顺序是_______________ (用离子符号表示)。
(3)元素d和e形成的一种化合物为淡黄色固体,该化合物的电子式为_____________ ,该化合物中化学键有__________ ,该化合物与c的最高价氧化物反应的化学方程式为_________ 。
(4)根据元素周期表推测K元素及其化合物的性质正确的是( )
A.气态氢化物的稳定性:K>h
B.K所在的主族元素通常用于制造农药和半导体材料
C.K的最高正价为+6
D.K的氢化物的沸点比NH3低
(5)用高能射线照射含有10电子的d元素氢化物分子时,一个分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子(含有10电子),试写出该阳离子的电子式:___________ 。

(1)元素b为
(2)元素f、i、j的原子半径从大到小的顺序是
(3)元素d和e形成的一种化合物为淡黄色固体,该化合物的电子式为
(4)根据元素周期表推测K元素及其化合物的性质正确的是
A.气态氢化物的稳定性:K>h
B.K所在的主族元素通常用于制造农药和半导体材料
C.K的最高正价为+6
D.K的氢化物的沸点比NH3低
(5)用高能射线照射含有10电子的d元素氢化物分子时,一个分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子(含有10电子),试写出该阳离子的电子式:
您最近一年使用:0次
名校
8 . 下图是元素周期表的一部分,表中所列字母a、b、c、d、e、f、g、h分别代表某种化学元素。请依据这8种元素回答下列问题。
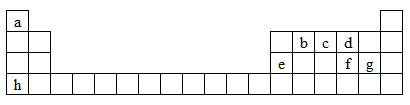
(1)上述8种元素的单质中常温下为气态,且密度最小的是______ (填化学式)。
(2)f元素的原子结构示意图为_______ 。
(3)c的最高价氧化物对应水化物的化学式为______ 。
(4)hg的电子式为_______ 。
(5)b、c、d三种元素的最简单氢化物的沸点由高到低的顺序是______ (填化学式)。
(6)元素e的单质与h的最高价氧化物对应的水化物反应的化学方程式为__________ 。
(7)f元素的最简单氢化物的水溶液显____ 性(填“酸”或“碱”),请写出该氢化物久置在空气中变质的化学方程式________ 。
(8)gd-常用作消毒剂,单质砷(As)在碱性溶液中可被gd-氧化为AsO43-,该反应的离子方程式为__________ 。

(1)上述8种元素的单质中常温下为气态,且密度最小的是
(2)f元素的原子结构示意图为
(3)c的最高价氧化物对应水化物的化学式为
(4)hg的电子式为
(5)b、c、d三种元素的最简单氢化物的沸点由高到低的顺序是
(6)元素e的单质与h的最高价氧化物对应的水化物反应的化学方程式为
(7)f元素的最简单氢化物的水溶液显
(8)gd-常用作消毒剂,单质砷(As)在碱性溶液中可被gd-氧化为AsO43-,该反应的离子方程式为
您最近一年使用:0次
2018-07-09更新
|
209次组卷
|
2卷引用:【全国区级联考】重庆市开州区2017-2018学年高一下学期期末测试化学试题
名校
解题方法
9 . 现有a~i 9种短周期元素,它们在同期表中的位置如下,请据此回答下列问题:(请用具体的元素符号及化学用语作答)
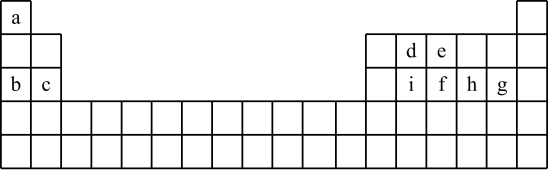
(1)a~i元素中,金属性最强的是________ ,最高价氧化物对应水化物中,酸性最强的物质是___________ 。g所在族的元素形成的氢化物中沸点最低的是____________________ 。
(2)比较b、e、g简单离子半径的大小___________________ (用离子符号作答)。
(3)写出由a~i 9种元素中的某些元素形成,且所有原子都满足最外层为8电子结构的任意两种化合物的化学式__________________ 、___________________ 。
(4)用一个化学反应方程式表示d的非金属性强于i_______________________________ 。
(5)由于在周期表中位置相近的元素性质相近,启发了人们在周期表中的一定区域内寻找新的物质。人们在周期表里金属和非金属的交界处找到了半导体材料。
①下列单质中,不能做半导体材料的物质是______ (填序号)。
A.Si B.Ge C.S
②砷(As)是e的同族元素,上比e多2个电子层,砷的一种核素含有42个中子,该核素的符号_________ ;镓(Ga)与As同周期,最外层有3个电子,Ga与As可以形成一种新型化合物半导体材料,其性能更优越。这种新型化合物化学式为____________________ 。
(6)c与a形成的化合物的电子式为___________ ,用电子式表示a与h形成a2h的过程__________________________________________ 。
(7)根据周期表对角线法则,金属Be和Al单质及化合物性质相似。试写出Be和氢氧化钠溶液反应的离子方程式_________________________________ 。

(1)a~i元素中,金属性最强的是
(2)比较b、e、g简单离子半径的大小
(3)写出由a~i 9种元素中的某些元素形成,且所有原子都满足最外层为8电子结构的任意两种化合物的化学式
(4)用一个化学反应方程式表示d的非金属性强于i
(5)由于在周期表中位置相近的元素性质相近,启发了人们在周期表中的一定区域内寻找新的物质。人们在周期表里金属和非金属的交界处找到了半导体材料。
①下列单质中,不能做半导体材料的物质是
A.Si B.Ge C.S
②砷(As)是e的同族元素,上比e多2个电子层,砷的一种核素含有42个中子,该核素的符号
(6)c与a形成的化合物的电子式为
(7)根据周期表对角线法则,金属Be和Al单质及化合物性质相似。试写出Be和氢氧化钠溶液反应的离子方程式
您最近一年使用:0次
名校
10 . 下表为元素周期表中的一部分,请回答下列问题:
(1)②、④、⑤的元素符号是_______ 、_______ 、_______ 。
(2)表中最活泼的金属元素是________ ,非金属性最强的元素是________________ (填写元素号)。
(3)④与水发生反应的化学方程式是______________________________________ 。
(4)请设计一个实验方案,比较⑤、⑦单质氧化性的强弱
________________________________________________________________________ 。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ||||||
| 4 | ⑥ | ⑦ |
(1)②、④、⑤的元素符号是
(2)表中最活泼的金属元素是
(3)④与水发生反应的化学方程式是
(4)请设计一个实验方案,比较⑤、⑦单质氧化性的强弱
您最近一年使用:0次
2018-04-22更新
|
314次组卷
|
3卷引用:重庆市南岸区2018-2019学年高一下学期期末质量调研抽测化学试题



