1 . 请按照要求填写:
(1)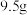 某二价金属氯化物
某二价金属氯化物 中含有
中含有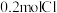 ,则
,则 的摩尔质量是
的摩尔质量是___________ 。
(2)除去镁粉中的铝粉,所选试剂为___________ ,相关的离子反应方程式为___________ 。
(3)配平离子方程式:___________ 。
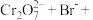 ___________=___________
___________=___________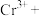 ___________
___________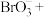 ___________
___________
(4)2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂 的一种制备方法如下。
的一种制备方法如下。___________ ;
② 的结构式是
的结构式是___________ ;
③反应Ⅰ的离子方程式是___________ 。
(1)
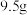 某二价金属氯化物
某二价金属氯化物 中含有
中含有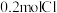 ,则
,则 的摩尔质量是
的摩尔质量是(2)除去镁粉中的铝粉,所选试剂为
(3)配平离子方程式:
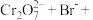 ___________=___________
___________=___________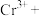 ___________
___________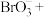 ___________
___________
(4)2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂
 的一种制备方法如下。
的一种制备方法如下。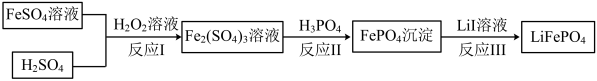
②
 的结构式是
的结构式是③反应Ⅰ的离子方程式是
您最近一年使用:0次
名校
2 . 元素周期表反映了元素之间的内在联系,是研究物质性质的重要工具。下图是元素周期表的一部分,请结合推断回答下列问题:________ (填元素符号);简单离子半径最小的元素是:________ (填离子符号)。
(2)由这些元素中原子半径最大与最小的两种元素形成的化合物X的电子式为________ ;画出X中阴离子的离子结构示意图:________ 。
(3)⑦⑧两种元素的最高价氧化物的水化物酸性较强的是________ (填化学式)。
(4)⑥的单质与强碱反应的离子方程式为________ 。
(5)根据周期表的结构特点,推断在第四周期中与⑤和⑥同族的元素原子序数相差________ 。
(6)查阅资料可知:⑤的单质可以在①的最高价氧化物中燃烧,瓶壁上出现大量白色和黑色的颗粒,试写出发生反应的化学方程式:________ 。
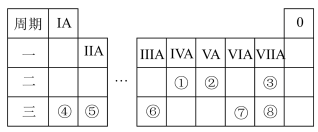
(2)由这些元素中原子半径最大与最小的两种元素形成的化合物X的电子式为
(3)⑦⑧两种元素的最高价氧化物的水化物酸性较强的是
(4)⑥的单质与强碱反应的离子方程式为
(5)根据周期表的结构特点,推断在第四周期中与⑤和⑥同族的元素原子序数相差
(6)查阅资料可知:⑤的单质可以在①的最高价氧化物中燃烧,瓶壁上出现大量白色和黑色的颗粒,试写出发生反应的化学方程式:
您最近一年使用:0次
2024-04-03更新
|
224次组卷
|
2卷引用:辽宁省名校联盟2023-2024学年高一下学期3月联合考试化学试题
名校
3 . 回答下列问题
Ⅰ.有下列物质:① 固体;②熔融的
固体;②熔融的 ;③NH4HCO3晶体;④稀硫酸;⑤
;③NH4HCO3晶体;④稀硫酸;⑤ 胶体;⑥铜;⑦液氨;⑧蔗糖晶体;⑨SO2;⑩冰醋酸
胶体;⑥铜;⑦液氨;⑧蔗糖晶体;⑨SO2;⑩冰醋酸
(1)上述状态下的物质可导电的是______ (填序号,下同),属于电解质的是_______ 。
(2)a个⑥原子的总质量为b g,则⑥的摩尔质量表示为_______ ,13.6g的②中阴阳离子总数为_______ 。
(3)在小烧杯中加入 蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和
蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和 溶液,
溶液,_______ ,即制得物质⑤ 胶体。
胶体。
(4)写出向①的水溶液中加入等物质的量的③的离子方程式:_______ 。
(5)向①溶液中通入少量⑨可产生白色沉淀,继续通入⑨可观察到白色沉淀消失,白色沉淀消失的原因为:_______ (离子方程式表示)
Ⅱ.元素周期表对学生学习化学有着重要的作用。其中过渡元素位于周期表中部,请补充以下元素的符号:
(6)原子序数21-25:_______ 、Ti、_______ 、Cr、Mn
元素周期表中同一纵列元素具有相似的化学性质,请补充以下元素的符号:
(7)第IVA族:C、Si、_______ 、_______ 、_______ 、Fl
Ⅰ.有下列物质:①
 固体;②熔融的
固体;②熔融的 ;③NH4HCO3晶体;④稀硫酸;⑤
;③NH4HCO3晶体;④稀硫酸;⑤ 胶体;⑥铜;⑦液氨;⑧蔗糖晶体;⑨SO2;⑩冰醋酸
胶体;⑥铜;⑦液氨;⑧蔗糖晶体;⑨SO2;⑩冰醋酸(1)上述状态下的物质可导电的是
(2)a个⑥原子的总质量为b g,则⑥的摩尔质量表示为
(3)在小烧杯中加入
 蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和
蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和 溶液,
溶液, 胶体。
胶体。(4)写出向①的水溶液中加入等物质的量的③的离子方程式:
(5)向①溶液中通入少量⑨可产生白色沉淀,继续通入⑨可观察到白色沉淀消失,白色沉淀消失的原因为:
Ⅱ.元素周期表对学生学习化学有着重要的作用。其中过渡元素位于周期表中部,请补充以下元素的符号:
(6)原子序数21-25:
元素周期表中同一纵列元素具有相似的化学性质,请补充以下元素的符号:
(7)第IVA族:C、Si、
您最近一年使用:0次
名校
4 . 如图是元素周期表的一部分,表中列出了八种元素的位置:
请回答下列问题:
(1)①元素的简单氢化物的电子式为______ 。
(2)在元素①-⑧中,金属性最强的元素是______ (填元素符号),最高价含氧酸酸性最强的是_____ (填化学式)。
(3)②、③、④三种元素的原子半径由大到小的顺序是_____ (填元素符号),③和⑦的简单氢化物的稳定性较强的是_____ (填化学式)。
(4)④和⑤所形成的化合物属于_____ (填“离子”或“共价”)化合物。
(5)⑤和⑥的最高价氧化物对应的水化物之间发生反应的离子方程式为_____ 。
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | ||||||||
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)①元素的简单氢化物的电子式为
(2)在元素①-⑧中,金属性最强的元素是
(3)②、③、④三种元素的原子半径由大到小的顺序是
(4)④和⑤所形成的化合物属于
(5)⑤和⑥的最高价氧化物对应的水化物之间发生反应的离子方程式为
您最近一年使用:0次
2023-04-09更新
|
478次组卷
|
2卷引用: 辽宁省实验中学2022-2023学年高一下学期4月月考化学试题
名校
解题方法
5 . 实验室加热液体时常加入沸石,其主要成分为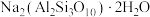 。根据其组成元素完成下列填空:
。根据其组成元素完成下列填空:
(1)元素Si在周期表中的位置是_______ 。
(2)沸石中的元素可形成多种化合物;Na元素与原子半径最小的元素组成化合物甲,常作强还原剂,化合物甲的电子式为_______ ;化合物乙可作为呼吸面具或潜艇氧气的来源,乙是_______ (填化学式);Na与同周期非金属性最强的元素形成的化合物可做调味品,用电子式表示该化合物的形成过程_______ 。
(3)与氧元素同周期的非金属元素中,简单气态氢化物最稳定的是_______ (填化学式)。
(4)Na所在周期的主族元素中,简单离子半径最小的是_______ (填离子符号)
(5)2022年我国科学家开始参与研究Uue新元素的合成。Uue与Na同主族,位于第八周期,称为类钫,其一种可能存在的核素原子核中有180个中子,则 中A=
中A=_______ 、Z=_______ 。
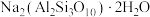 。根据其组成元素完成下列填空:
。根据其组成元素完成下列填空:(1)元素Si在周期表中的位置是
(2)沸石中的元素可形成多种化合物;Na元素与原子半径最小的元素组成化合物甲,常作强还原剂,化合物甲的电子式为
(3)与氧元素同周期的非金属元素中,简单气态氢化物最稳定的是
(4)Na所在周期的主族元素中,简单离子半径最小的是
(5)2022年我国科学家开始参与研究Uue新元素的合成。Uue与Na同主族,位于第八周期,称为类钫,其一种可能存在的核素原子核中有180个中子,则
 中A=
中A=
您最近一年使用:0次
解题方法
6 . 元素周期表的发现是近现代化学理论诞生的标志,全世界几乎所有化学教科书后都附有元素周期表。下表为元素周期表的一部分,请回答下列有关问题。
(1)由元素①和④可形成四核 的分子,写出该分子的电子式
的分子,写出该分子的电子式_______ 。
(2)元素④和⑤可构成一种淡黄色固体化合物,写出该化合物与②的最高价氧化物反应的化学方程式_______ 。
(3)元素②、③、④简单氢化物的稳定性由高到低顺序为_______ (用化学式表示)。
(4)元素⑦、⑧、⑨的简单离子半径由大到小顺序为_______ (用离子符号表示)。
(5)写出单质⑥与元素⑤的最高价氧化物对应水化物反应的化学方程式_______ 。
(6)元素的非金属性:⑧_______ ⑩(填“>”或“<”),下列事实不能说明上述结论的是_______ 。
A.元素⑧的单质与⑩的氢化物的水溶液发生反应,溶液变为橙黄色
B.元素⑧的最高价氧化物对应水化物的酸性比元素⑩的强
C.元素⑧和⑩的氢化物受热分解,前者的分解温度高
D.元素⑧的氢化物的水溶液的酸性比元素⑩的弱
E.元素⑧的氢化物的还原性比元素⑩的弱
F.常温下单质⑧为气态,单质⑩为液态
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
 的分子,写出该分子的电子式
的分子,写出该分子的电子式(2)元素④和⑤可构成一种淡黄色固体化合物,写出该化合物与②的最高价氧化物反应的化学方程式
(3)元素②、③、④简单氢化物的稳定性由高到低顺序为
(4)元素⑦、⑧、⑨的简单离子半径由大到小顺序为
(5)写出单质⑥与元素⑤的最高价氧化物对应水化物反应的化学方程式
(6)元素的非金属性:⑧
A.元素⑧的单质与⑩的氢化物的水溶液发生反应,溶液变为橙黄色
B.元素⑧的最高价氧化物对应水化物的酸性比元素⑩的强
C.元素⑧和⑩的氢化物受热分解,前者的分解温度高
D.元素⑧的氢化物的水溶液的酸性比元素⑩的弱
E.元素⑧的氢化物的还原性比元素⑩的弱
F.常温下单质⑧为气态,单质⑩为液态
您最近一年使用:0次
2023-01-04更新
|
726次组卷
|
3卷引用:辽宁省重点高中2022-2023学年高一上学期期末联考化学试题
名校
解题方法
7 . 元素①-⑥在元素周期表中的位置如下,按要求填空
回答下列问题:
(1)元素①的名称和符号为:_______ 。
(2)元素②的一种中子数为8的核素可用作分析古代人类食物结构,写出其原子符号_______ 。
(3)元素③-⑥中,原子半径最小的是_______ (填元素符号)。
(4)元素的非金属性:⑤_______ ⑥(填“>”、“<”或“=”),若通过实验事实证明上述结论,利用适当的文字与化学用语进行概述:_______ (写出2条)
(5)常温下,元素④的最高价氧化物的水化物可溶于③的最高价氧化物对应的水化物浓溶液中,其对应的化学方程式为_______ 。
| IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 第2周期 | ① | ② | ||||||
| 第3周期 | ③ | ④ | ⑤ | 6 | ||||
| 第4周期 | ⑦ |
回答下列问题:
(1)元素①的名称和符号为:
(2)元素②的一种中子数为8的核素可用作分析古代人类食物结构,写出其原子符号
(3)元素③-⑥中,原子半径最小的是
(4)元素的非金属性:⑤
(5)常温下,元素④的最高价氧化物的水化物可溶于③的最高价氧化物对应的水化物浓溶液中,其对应的化学方程式为
您最近一年使用:0次
8 . 如图是元素周期表的一部分。回答下列问题:
(1)地球上99%的溴元素存在于海水中,因此溴被称为“海洋元素”。
①溴在元素周期表中的位置_______ 。
②表中与溴同主族的元素中,最高价氧化物对应的水化物酸性最强的是_______ (填化学式)。
③类卤素IBr有很多类似于卤素单质的性质,已知IBr能与水发生非氧化还原反应,写出IBr与水反应的化学方程式_______ 。IBr中含有的化学键是_______ (填“离子键”、“极性键”或“非极性键”)。
(2)硒能够增强人体免疫力,是人体必需的微量元素。
① 的离子结构示意图为
的离子结构示意图为_______ 。
② 溶于水生成
溶于水生成 ,向所得溶液中通入
,向所得溶液中通入 气体发生反应,生成Se和
气体发生反应,生成Se和 。写出
。写出 与
与 反应的化学方程式
反应的化学方程式_______ 。
(3)下列说法正确的是_______ (填字母)。
a.原子半径: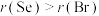
b.非金属性:
c.气态氢化物稳定性: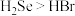

(1)地球上99%的溴元素存在于海水中,因此溴被称为“海洋元素”。
①溴在元素周期表中的位置
②表中与溴同主族的元素中,最高价氧化物对应的水化物酸性最强的是
③类卤素IBr有很多类似于卤素单质的性质,已知IBr能与水发生非氧化还原反应,写出IBr与水反应的化学方程式
(2)硒能够增强人体免疫力,是人体必需的微量元素。
①
 的离子结构示意图为
的离子结构示意图为②
 溶于水生成
溶于水生成 ,向所得溶液中通入
,向所得溶液中通入 气体发生反应,生成Se和
气体发生反应,生成Se和 。写出
。写出 与
与 反应的化学方程式
反应的化学方程式(3)下列说法正确的是
a.原子半径:
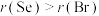
b.非金属性:

c.气态氢化物稳定性:
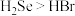
您最近一年使用:0次
名校
解题方法
9 . 为了庆祝元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。元素周期表反映了元素之间的内在联系,是学习、研究和应用化学的一种重要工具。下表是元素周期表的一部分,数字①~⑦代表前四周期七种主族元素。请按题目要求回答下列问题:
(1)①~⑦对应元素中,非金属性最强的元素名称是_______ ;⑤在周期表中的位置为_______ 。
(2)②与③形成化合物的电子式为_______ ;①的最高价氧化物的结构式为_______ 。
(3)③、④、⑥三种元素最高价氧化物对应的水化物的碱性由强到弱的顺序是_______ (用化学式来回答)。
(4)①~⑦对应元素中,位于金属与非金属的分界线附近的是_______ (填对应的序号)。
| ① | ② | |||||||
| ③ | ④ | ⑤ | ||||||
| ⑥ | …… | ⑦ | ||||||
(2)②与③形成化合物的电子式为
(3)③、④、⑥三种元素最高价氧化物对应的水化物的碱性由强到弱的顺序是
(4)①~⑦对应元素中,位于金属与非金属的分界线附近的是
您最近一年使用:0次
2022-09-08更新
|
114次组卷
|
2卷引用:辽宁省锦州市2019-2020学年高一上学期期末考试化学试题
名校
10 . 铁、铝和铜是人类使用最广泛的金属。回答下列问题:
(1)根据电子排布的特点,Al位于元素周期表的__ (填标号,下同),Fe位于元素周期表的__ 。
a.s区 b.p区 c.d区 d.ds区
(2)63Cu和65Cu互称为__ ,在元素周期表中位于第__ 周期,基态Cu+的电子排布式为__ 。
(3)经研究发现目前铁的最高价为+6价,其+6价化合物Na2FeO4在硫酸存在的条件下,可将Mn2+氧化为MnO ,而自身被还原为Fe3+,该反应的离子方程式为
,而自身被还原为Fe3+,该反应的离子方程式为__ 。
(1)根据电子排布的特点,Al位于元素周期表的
a.s区 b.p区 c.d区 d.ds区
(2)63Cu和65Cu互称为
(3)经研究发现目前铁的最高价为+6价,其+6价化合物Na2FeO4在硫酸存在的条件下,可将Mn2+氧化为MnO
 ,而自身被还原为Fe3+,该反应的离子方程式为
,而自身被还原为Fe3+,该反应的离子方程式为
您最近一年使用:0次
2022-01-09更新
|
228次组卷
|
2卷引用:辽宁省辽河油田第二高级中学2021-2022学年高二上学期期中考试化学试题



