名校
1 . 硒的原子序数为34,是硫的同主族元素,硒的单质及其化合物用途非常广泛。
(1)硒位于周期表第___ ,周期___ 族。Se2Cl2常用作分析试剂,其电子式为_____ 。
(2)硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是_____ (填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(3)工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HClO与Cu2Se的物质的量之比为___ 。用氨水中和亚硒酸后得到亚硒酸铵,再向( NH4)2SeO3溶液中加入Na2S2O3可得到纳米硒,同时生成亚硫酸盐,(NH4)2SeO3与Na2S2O3反应生成纳米硒的离子方程式为______ 。
(1)硒位于周期表第
(2)硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(3)工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HClO与Cu2Se的物质的量之比为
您最近一年使用:0次
2017-10-30更新
|
892次组卷
|
2卷引用:【全国百强校】辽宁省沈阳市东北育才学校2018-2019学年高一下学期第一次月考化学试题
2 . 元素周期表和元素周期律是学习化学的重要工具,可以帮助我们推测元素及其化合物的结构和性质,对工农业生产具有一定的指导意义。下表是元素周期表的部分片段(2、3周期)
(1)9种元素中,原子半径最小的是______ ,化学性质最不活泼的是____ 。
(2)⑥、⑧的最高价氧化物对应的水化物的酸性较强的是_______ 。
(3)④元素形成的多种同素异形体,有广泛的用途。请写出其中任意两种同素异形体的名称:______ 和______ 。
(4)写出③的最高价氧化物对应的水化物分别与①、⑤的最高价氧化物对应的水化物反应的化学方程式_______________ 。
(5)某同学做同周期元素金属性递变规律实验时,设什了如下实验并记录了有关实验现象。
请你根据上表得出实验结论:_________ ;若比较⑥与⑧的单质的活泼性,请写出实验方案___________________ 。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ④ | ⑤ | ⑦ | |||||
| 3 | ① | ② | ③ | ⑥ | ⑧ | ⑨ |
(1)9种元素中,原子半径最小的是
(2)⑥、⑧的最高价氧化物对应的水化物的酸性较强的是
(3)④元素形成的多种同素异形体,有广泛的用途。请写出其中任意两种同素异形体的名称:
(4)写出③的最高价氧化物对应的水化物分别与①、⑤的最高价氧化物对应的水化物反应的化学方程式
(5)某同学做同周期元素金属性递变规律实验时,设什了如下实验并记录了有关实验现象。
| 实验步骤 | 实验现象 |
| A、将一小块单质①放入滴有酚酞溶液的冷水中 | 剧烈反应,①浮于水面上,熔成小球,四处游动,发出“嘶嘶”声.随之消失,溶液变成红色 |
| B、将单质②投入冷水中,观察现象,再将水加热 | 开始无现象,加热后有气体产生 |
| C.将单质②投入稀盐酸中 | 迅速产生大量无色气体 |
| D.将单质③投入稀盐酸中 | 反应不十分剧烈,产生无色气体 |
请你根据上表得出实验结论:
您最近一年使用:0次
名校
3 . 下列为周期表的一部分,据此回答下列有关问题:
(1)写出元素符号 :①_______ ,⑤________ ,⑦_______ ,⑧________ 。
(2)表中所列元素中,最活泼的金属元素是______ (填元素符号,下同),最活泼的非金属元素是_______ 。
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是_________ (填化学式,下同),碱性最强的是_________ ,呈两性的是_________ 。
 族 周期 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)写出
(2)表中所列元素中,最活泼的金属元素是
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是
您最近一年使用:0次
名校
4 . 下列为元素周期表中的一部分:

已知:⑤的氢化物常温下为气体,该气体可使湿润的红色石蕊试纸变蓝。
用化学式或元素符号回答下列问题:
(1) ④在周期表中的位置_______ 。
(2) ①②③中,最高价氧化物对应的水化物碱性最强的物质的电子式为_________ 。
(3) ①②⑥的简单离子半径由大到小的顺序是___________ 。(填离子符号)
(4) 用一个化学方程式证明Cl元素与⑦非金属性的强弱:____________ 。
(5) ①和⑥形成的一种化合物A中含有一种10电子微粒和一种18电子微粒,则A中含有的化学键类型为______ 。
(6) ⑥、⑦分别形成的氢化物沸点高的是_______ (填化学式)。原因是_______ 。
(7) ①、③分别形成的最高价氧化物对应的水化物相互反应的离子方程式为_________ 。

已知:⑤的氢化物常温下为气体,该气体可使湿润的红色石蕊试纸变蓝。
用化学式或元素符号回答下列问题:
(1) ④在周期表中的位置
(2) ①②③中,最高价氧化物对应的水化物碱性最强的物质的电子式为
(3) ①②⑥的简单离子半径由大到小的顺序是
(4) 用一个化学方程式证明Cl元素与⑦非金属性的强弱:
(5) ①和⑥形成的一种化合物A中含有一种10电子微粒和一种18电子微粒,则A中含有的化学键类型为
(6) ⑥、⑦分别形成的氢化物沸点高的是
(7) ①、③分别形成的最高价氧化物对应的水化物相互反应的离子方程式为
您最近一年使用:0次
5 . (1)已知CuCl2溶液与乙二胺H2N-CH2CH2-NH2[常用(en)表示]作用,可形成配离子(如图所示):
请回答下列问题︰
①乙二胺分子中N原子成键时采取的杂化类型是____________ ,
乙二胺沸点高于Cl-CH2CH2-Cl的主要原因是___________________________ 。
②上述配离子中含有的化学键类型有:__________________ 。(填写代码,多选) ;
a配位键 b极性键 c非极性键 d离子键
③该配合物 [Cu(en)2]Cl2的系统命名为_______ ;其中铜离子的配位数是_______ 。
(2)下表中实线是元素周期表的部分边界,其中上边界未用实线标出。

根据信息回答下列问题:
①周期表中基态Ga原子的最外层电子排布式为__________________
②Fe元素位于周期表的_____ 区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为____ ;
已知:原子数目和电子总数(或价电子总数)相同的粒子互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为______ 和______ (填化学式)。
③根据VSEPR理论预测ED4-离子的空间构型为_________ 。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的化学式为____________ (写2种)。

请回答下列问题︰
①乙二胺分子中N原子成键时采取的杂化类型是
乙二胺沸点高于Cl-CH2CH2-Cl的主要原因是
②上述配离子中含有的化学键类型有:
a配位键 b极性键 c非极性键 d离子键
③该配合物 [Cu(en)2]Cl2的系统命名为
(2)下表中实线是元素周期表的部分边界,其中上边界未用实线标出。

根据信息回答下列问题:
①周期表中基态Ga原子的最外层电子排布式为
②Fe元素位于周期表的
已知:原子数目和电子总数(或价电子总数)相同的粒子互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为
③根据VSEPR理论预测ED4-离子的空间构型为
您最近一年使用:0次
6 . 甲、乙、丙、丁、戊代表五种元素.请填空:
(1)甲元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素名称为_______ ,其基态原子的电子排布式为_______ .
(2)乙元素的负一价离子和丙元素的正一价离子的电子层结构都与氩相同,乙的元素符号为_______ ,丙元素的基态原子的电子排布式为_______ .
(3)丁元素的正三价离子的3d能级为半充满,丁的元素符号为_______ ,其基态原子的电子排布式为_______ .
(4)戊元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,该元素在周期表中的位置是_______ (指明周期与族),其基态原子价层电子排布式为_______ .
(1)甲元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素名称为
(2)乙元素的负一价离子和丙元素的正一价离子的电子层结构都与氩相同,乙的元素符号为
(3)丁元素的正三价离子的3d能级为半充满,丁的元素符号为
(4)戊元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,该元素在周期表中的位置是
您最近一年使用:0次
2017-04-24更新
|
144次组卷
|
3卷引用:辽宁省锦州市黑山县黑山中学2021-2022学年高二上学期12月月考化学试题
解题方法
7 . 下表是元素周期表的一部分,针对a~k十一种元素回答下列问题(请用具体化学式回答,否则不给分):
(1)这些元素中非金属性最强的单质是_________ ,最高价氧化物对应水化物酸性最强的是_________ ,最高价氧化物对应水化物碱性最强的是_________ 。
(2)表中k的氢化物的化学式为_____ ,它的还原性比j的氢化物还原性_______ (填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性_______ (填“强”或“弱”)。
(3)e单质为________ ,其结构式为________________ 。
(4)用电子式表示h与k构成化合物的形成过程________________
(5)写出i的氧化物与强碱溶液反应的离子方程式________________
(6)H2和e的单质化合的反应是可逆反应,且该反应正方向放热。将等物质的量的H2、e的单质充入一恒容密闭容器中,在适当条件下反应。下列说法正确的是____ (填写选项)。
A.升高温度,不论正反应方向还是逆反应方向速率都加快
B.向上述容器中充入适量Ar气可加快反应速率
C.反应过程中,e的单质的体积分数始终为50%
D.反应器内压强不随时间变化而变化,说明反应到达平衡
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | c | d | e | f | g | |
| 3 | b | h | i | j | k |
(1)这些元素中非金属性最强的单质是
(2)表中k的氢化物的化学式为
(3)e单质为
(4)用电子式表示h与k构成化合物的形成过程
(5)写出i的氧化物与强碱溶液反应的离子方程式
(6)H2和e的单质化合的反应是可逆反应,且该反应正方向放热。将等物质的量的H2、e的单质充入一恒容密闭容器中,在适当条件下反应。下列说法正确的是
A.升高温度,不论正反应方向还是逆反应方向速率都加快
B.向上述容器中充入适量Ar气可加快反应速率
C.反应过程中,e的单质的体积分数始终为50%
D.反应器内压强不随时间变化而变化,说明反应到达平衡
您最近一年使用:0次
2016-12-09更新
|
434次组卷
|
2卷引用:2015-2016学年辽宁葫芦岛一中高二上期初考试化学试卷
8 . 下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白(涉及表中元素一律用对应化学符号表示):
(1)在这些元素中,化学性质最不活泼的是:________ (填具体元素符号,下同),原子结构示意图为________ 。元素⑩名称为________ 在周期表中的位置________ 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是________ ,碱性最强的化合物的电子式是:________ 。
(3)用电子式表示元素④与⑥的化合物的形成过程:________________ ,该化合物属于________ (填“共价”或“离子”)化合物。
(4)表示①与⑦的化合物的电子式________ ,该化合物是由________ (填”极性”、“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是______________ 。
(6)元素③的氢化物的结构式为________ ;该氢化物常温下和元素⑦的单质反应的化学方程式为_________________________________ 。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是
(3)用电子式表示元素④与⑥的化合物的形成过程:
(4)表示①与⑦的化合物的电子式
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是
(6)元素③的氢化物的结构式为
您最近一年使用:0次
2016-12-09更新
|
644次组卷
|
6卷引用:2014-2015辽宁师大附中高一下学期第一次月考化学试卷
9-10高一下·辽宁·期中
9 . 现有A、B、C、D四种短周期主族元素,其原子序数依次增大,已知A、C位于同一主族,A元素在元素周期表中原子半径最小,B、D原子最外层电子数相等,且B、D原子序数之和是A、C原子序数之和的两倍。
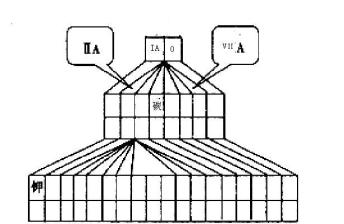
(1)请在如图塔式元素周期表(元素周期表的另一种画法)相应位置中标出A、B、C、D四种元素的元素符号。_____________
(2)图中将过渡元素涂黑。_______________
(3)由上述四种元素中的某几种所形成的具有漂白作用物质的化学式(写出两种):_______ 、______ 。

(1)请在如图塔式元素周期表(元素周期表的另一种画法)相应位置中标出A、B、C、D四种元素的元素符号。
(2)图中将过渡元素涂黑。
(3)由上述四种元素中的某几种所形成的具有漂白作用物质的化学式(写出两种):
您最近一年使用:0次
9-10高二下·吉林·期中
10 . A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为: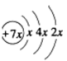 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A_________ B__________ C __________ D __________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________ ,碱性最强的是_________ 。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________ ,电负性最大的元素是__________ 。
(4)D的氢化物比C的氢化物的沸点__________ (填"高"或"低"),原因_____________
(5)E元素原子的核电荷数是__________ ,E元素在周期表的第_______ 周期,第________ 族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______ 区。
(6)A、B、C最高价氧化物的晶体类型是分别是______ 晶体、______ 晶体、_____ 晶体。
(7)画出D的核外电子排布图_____________________ ,这样排布遵循了_______ 规则。
(8)用电子式表示B的硫化物的形成过程:______________________________________
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:(1)写出下列元素的符号:A
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(4)D的氢化物比C的氢化物的沸点
(5)E元素原子的核电荷数是
(6)A、B、C最高价氧化物的晶体类型是分别是
(7)画出D的核外电子排布图
(8)用电子式表示B的硫化物的形成过程:
您最近一年使用:0次



