名校
解题方法
1 . 元素周期律反映了元素性质的周期性变化规律。
(1)氮氧化铝(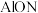 )是一种高硬度,耐高温的防弹材料,
)是一种高硬度,耐高温的防弹材料, 、O、N三种元素的简单离子半径由大到小的排列顺序是
、O、N三种元素的简单离子半径由大到小的排列顺序是___________ 。
(2)在元素周期表中, ,
, 具有相似的化学性质。写出铍与氢氧化钠溶液反应的离子方程式:
具有相似的化学性质。写出铍与氢氧化钠溶液反应的离子方程式:___________ 。
(3)锡为主族元素,其原子结构示意图: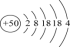 。锡在元素周期表中的位置是
。锡在元素周期表中的位置是___________ , 能与
能与 溶液反应生成钠盐,写出发生反应的化学方程式:
溶液反应生成钠盐,写出发生反应的化学方程式:___________ 。
(4)硒 是与人类的健康密切相关的一种元素,工业上用浓
是与人类的健康密切相关的一种元素,工业上用浓 ,焙烧
,焙烧 的方法提取硒(其中
的方法提取硒(其中 转化为
转化为 ),且有
),且有 和
和 (固体)生成,写出发生反应的化学方程式:
(固体)生成,写出发生反应的化学方程式:___________ 。理论上该反应每转移 电子,可得到的
电子,可得到的 的质量为
的质量为___________ g。
(1)氮氧化铝(
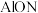 )是一种高硬度,耐高温的防弹材料,
)是一种高硬度,耐高温的防弹材料, 、O、N三种元素的简单离子半径由大到小的排列顺序是
、O、N三种元素的简单离子半径由大到小的排列顺序是(2)在元素周期表中,
 ,
, 具有相似的化学性质。写出铍与氢氧化钠溶液反应的离子方程式:
具有相似的化学性质。写出铍与氢氧化钠溶液反应的离子方程式:(3)锡为主族元素,其原子结构示意图:
 。锡在元素周期表中的位置是
。锡在元素周期表中的位置是 能与
能与 溶液反应生成钠盐,写出发生反应的化学方程式:
溶液反应生成钠盐,写出发生反应的化学方程式:(4)硒
 是与人类的健康密切相关的一种元素,工业上用浓
是与人类的健康密切相关的一种元素,工业上用浓 ,焙烧
,焙烧 的方法提取硒(其中
的方法提取硒(其中 转化为
转化为 ),且有
),且有 和
和 (固体)生成,写出发生反应的化学方程式:
(固体)生成,写出发生反应的化学方程式: 电子,可得到的
电子,可得到的 的质量为
的质量为
您最近一年使用:0次
名校
2 . 下表是元素周期表前20号元素的有关信息:
已知:Li的半径为0.152nm,Be的半径为0.111nm。回答下列问题:
(1)元素c在周期表中的位置为________ ,用电子式表示a2e的形成过程:________ 。
(2)f、h、b简单离子半径由大到小的顺序为________ (用离子符号表示)。
(3)BaCl2溶液中先通入eb2,再加入h的单质,可观察到的现象是________ ,发生反应的离子方程式为________ 。
(4)化合物A、B均由a、b、e、f四种元素组成,则A和B相互反应的离子方程式:________ 。
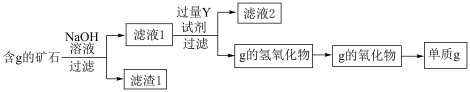
(5)工业上用含g元素的矿石(主要成分为g的氧化物,还含有杂质FeO、Fe2O3)提纯g的氧化物并冶炼单质g,流程如下,滤渣1的成分为:________ (填写化学式),滤液1中通入过量Y试剂反应的离子方程式为:________ 。
| 元素 | a | b | c | d | e | f | g | h |
| 原子半径/nm | 0.030 | 0.066 | 0.117 | 0.232 | 0.106 | 0.186 | 0.143 | 0.099 |
| 最高正化合价 | +1 | +4 | +1 | +6 | +1 | +3 | +7 | |
| 最低负化合价 | -2 | -4 | -2 | -1 |
(1)元素c在周期表中的位置为
(2)f、h、b简单离子半径由大到小的顺序为
(3)BaCl2溶液中先通入eb2,再加入h的单质,可观察到的现象是
(4)化合物A、B均由a、b、e、f四种元素组成,则A和B相互反应的离子方程式:
(5)工业上用含g元素的矿石(主要成分为g的氧化物,还含有杂质FeO、Fe2O3)提纯g的氧化物并冶炼单质g,流程如下,滤渣1的成分为:

您最近一年使用:0次
名校
3 . 元素周期表反映了元素之间的内在联系,是研究物质性质的重要工具。下图是元素周期表的一部分,请结合推断回答下列问题:________ (填元素符号);简单离子半径最小的元素是:________ (填离子符号)。
(2)由这些元素中原子半径最大与最小的两种元素形成的化合物X的电子式为________ ;画出X中阴离子的离子结构示意图:________ 。
(3)⑦⑧两种元素的最高价氧化物的水化物酸性较强的是________ (填化学式)。
(4)⑥的单质与强碱反应的离子方程式为________ 。
(5)根据周期表的结构特点,推断在第四周期中与⑤和⑥同族的元素原子序数相差________ 。
(6)查阅资料可知:⑤的单质可以在①的最高价氧化物中燃烧,瓶壁上出现大量白色和黑色的颗粒,试写出发生反应的化学方程式:________ 。
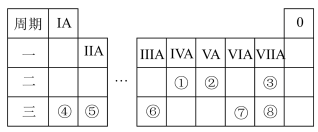
(2)由这些元素中原子半径最大与最小的两种元素形成的化合物X的电子式为
(3)⑦⑧两种元素的最高价氧化物的水化物酸性较强的是
(4)⑥的单质与强碱反应的离子方程式为
(5)根据周期表的结构特点,推断在第四周期中与⑤和⑥同族的元素原子序数相差
(6)查阅资料可知:⑤的单质可以在①的最高价氧化物中燃烧,瓶壁上出现大量白色和黑色的颗粒,试写出发生反应的化学方程式:
您最近一年使用:0次
2024-04-03更新
|
224次组卷
|
2卷引用:河南省漯河市高级中学2023-2024学年高一下学期3月月考化学试题
解题方法
4 . 人体必需的一些元素在周期表中的分布情况如下:
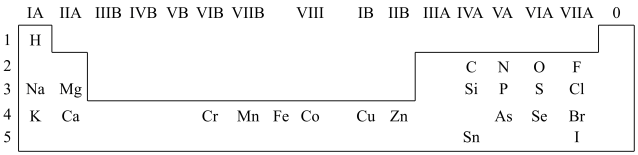
(1)请在上图中画出金属与非金属的分界线______ 。
(2)Na与O形成的原子个数比为1:1的化合物所含的化学键类型为______ 。
(3)锡(Sn)与C为同一主族元素,Sn原子比C原子多三个电子层,则Sn的原子序数为______ 。
(4)X射线衍射法可以测定某些分子的结构,下列分子结构模型中正确是______ (填字母)。
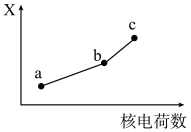
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是______(填字母)。
(6)某小组为探究 、
、 、
、 的氧化性强弱,设计实验如下:
的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
实验②观察到的现象是______ ,甲同学根据此现象得出结论:氧化性 。乙同学认为实验②不能充分证明氧化性
。乙同学认为实验②不能充分证明氧化性 ,其理由是
,其理由是______ 。试从原子结构的角度解释卤素单质的氧化性递变规律:同一主族元素从上到下,______ ,因此,元素的非金属性逐渐减弱,对应的单质的氧化性逐渐减弱。

(1)请在上图中画出金属与非金属的分界线
(2)Na与O形成的原子个数比为1:1的化合物所含的化学键类型为
(3)锡(Sn)与C为同一主族元素,Sn原子比C原子多三个电子层,则Sn的原子序数为
(4)X射线衍射法可以测定某些分子的结构,下列分子结构模型中正确是
| A | B | C | D |
| HCl | H₂O | CO₂ | CH₄ |
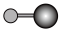 | 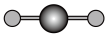 | 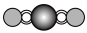 | 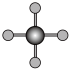 |
| 直线形 | 直线形 | 直线形 | 平面正方形 |
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是______(填字母)。

| A.若a、b、c表示碱金属元素,则X表示对应单质的密度 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第ⅥA族元素,则X表示对应氢化物的稳定性 |
| D.若a、b、c表示第ⅡA族元素,则X表示最高价氧化物对应水化物的碱性 |
(6)某小组为探究
 、
、 、
、 的氧化性强弱,设计实验如下:
的氧化性强弱,设计实验如下:资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
| 序号 | 实验① | 实验② |
| 实验操作 |  |  |
| 现象 | 溶液变为黄色 |
 。乙同学认为实验②不能充分证明氧化性
。乙同学认为实验②不能充分证明氧化性 ,其理由是
,其理由是
您最近一年使用:0次
名校
5 . 元素周期表反映元素之间的内在联系,是研究物质性质的重要工具。如表是元素周期表的一部分,请回答下列问题:
(1)元素②、③、⑥的简单离子半径由大到小的排序为___________ (填离子符号)。
(2)②和④组成的物质中含有___________ 键,可以证明该化合物含有此类型化学键的实验事实为___________ 。
(3)⑤的氧化物和⑥的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(4)已知④的单质与①的最高价氧化物A在点燃条件下能反应生成黑色单质,推测③的单质___________ (填“能”或“不能”)与A反应,说明推测的理由___________ 。
| 周期 | IA | 0 | |||||||
| 1 | IIA | … | IIIA | IVA | VA | VIA | VIIA | ||
| 2 | ① | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | |||||
(2)②和④组成的物质中含有
(3)⑤的氧化物和⑥的最高价氧化物对应的水化物反应的离子方程式为
(4)已知④的单质与①的最高价氧化物A在点燃条件下能反应生成黑色单质,推测③的单质
您最近一年使用:0次
名校
6 . 金属钛被誉为“二十一世纪金属”。回答下列问题:
(1)钛在周期表中的位置___________ ,位于元素周期表中___________ 区,钛原子核外有___________ 种空间运动状态不同的电子,Ti2+电子占据的最高能层的电子排布式为___________ 。
(2)TiO2的晶胞如图所示,则该晶体的密度为___________ g⋅cm-3 (设阿伏加德罗常数的值为NA,用含a、b、NA的代数式表示)。
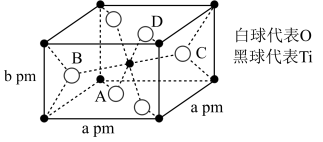
(1)钛在周期表中的位置
(2)TiO2的晶胞如图所示,则该晶体的密度为

您最近一年使用:0次
名校
7 . 如图是元素周期表的一部分:

(1)写出元素①的元素符号___________ ,与①同周期的主族元素中,第一电离能比①大的有___________ 种。该周期的某种元素基态原子的核外电子排布式为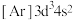 ,则该元素在元素周期表中的位置为
,则该元素在元素周期表中的位置为___________ 。
(2)基态锑(Sb)原子的价电子排布式为___________ 。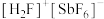 (氟酸锑)是一种超强酸,
(氟酸锑)是一种超强酸, 离子的空间构型为
离子的空间构型为___________ ,写出一种与 互为等电子体的分子
互为等电子体的分子___________ 。
(3)处于分界线的元素Al可形成多种化合物。
 中三种元素的基态原子的第一电离能从大到小的顺序是
中三种元素的基态原子的第一电离能从大到小的顺序是___________ (填元素符号)。
 中铝的杂化方式为
中铝的杂化方式为___________ ,其中阴离子的立体结构为___________ ,
(4)下列说法正确的是___________
a. 、SiC,
、SiC, 是空间构型均为正四面体的三种物质,键角与其他两种物质不同的是SiC
是空间构型均为正四面体的三种物质,键角与其他两种物质不同的是SiC
b.基态P原子中,电子占据的最高能级符号为M
c.Sb位于p区
d.升温实现液氨→氨气→氮气和氢气变化的阶段中,微粒间破坏的主要的作用力依次是氢键、极性共价键
(5)周期表中元素的性质呈现出周期性变化。元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能( )。第二周期部分元素的
)。第二周期部分元素的 变化趋势如图所示,其中除氮元素外,其他元素的
变化趋势如图所示,其中除氮元素外,其他元素的 自左而右依次增大的原因是
自左而右依次增大的原因是___________ ;氮元素的 呈现异常的原因是
呈现异常的原因是___________ 。


(1)写出元素①的元素符号
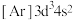 ,则该元素在元素周期表中的位置为
,则该元素在元素周期表中的位置为(2)基态锑(Sb)原子的价电子排布式为
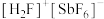 (氟酸锑)是一种超强酸,
(氟酸锑)是一种超强酸, 离子的空间构型为
离子的空间构型为 互为等电子体的分子
互为等电子体的分子(3)处于分界线的元素Al可形成多种化合物。
 中三种元素的基态原子的第一电离能从大到小的顺序是
中三种元素的基态原子的第一电离能从大到小的顺序是 中铝的杂化方式为
中铝的杂化方式为(4)下列说法正确的是
a.
 、SiC,
、SiC, 是空间构型均为正四面体的三种物质,键角与其他两种物质不同的是SiC
是空间构型均为正四面体的三种物质,键角与其他两种物质不同的是SiCb.基态P原子中,电子占据的最高能级符号为M
c.Sb位于p区
d.升温实现液氨→氨气→氮气和氢气变化的阶段中,微粒间破坏的主要的作用力依次是氢键、极性共价键
(5)周期表中元素的性质呈现出周期性变化。元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(
 )。第二周期部分元素的
)。第二周期部分元素的 变化趋势如图所示,其中除氮元素外,其他元素的
变化趋势如图所示,其中除氮元素外,其他元素的 自左而右依次增大的原因是
自左而右依次增大的原因是 呈现异常的原因是
呈现异常的原因是
您最近一年使用:0次
名校
8 . 下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:
(1)元素⑨在周期表中的位置___________ 。
(2)在0~⑨元素中,某种元素的氧化物是两性氧化物,请写出该氧化物与氢氧化钠反应的化学方程式___________ 。
(3)请比较④⑨两元素的氢化物的稳定性___________ (用氢化物的分子式表示)。
(4)元素⑨的单质可使湿润的淀粉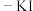 试纸变蓝,请写出离子方程式
试纸变蓝,请写出离子方程式___________ 。
(5)将⑤⑥⑦三种元素的离子按半径从大到小排序___________ (用元素符号表示)。
| ① | |||||||
| ② | ③ | ④ | |||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)元素⑨在周期表中的位置
(2)在0~⑨元素中,某种元素的氧化物是两性氧化物,请写出该氧化物与氢氧化钠反应的化学方程式
(3)请比较④⑨两元素的氢化物的稳定性
(4)元素⑨的单质可使湿润的淀粉
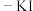 试纸变蓝,请写出离子方程式
试纸变蓝,请写出离子方程式(5)将⑤⑥⑦三种元素的离子按半径从大到小排序
您最近一年使用:0次
9 . 按照要求回答下列问题。
(1)有下列物质: 、
、 、
、 、
、 、
、 、
、 、
、 。
。
①上述物质中既含共价键又含离子键的__________ ;属于共价化合物的是__________ ;
② 溶于水时破坏
溶于水时破坏__________ (填“共价键”或“离子键”,下同), 熔化时破坏
熔化时破坏__________ 。
(2)砷在元素周期表中的位置__________ 。原子序数为115的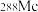 中子数为
中子数为__________ 。
(3)向 溶液中通入氯气出现黄色浑浊,反应的离子方程式为
溶液中通入氯气出现黄色浑浊,反应的离子方程式为__________ 。可证明非金属性:
__________ S(填“>”或“<”)。
(4)短周期元素Y的一种含氧酸化学式为 ,其结构式可表示为
,其结构式可表示为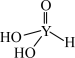 。该酸为
。该酸为__________ 元酸。写出该酸与过量 溶液反应的化学方程式:
溶液反应的化学方程式:__________ 。(用对应元素符号作答。已知信息:氢氧原子结合成的一种原子团“ ”叫羟基,含氧酸中只有羟基氢才可电离出
”叫羟基,含氧酸中只有羟基氢才可电离出 )
)
(1)有下列物质:
 、
、 、
、 、
、 、
、 、
、 、
、 。
。①上述物质中既含共价键又含离子键的
②
 溶于水时破坏
溶于水时破坏 熔化时破坏
熔化时破坏(2)砷在元素周期表中的位置
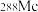 中子数为
中子数为(3)向
 溶液中通入氯气出现黄色浑浊,反应的离子方程式为
溶液中通入氯气出现黄色浑浊,反应的离子方程式为
(4)短周期元素Y的一种含氧酸化学式为
 ,其结构式可表示为
,其结构式可表示为 。该酸为
。该酸为 溶液反应的化学方程式:
溶液反应的化学方程式: ”叫羟基,含氧酸中只有羟基氢才可电离出
”叫羟基,含氧酸中只有羟基氢才可电离出 )
)
您最近一年使用:0次
2023-03-24更新
|
649次组卷
|
3卷引用:河南省南阳市六校2022-2023学年高一下学期第一次联考化学试题
名校
10 . 下表中阿拉伯数字(1、2……)是元素周期表中行或列的序号。请参照元素A~I在周期表中的位置,回答下列问题。
(1)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1∶1和1∶2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素以原子个数之比为1∶1和1∶2形成两种离子化合物Z和M。写出Z与Y反应的化学方程式:_______ 。
(2)I元素在周期表中的位置是第_______ 周期、第_______ 族。
(3)实验室中采用下图所示装置模拟工业上同时制取元素A和I的单质的过程。
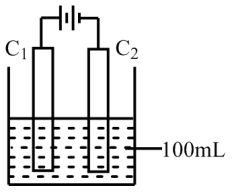
①写出电极C1上发生反应的电极反应式_______ 。
②当电极上产生112 mL(标准状况)元素I的单质气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=_______ 。(Kw=1.0×10-14)
纵行 横行 | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I |
(1)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1∶1和1∶2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素以原子个数之比为1∶1和1∶2形成两种离子化合物Z和M。写出Z与Y反应的化学方程式:
(2)I元素在周期表中的位置是第
(3)实验室中采用下图所示装置模拟工业上同时制取元素A和I的单质的过程。

①写出电极C1上发生反应的电极反应式
②当电极上产生112 mL(标准状况)元素I的单质气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=
您最近一年使用:0次



