解题方法
1 . 下表是元素周期表的一部分。请按要求回答下列问题:___________ ,⑦的最高价氧化物对应水化物的化学式___________ 。
(2)上述所列元素最高价氧化物对应水化物碱性最强的是___________ (填化学式)。
(3)写出由上述所列元素形成的18电子的双原子分子的化学式___________ 。
(4)下列说法不正确的是___________。
(5)BrCl属于卤素互化物,性质与Cl2相似。写出BrCl与氢氧化钠溶液反应的化学方程式___________ 。
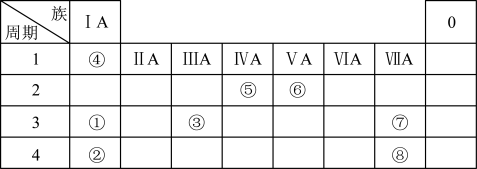
(2)上述所列元素最高价氧化物对应水化物碱性最强的是
(3)写出由上述所列元素形成的18电子的双原子分子的化学式
(4)下列说法不正确的是___________。
| A.⑥形成的最简单氢化物比⑤形成的最简单氢化物的稳定性高 |
| B.元素最高正价与最低负价绝对值相等的元素一定处于第ⅣA族 |
| C.第5周期第ⅦA族元素的原子序数为53 |
| D.周期表中当某元素的周期序数大于其主族序数时,该元素可能属于金属或非金属 |
(5)BrCl属于卤素互化物,性质与Cl2相似。写出BrCl与氢氧化钠溶液反应的化学方程式
您最近一年使用:0次
名校
2 . 回答下列问题。
(1)第117号元素Ts在周期表中的位置是___________ 。
(2)下图表示铷(Rb)及其化合物的产业链,回答相应问题。___________ (填“小于”或“大于”)钾的离子半径。
②写出由氧化铷制备氢氧化铷的化学方程式___________ 。
③离子推进火箭是通过电离原子气体,转化为阳离子,然后离子被电场力作用加速,通过排气口射出推进器,产生反作用力推动火箭。单质铷适合用于离子推进火箭的原因是___________ 。
(3)阅读短文,回答问题。
硅元素在地壳中的含量仅次于氧。人类很早就利用硅酸盐烧陶制瓷、获得玻璃制品。
1824年,人类成功提炼出硅单质。由石英砂制高纯硅的过程如下:
整个芯片制造过程需要许多高精密度的专业设备,其中不乏我国目前还未完全掌握而被“卡脖子”的技术。我国科学家正开发“碳基”芯片来替代硅基芯片,习近平主席评价此项研究“另辟蹊径,柳暗花明”。
①请依据以上短文,下列说法正确是___________ 。
A.硅元素在自然界中以游离态(单质)形式存在,石英砂的主要成分是SiO2
B.单晶硅做芯片的基底材料与硅元素储量丰富,单晶硅导电性好、耐腐蚀性能优异有关
C.制备单质硅的过程中焦炭过多容易生成副产物金刚砂
D.碳和硅在周期表中位于同一主族,性质相似,因此“碳基”芯片有望替代硅基芯片
②制备高纯硅过程必须严格控制无水无氧,因为SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式___________ 。
③有一类组成最简单的有机硅化合物叫硅烷,硅烷的组成、结构与相应的烷烃相似,化学性质活泼,可在空气中自燃,写出乙硅烷在空气中自燃的化学方程式___________ 。
(1)第117号元素Ts在周期表中的位置是
(2)下图表示铷(Rb)及其化合物的产业链,回答相应问题。
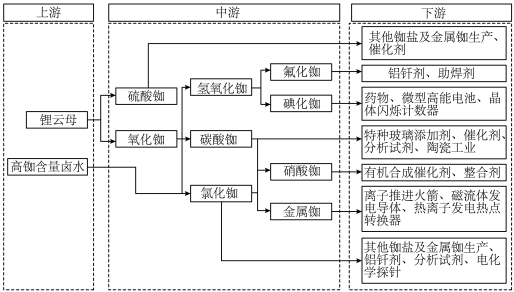
②写出由氧化铷制备氢氧化铷的化学方程式
③离子推进火箭是通过电离原子气体,转化为阳离子,然后离子被电场力作用加速,通过排气口射出推进器,产生反作用力推动火箭。单质铷适合用于离子推进火箭的原因是
(3)阅读短文,回答问题。
硅元素在地壳中的含量仅次于氧。人类很早就利用硅酸盐烧陶制瓷、获得玻璃制品。
1824年,人类成功提炼出硅单质。由石英砂制高纯硅的过程如下:
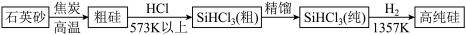
整个芯片制造过程需要许多高精密度的专业设备,其中不乏我国目前还未完全掌握而被“卡脖子”的技术。我国科学家正开发“碳基”芯片来替代硅基芯片,习近平主席评价此项研究“另辟蹊径,柳暗花明”。
①请依据以上短文,下列说法正确是
A.硅元素在自然界中以游离态(单质)形式存在,石英砂的主要成分是SiO2
B.单晶硅做芯片的基底材料与硅元素储量丰富,单晶硅导电性好、耐腐蚀性能优异有关
C.制备单质硅的过程中焦炭过多容易生成副产物金刚砂
D.碳和硅在周期表中位于同一主族,性质相似,因此“碳基”芯片有望替代硅基芯片
②制备高纯硅过程必须严格控制无水无氧,因为SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式
③有一类组成最简单的有机硅化合物叫硅烷,硅烷的组成、结构与相应的烷烃相似,化学性质活泼,可在空气中自燃,写出乙硅烷在空气中自燃的化学方程式
您最近一年使用:0次
解题方法
3 . 下表为长式元素周期表的主要部分。①~⑬代表13种元素,⑭表示元素周期表中某一区域。
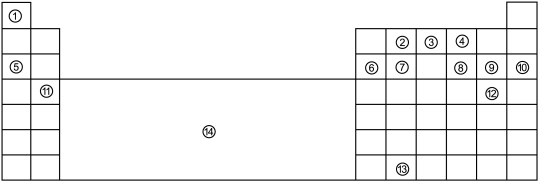
请回答:
(1)①、②、④的原子半径从大到小排列的顺序是______ 。(填化学式)
(2)①与③组成的含10个电子的阳离子的化学式是______ 。
(3)有些族的元素有特别的名称,⑨所在主族的元素叫做______ 元素。
(4)⑩的元素符号是______ 。
(5)⑪的元素名称是______ 。
(6)⑫的原子结构示意图是______ 。
(7)⑬在元素周期表中的位置是______ 。
(8)下列说法不正确 的是______ 。
A. ②的原子所含原子数即
②的原子所含原子数即 任何粒子的粒子数
任何粒子的粒子数
B.⑥、⑦的氧化物均能与⑤的最高价氧化物对应水化物反应
C.⑧的某种氧化物进入大气会形成酸雨
D.⑨的某种氧化物可用于自来水消毒
E.⑭所示区域内的元素常见于农药中
(9)⑥的单质与 溶液反应的化学方程式是
溶液反应的化学方程式是______ 。

请回答:
(1)①、②、④的原子半径从大到小排列的顺序是
(2)①与③组成的含10个电子的阳离子的化学式是
(3)有些族的元素有特别的名称,⑨所在主族的元素叫做
(4)⑩的元素符号是
(5)⑪的元素名称是
(6)⑫的原子结构示意图是
(7)⑬在元素周期表中的位置是
(8)下列说法
A.
 ②的原子所含原子数即
②的原子所含原子数即 任何粒子的粒子数
任何粒子的粒子数B.⑥、⑦的氧化物均能与⑤的最高价氧化物对应水化物反应
C.⑧的某种氧化物进入大气会形成酸雨
D.⑨的某种氧化物可用于自来水消毒
E.⑭所示区域内的元素常见于农药中
(9)⑥的单质与
 溶液反应的化学方程式是
溶液反应的化学方程式是
您最近一年使用:0次
4 . 下表是元素周期表的一部分。请按要求回答下列问题:
(1)氧元素在周期表中的位置是___________ ,⑦的最高价氧化物对应水化物的化学式___________ 。
(2)上述所列元素最高价氧化物对应水化物碱性最强的是___________ (填化学式)。
(3)写出由上述所列元素形成的18电子的双原子分子的化学式___________ 。
(4)已知X为第四周期第IIIA族元素,其原子序数为a,Y与X位于同一周期,且为第IIA族元素,写出Y的原子序数b=___________ (用含a的代数式表示)。
(5)下列说法不正确的是___________。
(6)BrCl属于卤素互化物,性质与Cl2相似。写出BrCl与氢氧化钠溶液反应的化学方程式___________ 。
族 周期 | IA | 0 | ||||||
| 1 | ④ | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ⑦ | |||||
| 4 | ② | ⑧ | ||||||
(2)上述所列元素最高价氧化物对应水化物碱性最强的是
(3)写出由上述所列元素形成的18电子的双原子分子的化学式
(4)已知X为第四周期第IIIA族元素,其原子序数为a,Y与X位于同一周期,且为第IIA族元素,写出Y的原子序数b=
(5)下列说法不正确的是___________。
| A.⑥形成的最简单氢化物比⑤形成的最简单氢化物的稳定性高 |
| B.元素最高正价与最低负价绝对值相等的元素一定处于第IVA族 |
| C.第5周期第VIIA族元素的原子序数为53 |
| D.周期表中当某元素的周期序数大于其主族序数时,该元素可能属于金属或非金属 |
您最近一年使用:0次
名校
5 . 据报道,我国首次将星载铷(Rb)钟应用于海洋二号卫星,已知Rb的原子序数为37。回答下列有关问题:
(1)Rb的原子结构示意图中共有______ 个电子层,最外层电子数为______ 。
(2)Rb在元素周期表中的位置是______ 。
(3)取少量铷单质加入水中,可观察到其剧烈反应,涉及反应的离子方程式为____________ 。
(1)Rb的原子结构示意图中共有
(2)Rb在元素周期表中的位置是
(3)取少量铷单质加入水中,可观察到其剧烈反应,涉及反应的离子方程式为
您最近一年使用:0次
名校
6 . 按要求完成下列填空:
(1)①写出次氯酸的电子式_______ ;②漂粉精主要成分的化学式_______ 。
(2)写出 元素在元素周期表中的位置
元素在元素周期表中的位置_______ 。
(3) 与
与 溶液反应的化学方程式
溶液反应的化学方程式_______ 。
(1)①写出次氯酸的电子式
(2)写出
 元素在元素周期表中的位置
元素在元素周期表中的位置(3)
 与
与 溶液反应的化学方程式
溶液反应的化学方程式
您最近一年使用:0次
名校
7 . 短周期主族元素A、B、C、D、E、F在元素周期表中的位置如下图所示,其中元素F是同周期元素原子半径最小的;请回答下列问题:
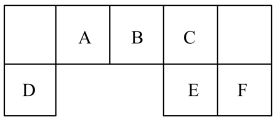
(1)F在周期表中的位置___________ ;
(2)比较B、C、D元素简单离子半径的大小顺序___________ (填写离子符号);
(3)F的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为_______________________ ;
(4)要比较元素E与F非金属性的强弱,正确合理的实验操作与现象是______________________ ;
(5)用高能射线照射液态水时,一个水分子能释放一个电子,同时产生一种具有较强氧化性阳离子,该阳离子中存在的化学键有______ ,并写出该阳离子与E的氢化物的水溶液反应的离子方程式________________ 。

(1)F在周期表中的位置
(2)比较B、C、D元素简单离子半径的大小顺序
(3)F的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,反应的化学方程式为
(4)要比较元素E与F非金属性的强弱,正确合理的实验操作与现象是
(5)用高能射线照射液态水时,一个水分子能释放一个电子,同时产生一种具有较强氧化性阳离子,该阳离子中存在的化学键有
您最近一年使用:0次
名校
8 . 肼(N2H4)是重要的化工原料,能与水、乙醇等混溶;它是一种二元弱碱,在水中的电离方式与氨相似,室温下电离常数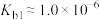 ;在碱性溶液中,N2H4是强还原剂。
;在碱性溶液中,N2H4是强还原剂。
(1)写出N元素在元素周期表中的位置___________ 。
(2)写出N2H4与过量硫酸反应形成的酸式盐的化学式___________ 。
(3)N2H4可通过NH3和NaClO反应制得,总反应主要分为两步,
已知第一步: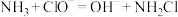
①写出第二步反应的离子方程式___________ 。
②请设计实验,检验总反应中产物的主要阴离子(假设反应物完全反应)___________ 。
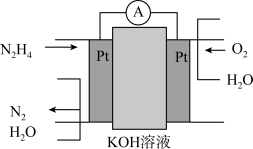
(4)N2H4是一种高能燃料,可用于燃料电池,原理如图,电池的负极反应式为___________ 。
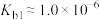 ;在碱性溶液中,N2H4是强还原剂。
;在碱性溶液中,N2H4是强还原剂。(1)写出N元素在元素周期表中的位置
(2)写出N2H4与过量硫酸反应形成的酸式盐的化学式
(3)N2H4可通过NH3和NaClO反应制得,总反应主要分为两步,
已知第一步:
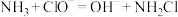
①写出第二步反应的离子方程式
②请设计实验,检验总反应中产物的主要阴离子(假设反应物完全反应)
(4)N2H4是一种高能燃料,可用于燃料电池,原理如图,电池的负极反应式为

您最近一年使用:0次
22-23高一下·浙江·期中
9 . 按要求完成下列填空:
(1)①写出乙烯的电子式_______ ;
②黄铁矿主要成分的化学式_______ 。
(2)写出Si元素在元素周期表中的位置_______ 。
(3)在加热条件下木炭与浓硫酸反应的化学方程式为_______ 。
(1)①写出乙烯的电子式
②黄铁矿主要成分的化学式
(2)写出Si元素在元素周期表中的位置
(3)在加热条件下木炭与浓硫酸反应的化学方程式为
您最近一年使用:0次
解题方法
10 . 按要求回答下列问题。
(1)写出漂白粉有效成分的化学式___________ 。
(2)某元素的一种核素可用于文物的年代测定,写出该元素在周期表中的位置___________ 。
(3)写出稀盐酸与石灰石反应的离子方程式___________ 。
(4)写出红热的铁与水蒸气反应的化学方程式___________ 。
(1)写出漂白粉有效成分的化学式
(2)某元素的一种核素可用于文物的年代测定,写出该元素在周期表中的位置
(3)写出稀盐酸与石灰石反应的离子方程式
(4)写出红热的铁与水蒸气反应的化学方程式
您最近一年使用:0次



