1 . 下表是元素周期表的一部分根据A~G元素在周期表中的位置,用化学式填写空白。
(1)氧化性最强的单质是______ ,还原性最强的单质是______ ,化学性质最不活泼的单质是______ 。(填相应的化学式)
(2)最稳定的氢化物是______ 。(填相应的化学式)
(3)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是__________________ 。(填相应的化学式)
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | A | |||||||
| 2 | D | F | H | |||||
| 3 | B | C | E | G |
(1)氧化性最强的单质是
(2)最稳定的氢化物是
(3)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是
您最近一年使用:0次
2 . 现有下列10种物质:①H2O②Cl2③Al④P2O5⑤盐酸⑥NaOH⑦AgNO3⑧碘酒⑨C2H5OH⑩NaHCO3。
(1)其中属于电解质的是___ (填序号)。
(2)②在元素周期表中的位置是___ ,写出③的原子结构示意图___ 。
(3)请写出③⑥反应的化学方程式___ 。
(4)请写出足量⑤与⑦反应的离子方程式___ 。
(1)其中属于电解质的是
(2)②在元素周期表中的位置是
(3)请写出③⑥反应的化学方程式
(4)请写出足量⑤与⑦反应的离子方程式
您最近一年使用:0次
20-21高一上·浙江绍兴·阶段练习
3 . 下表是元素周期表的一部分,表中所列字母分别代表某一元素,根据表中所列元素回答问题:
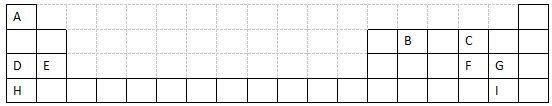
(1)元素B在周期表中的位置是___________ 。
(2)上表短周期元素中金属性最强的是___________ (填元素符号)。
(3)最高价氧化物对应水化物酸性最强的物质___________ (填化学式)。
(4)A、C、D三元素形成化合物的电子式为___________ ,该化合物中含有的作用力有___________ 。
(5)表中F、G、H元素可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是___________ (用离子符号表示)。
(6)比较G、I的非金属性:G___________ I (填“>", “<”,“=”),用化学为程式证明你的结论___________ 。

(1)元素B在周期表中的位置是
(2)上表短周期元素中金属性最强的是
(3)最高价氧化物对应水化物酸性最强的物质
(4)A、C、D三元素形成化合物的电子式为
(5)表中F、G、H元素可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是
(6)比较G、I的非金属性:G
您最近一年使用:0次
名校
4 . 下表是元素周期表的一部分,表中所列的数字分别代表某一种元素。
请完成下列空白。
(1)属于卤族元素的有_______ (填元素符号)。
(2)②在⑥的单质中燃烧产物的电子式为_______ ,其中所含化学键类型为_______ 。
(3)能证明元素⑧比⑨的非金属性强的实验事实有(用离子方程式表示):_______ 。
(4)元素⑥的一种中子数为10的核素的符号为_______
(5)元素⑤的单质与NaOH溶液反应的化学方程式为_______
| ⅠA | 0 | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ⑥ | |||||||
| 3 | ② | ④ | ⑤ | ⑦ | ⑧ | |||
| 4 | ③ | ⑨ | ||||||
请完成下列空白。
(1)属于卤族元素的有
(2)②在⑥的单质中燃烧产物的电子式为
(3)能证明元素⑧比⑨的非金属性强的实验事实有(用离子方程式表示):
(4)元素⑥的一种中子数为10的核素的符号为
(5)元素⑤的单质与NaOH溶液反应的化学方程式为
您最近一年使用:0次
解题方法
5 . (1)①写出Na2O的名称:_________ ;②写出乙酸官能团的名称_________ 。
(2)写出乙烯通入溴水溶液反应的化学方程式:______________________ 。
(3)写出硫在周期表中的位置:_________
(2)写出乙烯通入溴水溶液反应的化学方程式:
(3)写出硫在周期表中的位置:
您最近一年使用:0次
6 . 2019年是门捷列夫提出元素周期表150周年。根据元素周期律和元素周期表,回答以下问题:
(1)下列推断合理 的是______________
A.第35号元素的单质在常温常压下是液体
B.位于第四周期第ⅤA族的元素为非金属元素
C.第84号元素的最高化合价是+7
D.第七周期0族元素的原子序数为118
(2)X、Y、Z代表3种元素。已知:①X+和Y-两种离子具有相同的电子层结构;②Z元素原子核内质子数比Y元素原子核内质子数少9个;③Y和Z两元素可以形成四核42个电子的负一价阴离子。下列说法正确的是__________
A.元素X位于元素周期表的第三周期第ⅠA族
B.化合物YZ2可用于杀菌消毒,被列为A1级高级安全灭菌消毒剂
C.三种元素X、Y、Z可以组成XYZ、XYZ2、XYZ3、XYZ4等多种化合物
D.化合物XY、X2Z2属于离子化合物
(1)下列推断
A.第35号元素的单质在常温常压下是液体
B.位于第四周期第ⅤA族的元素为非金属元素
C.第84号元素的最高化合价是+7
D.第七周期0族元素的原子序数为118
(2)X、Y、Z代表3种元素。已知:①X+和Y-两种离子具有相同的电子层结构;②Z元素原子核内质子数比Y元素原子核内质子数少9个;③Y和Z两元素可以形成四核42个电子的负一价阴离子。下列说法正确的是
A.元素X位于元素周期表的第三周期第ⅠA族
B.化合物YZ2可用于杀菌消毒,被列为A1级高级安全灭菌消毒剂
C.三种元素X、Y、Z可以组成XYZ、XYZ2、XYZ3、XYZ4等多种化合物
D.化合物XY、X2Z2属于离子化合物
您最近一年使用:0次
7 . 下表是元素周期表的一部分,针对表中的①~⑨ 9种元素,回答以下问题:
(1)③与⑥形成的化合物的晶体类型_____________ 。
(2)比较⑥⑦两种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序(用化学式表示):_ 。写出①③⑦形成化合物(其中⑦显+1价)的结构式____________ 。
(3)①元素的阴离子半径___________ ②元素的阳离子半径(填“>”、“<”或“=”)。
(4)用化学反应事实说明⑦与⑨的单质的化学性质活泼性强弱_______ (用离子方程式表示)。
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
一 | ① | |||||||
二 | ② | ③ | ||||||
三 | ④ | ⑤ | ⑥ | ⑦ | ||||
四 | ⑧ | ⑨ |
(1)③与⑥形成的化合物的晶体类型
(2)比较⑥⑦两种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序(用化学式表示):
(3)①元素的阴离子半径
(4)用化学反应事实说明⑦与⑨的单质的化学性质活泼性强弱
您最近一年使用:0次
2019高三·浙江·专题练习
8 . 如表所示是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
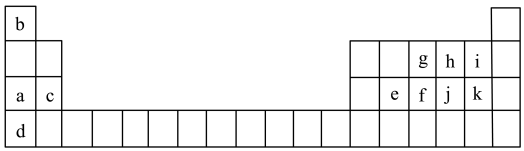
请你根据表中所给元素,回答下列问题:
(1)在所给短周期元素中____ 的原子半径与_____ 的原子半径之比最小 (填元素符号)。
(2)表中金属性最强的元素与氧气反应生成化合物的化学式是________ (填两种即可),i和j氢化物比较,稳定性强的是________ (填写氢化物化学式)。
(3)海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,其单质能做消毒杀菌剂的原因是____________________________________ (用化学方程式表示)。
(4)写出均由a、b、h、j四种元素所形成的两种化合物的水溶液相互反应的离子方程式:_____________ 。
(5)常温下某液态化合物只含上述元素的两种,分子中原子个数比1∶1,请你仅用一个化学方程式表示该液态化合物既有氧化性又有还原性:____________________________ 。

请你根据表中所给元素,回答下列问题:
(1)在所给短周期元素中
(2)表中金属性最强的元素与氧气反应生成化合物的化学式是
(3)海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,其单质能做消毒杀菌剂的原因是
(4)写出均由a、b、h、j四种元素所形成的两种化合物的水溶液相互反应的离子方程式:
(5)常温下某液态化合物只含上述元素的两种,分子中原子个数比1∶1,请你仅用一个化学方程式表示该液态化合物既有氧化性又有还原性:
您最近一年使用:0次
9-10高一下·浙江金华·期中
9 . 下表中的实线表示元素周期表的部分边界。①-⑥分别表示元素周期表中对应位置的元素。
(1)元素⑤氢化物的结构式为_______ 。
(2)元素④的氢化物沸点比元素⑤的氢化物沸点_______ (填“高”或“低”)。原因是_______
(3)在一定条件下,元素③与⑥可形成一种化合物,常温下为淡黄色液体,则其晶体类型为_______ ;已知该化合物中每个原子都满足稳定结构,写出它的电子式_______ ;该物质遇水剧烈反应,生成两种产物,其中之一的分子构型为三角锥形,另一利物质具有漂白性,写出相关反应的化学方程式_______ 。
| ③ | ④ | ||||||||||||||||
| ① | ⑤ | ⑥ | |||||||||||||||
| ② | |||||||||||||||||
(1)元素⑤氢化物的结构式为
(2)元素④的氢化物沸点比元素⑤的氢化物沸点
(3)在一定条件下,元素③与⑥可形成一种化合物,常温下为淡黄色液体,则其晶体类型为
您最近一年使用:0次
名校
10 . 六种短周期元素在周期表中的相对位置如下所示,其中E元素原子核外电子总数是其最外层电子数的3倍。关于元素周期表及这六种元素性质,请回答:

(1)这六种元素的氢化物中,最稳定的是___________ .(写化学式);
(2)AF2的结构式为_____________ .
(3)在一定条件下,由B单质与H2反应生成1 molG气体时,放出的热量为46.2 kJ,写出该反应的热化学方程式:_____________________ .
(4)工业上用G检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质B生成,写出化学方程式__________________________ .该反应中被氧化的G与参与反应的G的质量之比__________ .
(5)F的单质可由其氧化物与氢化物反应生成,写出该反应的化学方程式:__________ .

(1)这六种元素的氢化物中,最稳定的是
(2)AF2的结构式为
(3)在一定条件下,由B单质与H2反应生成1 molG气体时,放出的热量为46.2 kJ,写出该反应的热化学方程式:
(4)工业上用G检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质B生成,写出化学方程式
(5)F的单质可由其氧化物与氢化物反应生成,写出该反应的化学方程式:
您最近一年使用:0次



