名校
1 . 19世纪中叶,门捷列夫总结了如表所示的元素化学性质的变化情况。请回答:
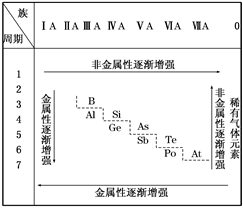
(1)门捷列夫的突出贡献是________ 。
A.提出了原子学说
B.提出了分子学说
C.发现了元素周期律
D.发现能量守恒定律
(2)该表变化表明________ 。
A.事物的性质总是在不断地发生变化
B.元素周期表中最右上角的氦元素是非金属性最强的元素
C.第ⅠA族元素的金属性肯定比同周期的第ⅡA族元素的金属性强
D.物质发生量变到一定程度必然引起质变
(3)按照表中元素的位置,认真观察从第ⅢA族的硼到第ⅦA族的砹连接的一条折线,我们能从分界线附近找到________ 。
A.耐高温材料 B.新型农药材料
C.半导体材料 D.新型催化剂材料
(4)据报道,美国科学家制得一种新原子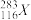 ,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是
,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是________ 。
A.这种原子的中子数为167
B.它位于元素周期表中第6周期
C.这种元素一定是金属元素
D.这种元素的原子易与氢化合

(1)门捷列夫的突出贡献是
A.提出了原子学说
B.提出了分子学说
C.发现了元素周期律
D.发现能量守恒定律
(2)该表变化表明
A.事物的性质总是在不断地发生变化
B.元素周期表中最右上角的氦元素是非金属性最强的元素
C.第ⅠA族元素的金属性肯定比同周期的第ⅡA族元素的金属性强
D.物质发生量变到一定程度必然引起质变
(3)按照表中元素的位置,认真观察从第ⅢA族的硼到第ⅦA族的砹连接的一条折线,我们能从分界线附近找到
A.耐高温材料 B.新型农药材料
C.半导体材料 D.新型催化剂材料
(4)据报道,美国科学家制得一种新原子
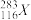 ,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是
,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是A.这种原子的中子数为167
B.它位于元素周期表中第6周期
C.这种元素一定是金属元素
D.这种元素的原子易与氢化合
您最近一年使用:0次
2017-05-02更新
|
259次组卷
|
3卷引用:浙江省温州中学2016-2017学年高一下学期期中考试化学试题
10-11高一下·浙江台州·期末
2 . 下表为元素周期表的一部分,元素①-⑦是短周期的主族元素,请参照元素①-⑥在表中的位置,回答下列问题:
(1)写出⑥在元素周期表中的位置_____ 。
(2)②的气态氢化物的沸点____ ⑥的气态氢化物的沸点。(填大于、小于或等于)
(3)④的最高价氧化物与③的最高价氧化物对应的水化物的水溶液反应的离子方程式为
_____ 。
(4)①和⑤形成的化合物是化工行业已合成的一种硬度很大、熔点很高的晶体,若已知在此化合物中各元素均处于其最高或最低价态,据此推断:该化合物的化学式可能是_____ , 与该化合物晶体类型相同的是______ (请用相应的编号填写)。
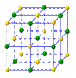
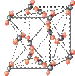

A B C
(5)由①和③形成的化合物甲和乙,甲受到撞击会分解生成一种固体单质和一种气体单质,此反应中反应物、固体单质和气体单质的物质的量之比是2:2:3;乙中加入过量的盐酸后生成两种盐,在其中一种盐中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体。则化合物甲的化学式为_____ ,化合物乙与过量盐酸反应的化学方程式为_____ 。
| ① | ② | |||||
| ③ | ④ | ⑤ | ⑥ | ⑦ |
(1)写出⑥在元素周期表中的位置
(2)②的气态氢化物的沸点
(3)④的最高价氧化物与③的最高价氧化物对应的水化物的水溶液反应的离子方程式为
(4)①和⑤形成的化合物是化工行业已合成的一种硬度很大、熔点很高的晶体,若已知在此化合物中各元素均处于其最高或最低价态,据此推断:该化合物的化学式可能是



A B C
(5)由①和③形成的化合物甲和乙,甲受到撞击会分解生成一种固体单质和一种气体单质,此反应中反应物、固体单质和气体单质的物质的量之比是2:2:3;乙中加入过量的盐酸后生成两种盐,在其中一种盐中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体。则化合物甲的化学式为
您最近一年使用:0次
10-11高三下·浙江绍兴·阶段练习
解题方法
3 . 下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
(1)④、⑥、⑦的离子半径由大到小的顺序为___________ 。
(2)1971年美国科学家通过细冰获得含元素④的含氧酸(HXO),在与水反应时,两种分子中的共价键分别断裂成两部分,再重新组合,写出该反应的化学方程式___________ 。
(3)①、②两种元素的原子按1:1组成的常见液态化合物的电子式为________ 。在酸性溶液中该物质能将Fe2+氧化,写出该反应的离子方程式___________ 。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气
体,D溶液显碱性。
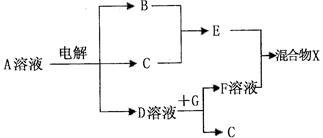
①写出D溶液与G反应的化学方程式_________________________________ 。
②常温下,若电解l L 0.1 mol/L A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为________ mol。
③若仅电解l L 0.1 mol/L A溶液,图中各步反应均为完全转化,而各物质在反应过程中没有损耗,则混合物X中含有的物质有_______________ 。
| ⅠA | 0 | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ④ | ||||||
| 3 | ⑤ | ③ | ⑥ | ⑦ | ||||
(1)④、⑥、⑦的离子半径由大到小的顺序为
(2)1971年美国科学家通过细冰获得含元素④的含氧酸(HXO),在与水反应时,两种分子中的共价键分别断裂成两部分,再重新组合,写出该反应的化学方程式
(3)①、②两种元素的原子按1:1组成的常见液态化合物的电子式为
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气
体,D溶液显碱性。

①写出D溶液与G反应的化学方程式
②常温下,若电解l L 0.1 mol/L A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为
③若仅电解l L 0.1 mol/L A溶液,图中各步反应均为完全转化,而各物质在反应过程中没有损耗,则混合物X中含有的物质有
您最近一年使用:0次
10-11高三·浙江·阶段练习
4 . 已知:氧化性:KMnO4>HNO3;Bi 元素+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行下列实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)Bi和P元素在同一主族,试写出P在周期表中的位置____________________ ;
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为__________________________ ;
(3)实验④中的现象为:_______________________________________________ ;
(4)实验②反应的离子方程式是:________________________________________ ;
(5)实验③反应的离子方程式是:_______________________________________ 。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)Bi和P元素在同一主族,试写出P在周期表中的位置
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为
(3)实验④中的现象为:
(4)实验②反应的离子方程式是:
(5)实验③反应的离子方程式是:
您最近一年使用:0次
9-10高一下·西藏拉萨·期末
5 . 超重元素的假设预言自然界中可能存在114号的稳定同位素X,请根据原子结构理论和元素周期律预测:
(1)X元素位于周期表中第____ 周期,_____ 族,为_____ 元素(金属或非金属)
(2)写出其最高价氧化物及其水化物的化学式分别为___________ 、__________ ,并估计后者为________ 性(填“酸”或“碱”)
(1)X元素位于周期表中第
(2)写出其最高价氧化物及其水化物的化学式分别为
您最近一年使用:0次
11-12高三上·浙江宁波·期中
6 . 下表为部分短周期元素化合价及相应氢化物沸点的数据:
已知:①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙。
请回答:
(1)表中属于第三周期元素的是_________________________ (用表中元素编号填写)。
(2)写出H的最高价氧化物的电子式:__________________________ ;
比较A、D、G三种简单阴离子的半径大小:r( ) >r( ) >r( ) (均用实际的元素符号表示)。
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________________ 。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是:______________________ 。
元素性质 | 元素编号 | |||||||
A | B | C | D | E | F | G | H | |
氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
已知:①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙。
请回答:
(1)表中属于第三周期元素的是
(2)写出H的最高价氧化物的电子式:
比较A、D、G三种简单阴离子的半径大小:r
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是:
您最近一年使用:0次
9-10高一下·浙江温州·期中
7 . 根据下表列出的前20号元素中部分元素的性质数据,完成下列题目。
注:原子半径的单位是埃(10-10m)。
(1) 元素⑦在周期表中的位置: ;
(2) 请写出编号为①、④、⑩的元素的名称:① 、④ 、⑩ ;
(3)写出元素③和⑤形成的三原子分子的结构式 、元素⑨的最高价氧化物对应的水化物的化学式 。
(4) 写出下列物质的电子式:元素⑦和⑧形成的化合物 、元素③与⑧及氢元素形成的碱 ;
(5) 现有三种物质:元素⑤的原子所形成的空间立体网状结构的物质A、元素③和⑤形成的有毒气体B、元素⑦和⑧形成的化合物C,请将A、B、C三种物质按熔点从高到低的顺序排列(用字母表示): 。
| 性质\编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高正价 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低负价 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
注:原子半径的单位是埃(10-10m)。
(1) 元素⑦在周期表中的位置: ;
(2) 请写出编号为①、④、⑩的元素的名称:① 、④ 、⑩ ;
(3)写出元素③和⑤形成的三原子分子的结构式 、元素⑨的最高价氧化物对应的水化物的化学式 。
(4) 写出下列物质的电子式:元素⑦和⑧形成的化合物 、元素③与⑧及氢元素形成的碱 ;
(5) 现有三种物质:元素⑤的原子所形成的空间立体网状结构的物质A、元素③和⑤形成的有毒气体B、元素⑦和⑧形成的化合物C,请将A、B、C三种物质按熔点从高到低的顺序排列(用字母表示): 。
您最近一年使用:0次



