解题方法
1 . 表为元素周期表的一部分,a、b、c……为其中几种元素。回答下列问题:
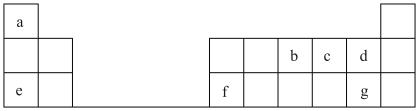
(1)写出b在元素周期表中的位置_______ 。
(2)元素d和g的气态氢化物中,更稳定的是_______ (写化学式)。
(3)元素d、e、g中原子半径由大到小的顺序为_______ (用元素符号表示)。
(4)元素e、g形成的化合物的电子式为_______ ,所含化学键类型为_______ 。
(5)a、c、e三种元素形成化合物的水溶液与g的最高价氧化物对应水化物反应的离子方程式:_______ 。

(1)写出b在元素周期表中的位置
(2)元素d和g的气态氢化物中,更稳定的是
(3)元素d、e、g中原子半径由大到小的顺序为
(4)元素e、g形成的化合物的电子式为
(5)a、c、e三种元素形成化合物的水溶液与g的最高价氧化物对应水化物反应的离子方程式:
您最近一年使用:0次
名校
解题方法
2 . 几种主族元素在周期表中的位置如下:
(1)①⑨形成的化合物属于___________ (填“离子化合物”或“共价化合物”),用电子式表示其形成过程___________ 。
(2)以上元素的最高价氧化物对应的水化物的酸性最强的分子式为___________ 。
(3)比较⑦、⑧简单氢化物的还原性:___________ (填化学式);比较①、⑥、⑦三种简单离子的半径大小,其由大到小的顺序___________ (填离子符号)。
(4)下列可以判断①和③金属性强弱的是___________(填字母)。
(5)金属镓 常用作光学玻璃、真空管、半导体的原料。
常用作光学玻璃、真空管、半导体的原料。
预测 的化学性质并填写表格:
的化学性质并填写表格:
以上预测都是依据___________ 。
 | 0 | |||||||
| 1 | ④ |  |  | 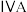 | 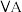 | 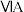 | 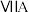 | |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ⑨ | ⑦ | ||||
| 4 | ② |  | ⑧ | |||||
(2)以上元素的最高价氧化物对应的水化物的酸性最强的分子式为
(3)比较⑦、⑧简单氢化物的还原性:
(4)下列可以判断①和③金属性强弱的是___________(填字母)。
A.单质的熔点: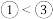 | B.化合价: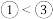 |
| C.单质与水反应的剧烈程度:①>③ | D.最高价氧化物对应水化物的碱性:①>③ |
 常用作光学玻璃、真空管、半导体的原料。
常用作光学玻璃、真空管、半导体的原料。预测
 的化学性质并填写表格:
的化学性质并填写表格:| 预测性质(所填物质类别不同) | 反应后可能的生成物(填化学式) |
 能与 能与 | 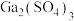 、 、 |
 能与 能与 | 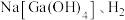 |
您最近一年使用:0次
名校
3 . 现代元素周期表是在门捷列夫首创的元素周期表基础上完善的。下图是扇形元素周期表,表中的“1、2、3、4”表示原子的核外电子层数,与现代元素周期表中的周期对应;“一、二、三……”与现代元素周期表中的族对应,共18列。①~⑨为现代元素周期表中1~18号元素。请按要求回答下列问题:_______ 。
(2)元素原子半径:②_______ (填“>”“<”或“=”,下同)⑥,比较最简单氢化物的热稳定性:⑤_______ ⑧。
(3)元素⑥形成的离子的结构示意图是_______ ,由元素⑥和元素⑨组成的常见化合物中所含化学键类型为_______ 。
(4)元素②⑥⑦的最高价氧化物对应的水化物中,碱性最强的是_______ (填化学式);写出元素⑦的最高价氧化物对应的水化物与元素⑨的最高价氧化物对应的水化物反应的离子方程式:_______ 。
(5)由①和⑤构成的原子个数比为1∶1的化合物与⑧的氢化物反应的化学方程式为_______ 。
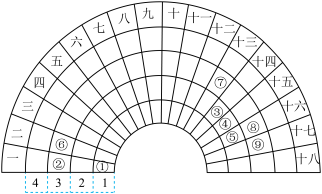
(2)元素原子半径:②
(3)元素⑥形成的离子的结构示意图是
(4)元素②⑥⑦的最高价氧化物对应的水化物中,碱性最强的是
(5)由①和⑤构成的原子个数比为1∶1的化合物与⑧的氢化物反应的化学方程式为
您最近一年使用:0次
2024-02-14更新
|
121次组卷
|
2卷引用:山东省青岛一中2023-2024学年高一下学期4月月考化学试卷
名校
解题方法
4 . 为纪念元素周期表诞生150周年,IUPAC等向世界介绍了118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“ ,
, 、
、 ”元素的代言人。回答下列问题:
”元素的代言人。回答下列问题:
(1)根据汞的原子结构示意图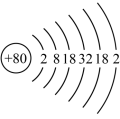 判断,汞在第
判断,汞在第___________ 周期。工业上冶炼金属汞的方法为___________ 。
(2)硒(Se)与硫位于同一主族,均是生命必需元素。下列推断不正确的是___________ 。
A.硒元素的最低负化合价为 价
价
B.还原性: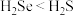
C.二氧化硒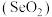 具有还原性
具有还原性
(3)氮是自然界各种生物体生命活动不可缺少的重要元素,磷(P)、砷(As)也是氮族元素。
①砷有多种同位素原子,其中稳定的核素是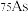 ,它的中子数为
,它的中子数为___________ 。
②已知 与
与 的性质相似,则对
的性质相似,则对 性质的推测正确的是
性质的推测正确的是___________ 。
A.含有离子键和共价键
B.能与 溶液反应
溶液反应
C.加热充分分解时与 分解产物的种类完全一样
分解产物的种类完全一样
③下列关于第ⅤA族元素及其化合物的说法正确的是___________ 。
A.热稳定性:
B.As的氧化物的水化物是强碱
C.简单离子半径随原子序数递增而增大
(4)砷酸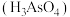 可用于制造杀虫剂、药物等。
可用于制造杀虫剂、药物等。 溶于稀硝酸中可得砷酸,此反应的化学方程式为
溶于稀硝酸中可得砷酸,此反应的化学方程式为___________ 。
 ,
, 、
、 ”元素的代言人。回答下列问题:
”元素的代言人。回答下列问题:(1)根据汞的原子结构示意图
 判断,汞在第
判断,汞在第(2)硒(Se)与硫位于同一主族,均是生命必需元素。下列推断不正确的是
A.硒元素的最低负化合价为
 价
价B.还原性:
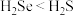
C.二氧化硒
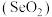 具有还原性
具有还原性(3)氮是自然界各种生物体生命活动不可缺少的重要元素,磷(P)、砷(As)也是氮族元素。
①砷有多种同位素原子,其中稳定的核素是
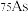 ,它的中子数为
,它的中子数为②已知
 与
与 的性质相似,则对
的性质相似,则对 性质的推测正确的是
性质的推测正确的是A.含有离子键和共价键
B.能与
 溶液反应
溶液反应C.加热充分分解时与
 分解产物的种类完全一样
分解产物的种类完全一样③下列关于第ⅤA族元素及其化合物的说法正确的是
A.热稳定性:

B.As的氧化物的水化物是强碱
C.简单离子半径随原子序数递增而增大
(4)砷酸
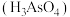 可用于制造杀虫剂、药物等。
可用于制造杀虫剂、药物等。 溶于稀硝酸中可得砷酸,此反应的化学方程式为
溶于稀硝酸中可得砷酸,此反应的化学方程式为
您最近一年使用:0次
2024-02-11更新
|
132次组卷
|
3卷引用:山东省东明县第一中学2023-2024学年高一下学期4月第一次月考化学试题
名校
解题方法
5 . 人体必需的一些元素在周期表中的分布情况如下:______ 。 是一种绿色氧化剂,电子式为
是一种绿色氧化剂,电子式为________ 。
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将 通入水中,可以得到一种具有漂白性的分子,写出它的结构式
通入水中,可以得到一种具有漂白性的分子,写出它的结构式________ 。
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是________ ,原子序数为____ 。
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性 溶液中加入
溶液中加入 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为___________ 。
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是_______(填字母)。

 是一种绿色氧化剂,电子式为
是一种绿色氧化剂,电子式为(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将
 通入水中,可以得到一种具有漂白性的分子,写出它的结构式
通入水中,可以得到一种具有漂白性的分子,写出它的结构式(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性
 溶液中加入
溶液中加入 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是_______(填字母)。
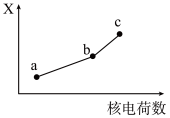
| A.若a、b、c表示氧族元素,则X表示对应氢化物的沸点 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第ⅠA族元素,则X表示对应离子的氧化性 |
| D.若a、b、c表示第ⅡA族元素,则X表示最高价氧化物对应水化物的碱性 |
您最近一年使用:0次
2024-01-24更新
|
68次组卷
|
2卷引用:山东省邹城市第二中学2023-2024学年高一上学期12月月考化学试题
6 . 合成氨是人类科学技术发展史上的一项重大成就,是化学和技术对社会发展与进步的巨大贡献。
(1)基态氮原子中,能量最高的电子的电子云在空间有___________ 个伸展方向。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“ ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为___________ 。
(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有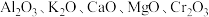 等氧化物中的几种。
等氧化物中的几种。
①Cr原子的价电子排布图为___________ ;第四周期ds区元素中,与基态Cr原子最外层电子数目相同的元素的元素符号为___________ 。
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有___________ (填元素符号)。
(4)我国科研人员研制出了 (M为Fe、Mn等金属)等催化剂,使得合成氨工业温度,压强分别降到了350℃、
(M为Fe、Mn等金属)等催化剂,使得合成氨工业温度,压强分别降到了350℃、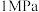 ,这是近年来合成氨反应研究中的重要突破。第三电离能
,这是近年来合成氨反应研究中的重要突破。第三电离能
___________ 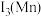 (填“>”或“<”),原因是
(填“>”或“<”),原因是___________ 。
(1)基态氮原子中,能量最高的电子的电子云在空间有
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“
 ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有
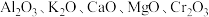 等氧化物中的几种。
等氧化物中的几种。①Cr原子的价电子排布图为
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有
(4)我国科研人员研制出了
 (M为Fe、Mn等金属)等催化剂,使得合成氨工业温度,压强分别降到了350℃、
(M为Fe、Mn等金属)等催化剂,使得合成氨工业温度,压强分别降到了350℃、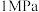 ,这是近年来合成氨反应研究中的重要突破。第三电离能
,这是近年来合成氨反应研究中的重要突破。第三电离能
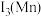 (填“>”或“<”),原因是
(填“>”或“<”),原因是
您最近一年使用:0次
7 . 黑火药的爆炸反应原理为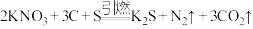 。请回答下列问题:
。请回答下列问题:
(1)基态 原子核外有
原子核外有___________ 种空间运动状态的电子。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为
表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为___________ 。
(3)K位于周期表的___________ 区;基态钾离子的电子占据的最高能层符号是___________ 。
(4) 与
与 具有相同的电子构型,
具有相同的电子构型, 小于
小于 ,原因是
,原因是___________ 。
(5)下列曲线表示氧族元素性质随核电荷数的变化趋势,正确的是___________ 。
a.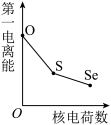 b.
b.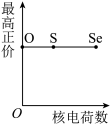 c.
c.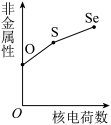 d.
d.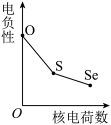
(6)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲和能 。
。 的Born-Haber循环如图所示。
的Born-Haber循环如图所示。

由图可知, 原子的第二电离能为
原子的第二电离能为___________  ;
; 键的键能为
键的键能为___________  ;氧原子的第一电子亲和能为
;氧原子的第一电子亲和能为___________  ;
; 的晶格能为
的晶格能为___________  。
。
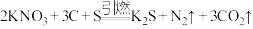 。请回答下列问题:
。请回答下列问题:(1)基态
 原子核外有
原子核外有(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为
表示称为电子的自旋磁量子数。对于基态的N原子,其价电子自旋磁量子数的代数和为(3)K位于周期表的
(4)
 与
与 具有相同的电子构型,
具有相同的电子构型,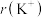 小于
小于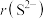 ,原因是
,原因是(5)下列曲线表示氧族元素性质随核电荷数的变化趋势,正确的是
a.
 b.
b. c.
c. d.
d.
(6)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲和能
 。
。 的Born-Haber循环如图所示。
的Born-Haber循环如图所示。
由图可知,
 原子的第二电离能为
原子的第二电离能为 ;
; 键的键能为
键的键能为 ;氧原子的第一电子亲和能为
;氧原子的第一电子亲和能为 ;
; 的晶格能为
的晶格能为 。
。
您最近一年使用:0次
8 . 合成氨是人类科学技术发展史上的一项重大成就,是化学和技术对社会发展与进步的巨大贡献。
(1)基态氮原子中,能量最高的电子的电子云在空间有_______ 个伸展方向。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“ ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为_______ 。
(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有 、
、 、CaO、MgO、
、CaO、MgO、 等氧化物中的几种。
等氧化物中的几种。
①Cr原子的价电子排布图为_______ ;第四周期ds区元素中,与基态Cr原子最外层电子数目相同的元素的元素符号为_______ 。
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有_______ (填元素符号)
(4)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①Mn在元素周期表中的位置_______ ,基态Mn原子未成对的电子数为_______ 。
②第三电离能
_______ 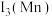 (填“>”或“<”),原因是
(填“>”或“<”),原因是_______ 。
(1)基态氮原子中,能量最高的电子的电子云在空间有
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“
 ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有
 、
、 、CaO、MgO、
、CaO、MgO、 等氧化物中的几种。
等氧化物中的几种。①Cr原子的价电子排布图为
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有
(4)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①Mn在元素周期表中的位置
②第三电离能

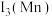 (填“>”或“<”),原因是
(填“>”或“<”),原因是
您最近一年使用:0次
2023-02-14更新
|
662次组卷
|
3卷引用:山东省泰安市2022-2023学年高二上学期期末考试化学试题
名校
9 . 下表列出9种元素在元素周期表(元素周期表只给出部分)中的位置
请回答下列问题:
(1)考古工作者利用某元素的一种核素测定一些文物的年代,这种核素的元素符号是_______ 。
(2)写出由元素②和元素④形成原子个数比为1∶2的化合物的电子式:_______ 。
(3)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式为_______
(4)③、④、⑤三种元素的简单氢化物稳定性顺序是_______ (填化学式;用“>”连接)。
(5)表中的ⅠA族、ⅡA族元素全部是金属元素,这种判断_______ (填“正确”或“错误”);根据元素周期律,自然界中最强的碱是_______ (填化学式)。
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | |||||
| 4 | ⑨ |
(1)考古工作者利用某元素的一种核素测定一些文物的年代,这种核素的元素符号是
(2)写出由元素②和元素④形成原子个数比为1∶2的化合物的电子式:
(3)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式为
(4)③、④、⑤三种元素的简单氢化物稳定性顺序是
(5)表中的ⅠA族、ⅡA族元素全部是金属元素,这种判断
您最近一年使用:0次
2023-01-16更新
|
410次组卷
|
4卷引用:山东省莘县多校2022-2023学年高一上学期期末线上联考化学试题
山东省莘县多校2022-2023学年高一上学期期末线上联考化学试题(已下线)【知识图鉴】单元讲练测必修第一册第四单元03巩固练安徽省六安市金寨县青山中学2023-2024学年高一下学期第一次月考化学试题江西省宜春市万载县万载二中 2023?2024 学年高一上学期期末模拟考试化学试卷
解题方法
10 . 下图是元素周期表的一部分。按要求填写下列空白:
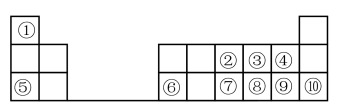
(1)元素⑦在周期表中的位置可表示为_______ 。
(2)④、⑧、⑨的简单离子半径的大小顺序为_______ (填离子符号)。
(3)①-⑩元素的最高价氧化物对应的水化物中,酸性最强的是_______ (填化学式)。
(4)④⑧⑨三种元素形成的气态氢化物稳定性由大到小的顺序是_______ (用化学式表示)。
(5)⑤的最高价氧化物对应的水化物的电子式为_______ ;⑧的氢化物的结构式为_______
(6)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是_______ 。
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱

(1)元素⑦在周期表中的位置可表示为
(2)④、⑧、⑨的简单离子半径的大小顺序为
(3)①-⑩元素的最高价氧化物对应的水化物中,酸性最强的是
(4)④⑧⑨三种元素形成的气态氢化物稳定性由大到小的顺序是
(5)⑤的最高价氧化物对应的水化物的电子式为
(6)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
您最近一年使用:0次
2022-12-21更新
|
348次组卷
|
2卷引用:山东省临沂滨河高级中学2022-2023学年高一上学期线上期末考试化学试题



