1 . 在日常生活中,为了达到更好的清洁效果,经常有人会将洁厕液(含有盐酸)与84消毒液混合使用,从而会发生引发中毒的事故。
(1)两种日化产品主要成分中都含有氯元素,该元素在元素周期表中位置是_______ 。
(2)84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式:_______ 。
(3)洁厕灵的主要成分是HCl。下列关于卤化氢的性质比较中错误的是_______。
(4)常温下,0.1mol/L的NaClO溶液的PH=9.7,原因_______ 。常温下HClO的电离平衡常数为_______ 。洁厕液与84消毒液混合后会生成有毒的氯气。写出该反应的离子方程式_______ 。
(5)高铁酸钾是一种高效多功能水处理剂,工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为_______ 。
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH
K2FeO4在水溶液中易水解:4 +10H2O⇌4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
+10H2O⇌4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______ 溶液(填序号)
a.水 b.NH4Cl、异丙醇 c.Fe(NO3)3、异丙醇 d.CH3COONa、异丙醇
(6)消毒效率是物质单位质量得到的电子数,则Cl2与NaClO两种消毒剂的消毒效率之比为__ 。
(1)两种日化产品主要成分中都含有氯元素,该元素在元素周期表中位置是
(2)84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式:
(3)洁厕灵的主要成分是HCl。下列关于卤化氢的性质比较中错误的是_______。
| A.酸性:HF>HCl>HBr>HI | B.键能:H—F>H—Cl>H—Br>H—I |
| C.熔点:HF<HCl<HBr<HI | D.还原性:HF<HCl<HBr<HI |
(5)高铁酸钾是一种高效多功能水处理剂,工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH
K2FeO4在水溶液中易水解:4
 +10H2O⇌4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
+10H2O⇌4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用a.水 b.NH4Cl、异丙醇 c.Fe(NO3)3、异丙醇 d.CH3COONa、异丙醇
(6)消毒效率是物质单位质量得到的电子数,则Cl2与NaClO两种消毒剂的消毒效率之比为
您最近一年使用:0次
11-12高一下·河北邢台·阶段练习
名校
2 . 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等。请回答下列问题:
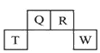
(1)T的原子结构示意图为______________________ 。
(2)元素的非金属性(原子的得电子能力):Q_______________ W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为__________________________________ 。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________________________________________________ 。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是______________ 。

(1)T的原子结构示意图为
(2)元素的非金属性(原子的得电子能力):Q
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是
您最近一年使用:0次
2016-12-09更新
|
241次组卷
|
10卷引用:山东省潍坊市临朐县实验中学2022届高三9月摸底考试化学试题
山东省潍坊市临朐县实验中学2022届高三9月摸底考试化学试题(已下线)2011-2012学年河北省邢台一中高一下学期第二次月考化学试卷2014-2015福建省福州市第八中学高一下学期期中化学试卷2015-2016学年海南琼海市嘉积中学高一下期中理科化学卷2016-2017学年河北省邯郸市大名县第一中学高一3月月考化学试卷2016-2017学年河南省林州市第一中学高一3月调研考试化学试卷江西省南昌市八一中学、洪都中学、麻丘中学、十七中、桑海中学2016-2017学年高一下学期期中考试化学试题江苏省泰州中学2016-2017学年高一5月月度检测化学试题四川省南充市白塔中学2021-2022学年高一下学期期中考试化学试题安徽省砀山县第四中学2021-2022学年高一下学期第一阶段教学质量检测 化学试题
解题方法
3 . 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于_____ 晶体;Ni元素在元素周期表中的位置是第________ 周期,第________ 族;镍有54Ni和58 Ni两种原子,它们互称为__________ 。
(2)如图所示配合物分子内的作用力有________ (填编号)。
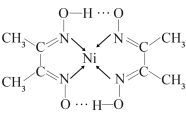
E.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③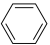 、④HCHO等,其中分子属于平面结构的有
、④HCHO等,其中分子属于平面结构的有______ (填物质序号),预测HCHO分子的立体结构为______ 形。
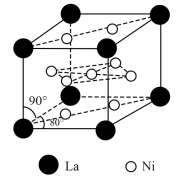
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为______ 。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于
(2)如图所示配合物分子内的作用力有

| A.氢键 |
| B.离子键 |
| C.共价键 |
| D.金属键 |
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③
 、④HCHO等,其中分子属于平面结构的有
、④HCHO等,其中分子属于平面结构的有(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为

您最近一年使用:0次
9-10高一下·福建龙岩·期中
4 . 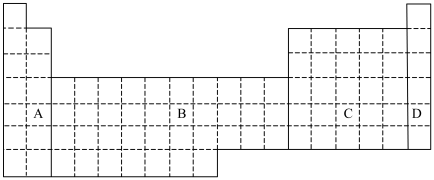
(1)在上面元素周期表中的A、B、、C、D四个区域中,全部是金属元素的区域为___________ 。
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等_____ 。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素,金属性较强的是_____ (填名称),能验证该结论的实验是___ (填编号)
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素单质的粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性

(1)在上面元素周期表中的A、B、、C、D四个区域中,全部是金属元素的区域为
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素,金属性较强的是
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素单质的粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
您最近一年使用:0次
名校
5 . 如表是元素周期表的一部分,其中每个数字序号代表一种短周期元素.

请按要求回答下列问题:
(1)元素③的最高价氧化物对应的水化物的化学式为_______________ ;
(2)②、③两元素的原子半径较大的是___________ (填元素符号);
(3)④和⑤两种元素的金属性较强的是____________ (填元素符号);
(4)元素③和元素⑥的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式___________________ .

请按要求回答下列问题:
(1)元素③的最高价氧化物对应的水化物的化学式为
(2)②、③两元素的原子半径较大的是
(3)④和⑤两种元素的金属性较强的是
(4)元素③和元素⑥的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式
您最近一年使用:0次
2016-12-09更新
|
273次组卷
|
4卷引用:山东省济南第一中学2016-2017学年高二5月学考模拟化学试题
10-11高一下·山东威海·期末
6 . 下表是元素周期表的一部分,请依据该表回答问题。
(1)下列说法正确的是( )
A.可用于半导体材料的元素是碳
B.PH3的稳定性比H2S强
C.第VA族元素的最高价氧化物对应的水化物化学式均为H3RO4
D.H2SiO3的酸性比H3PO4弱
E.NaOH的碱性比Mg(OH)2强
(2)第2周期VIIA族元素的原子结构示意图是_______________ ,该元素与同周期IA族元素组成的化合物类型是。_______________
(3)第3周期元素的最高价氧化物对应水化物中,酸性最强的是_______________ (填化学式,下同);碱性最强的是 _______________ ;具有两性的是 _______________ 。
| 族 周期 | IA | 0 | ||||||
| 1 | H | IIA | IIIA | IVA | VA | VIA | VIIA | He |
| 2 | Li | Be | B | C | N | O | F | Ne |
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar |
(1)下列说法正确的是
A.可用于半导体材料的元素是碳
B.PH3的稳定性比H2S强
C.第VA族元素的最高价氧化物对应的水化物化学式均为H3RO4
D.H2SiO3的酸性比H3PO4弱
E.NaOH的碱性比Mg(OH)2强
(2)第2周期VIIA族元素的原子结构示意图是
(3)第3周期元素的最高价氧化物对应水化物中,酸性最强的是
您最近一年使用:0次
10-11高二下·山东济宁·期中
7 . (1)以基态硅原子为例,如果电子排布式写作ls22s22p63s13p3则违反了_______ 原理,如写作ls22s22p63s33p1则违反了_______ 原理;
(2)已知H、C、Si三种元素的电负性依次为2.1、2.5、1.8,则CH4、SiH4中C、Si的化合价依次为_______ 、_______ ;
(3)在我们现今使用的元素周期表中,元素种类最多的族是_______ 族,共_______ 种元素;元素种类最多的周期是第_______ 周期,共_______ 种元素;
(4)熔点: F2_______ Cl2(填“<”或“=”“或>”,下同),沸点:HF_______ HCl,一定压强下HF和HCl的混合气体降温时_______ (填HF或HCl)先液化;
(5)前三周期元素中,基态原子中未成对电子数与其所在周期序数相同的元素:_______ (用元素符号按原子序数由小到大排列)。
(2)已知H、C、Si三种元素的电负性依次为2.1、2.5、1.8,则CH4、SiH4中C、Si的化合价依次为
(3)在我们现今使用的元素周期表中,元素种类最多的族是
(4)熔点: F2
(5)前三周期元素中,基态原子中未成对电子数与其所在周期序数相同的元素:
您最近一年使用:0次
10-11高一·山东聊城·阶段练习
8 . 下表是元素周期表的一部分
(1)写出元素符号: B.________ C______ 、D________ 、E_______ ;
(2)D- 离子结构示意图___________ ,B+ 离子结构示意图______________ ,
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ||||||||
2 | D | |||||||
3 | B | C | E | |||||
4 | A |
(1)写出元素符号: B.
(2)D- 离子结构示意图
您最近一年使用:0次
9-10高一下·山东济宁·期中
9 . 已知X、Y、Z、W四种元素分布在元素周期表中的三个不同短周期元素里,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)写出X、Y的元素符号:X_______ 、Y_______ ;
(2)W在元素周期表中的位置是_______ ;Z的原子结构示意图_______
(3)由X、Y、Z所形成的离子化合物的化学式是_______ ,它与W的最高价氧化物的水化物的溶液反应时的离子方程式是_______ ;
(4)用电子式表示Y的氢化物的形成过程_______ 。
(1)写出X、Y的元素符号:X
(2)W在元素周期表中的位置是
(3)由X、Y、Z所形成的离子化合物的化学式是
(4)用电子式表示Y的氢化物的形成过程
您最近一年使用:0次
11-12高三上·山东聊城·期中
10 . W、X、Y、Z是原子序数逐渐增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1) X的原子结构示意图为____________ 。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为______________ 。
(3) W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的化学方程式为_________________________________________ 。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_______________________ 。
(5)比较Y、Z气态氢化物的稳定性_________ >_______ (用分子式表示)
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:_____ >_____ >______ >______ 。(用“离子符号”表示)
(1) X的原子结构示意图为
(2)W与Y 可形成化合物W2Y,该化合物的电子式为
(3) W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的化学方程式为
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为
(5)比较Y、Z气态氢化物的稳定性
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:
您最近一年使用:0次



