名校
解题方法
1 . 已知元素周期表中共有18纵行。如图所示实线表示元周期表的边界,按电子排布,可把元素周期表划分为s区、p区、d区、ds等,除ds区外,其他区的名称均按构造原理最后填入电子的能级符号来命名。
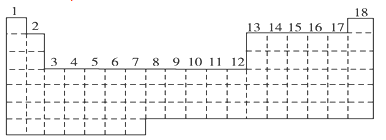
(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并标记分区_____ 。
(2)有的同学受这种划分的启示,认为d区内6、7纵行的部分元素可以排在另一区,你认为应排在___________ 区。
(3)请在元素周期表中标出4s轨道半充满的元素(用元素符号表示)_____ 。
(4)请利用电子排布的相关知识解释Fe3+比Fe2+稳定的原因:___________ 。
(5)随着科学技术的发展,不断有新的元素被发现。现在第七周期已经排满,则元素周期表共可以排布___________ 种元素。

(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并标记分区
(2)有的同学受这种划分的启示,认为d区内6、7纵行的部分元素可以排在另一区,你认为应排在
(3)请在元素周期表中标出4s轨道半充满的元素(用元素符号表示)
(4)请利用电子排布的相关知识解释Fe3+比Fe2+稳定的原因:
(5)随着科学技术的发展,不断有新的元素被发现。现在第七周期已经排满,则元素周期表共可以排布
您最近一年使用:0次
2022-10-20更新
|
156次组卷
|
2卷引用:云南省玉溪市华宁县第二中学2021-2022年高二下学期开学考试化学试题
名校
2 . 随着原子序数的递增,七种短周期元素的原子半径的相对大小、最高正化合价或最低负化合价的变化如图所示。请回答下列问题:
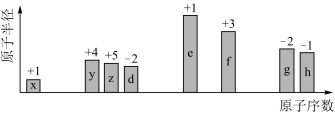
(1)x在元素周期表中的位置是___________ ,如果x的某种原子中含2个中子,则该原子的核素符号为___________ 。
(2)y的最简单氢化物中含有的化学键类型为___________ (填“离子键”“极性共价键”或“非极性共价键”)。
(3)d、e、f的简单离子半径由大到小的顺序为___________ (用离子符号表示)。
(4) e的单质在空气中充分燃烧,所得产物的电子式为___________ 。
(5)f的单质和e的最高价氧化物对应的水化物相互反应的化学方程式为___________ 。
(6)能说明h的非金属性比g的强的实验事实是___________ (列举一条)。

(1)x在元素周期表中的位置是
(2)y的最简单氢化物中含有的化学键类型为
(3)d、e、f的简单离子半径由大到小的顺序为
(4) e的单质在空气中充分燃烧,所得产物的电子式为
(5)f的单质和e的最高价氧化物对应的水化物相互反应的化学方程式为
(6)能说明h的非金属性比g的强的实验事实是
您最近一年使用:0次
名校
3 . 联合国大会将2019年定为“化学元素周期表国际年”,高度体现了元素周期表的重要性,图中表示了元素周期表短周期的一部分,①~⑦代表7种短周期元素。
(1)写出七种元素中化学性质最不活泼的元素形成的单质的化学式_______ 。
(2)元素②的最低价阴离子的离子结构示意图是_______ 。
(3)②、⑤两种元素的最简单氢化物中稳定性较强的是_______ (填化学式)。
(4)⑤、⑥两种元素的最高价氧化物对应的水化物中,酸性较弱的是_______ (填化学式)。
(5)元素③最高价氧化物对应水化物与元素④的单质反应的离子方程式为:_______ 。
| ① | ② | |||||||
| ③ | ④ | ⑤ | ⑥ | ⑦ |
(1)写出七种元素中化学性质最不活泼的元素形成的单质的化学式
(2)元素②的最低价阴离子的离子结构示意图是
(3)②、⑤两种元素的最简单氢化物中稳定性较强的是
(4)⑤、⑥两种元素的最高价氧化物对应的水化物中,酸性较弱的是
(5)元素③最高价氧化物对应水化物与元素④的单质反应的离子方程式为:
您最近一年使用:0次
2022-04-09更新
|
536次组卷
|
2卷引用:云南省昆明市第一中学2021-2022学年高一上学期期末考试化学试题
名校
解题方法
4 . 下表为元素周期表的一部分,其中的编号代表对应的元素。
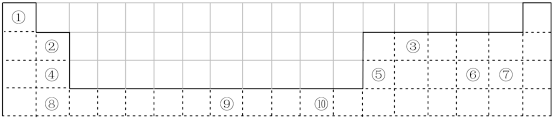
请回答下列问题:
(1)表中属于d区的元素是___________ (填编号)。
(2)写出元素⑨的基态原子的电子排布式:___________ 。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为___________ 对。
(4)写出p区中最高价氧化物对应的水化物酸性最强元素原子的价电子排布图为___________ 。

请回答下列问题:
(1)表中属于d区的元素是
(2)写出元素⑨的基态原子的电子排布式:
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为
(4)写出p区中最高价氧化物对应的水化物酸性最强元素原子的价电子排布图为
您最近一年使用:0次
5 . 元素在周期表中的位置,反映了元素的原子结构和性质。下图是元素周期表的一部分,请按要求回答下列问题。
(1)元素⑤位于周期表中的第___________ 周期第___________ 族。
(2)④⑥两种元素形成的化合物可用作防腐剂,常用于腌制食物,该化合物的电子式为______ ,高温灼烧该化合物时,火焰呈________ 色。
(3)①②③三种元素中,原子半径最小的是___________ (填元素符号)。
(4)④⑦两种元素最高价氧化物对应的水化物碱性较强的是___________ (填化学式)。
(5)①⑥两种元素的简单氢化物相遇会迅速反应,产生大量白烟,请写出该反应的化学方程式_____ 。
| He | |||||||||||||||||
| ① | ② | ③ | Ne | ||||||||||||||
| ④ | ⑤ | ⑥ | Ar | ||||||||||||||
| ⑦ | Kr |
(2)④⑥两种元素形成的化合物可用作防腐剂,常用于腌制食物,该化合物的电子式为
(3)①②③三种元素中,原子半径最小的是
(4)④⑦两种元素最高价氧化物对应的水化物碱性较强的是
(5)①⑥两种元素的简单氢化物相遇会迅速反应,产生大量白烟,请写出该反应的化学方程式
您最近一年使用:0次
2022-01-11更新
|
619次组卷
|
2卷引用:云南省2021年高二上学期期末普通高中学业水平考试化学(新教材)试题
解题方法
6 . 下表是元素周期表的一部分,按要求完成各小题。
(1)元素①的原子结构示意图为_______ ,元素④的原子的电子式为_______ 。
(2)元素②的最简单氢化物的化学式为_______ , 该物质与O2完全燃烧时的化学反应方程式为_______ 。
(3)上述6种元素对应的化合物中,最高价氧化物对应水化物碱性最强的是_______ (填化学式),最高价氧化物对应水化物具有两性的是_______ (填化学式),两者发生反应的离子方程式为_______ 。
| ① | He | ||||||
| ② | ③ | Ne | |||||
| ④ | ⑤ | ⑥ | Ar |
(2)元素②的最简单氢化物的化学式为
(3)上述6种元素对应的化合物中,最高价氧化物对应水化物碱性最强的是
您最近一年使用:0次
名校
7 . 下表列出了①~⑤五种元素在周期表中的位置:
按要求回答下列问题:
(1)元素⑥的最高正化合价是___________ 。
(2)元素⑤在周期表中的位置是___________ 。
(3)元素②和元素③的非金属性强弱关系是②___________ ③(选填“>”或“<”);表中所列六种元素的单质,常温下为有色气体的是___________ (填化学式)。
(4)①~⑥六种元素中原子半径最大 的是___________ (填元素符号)。②③两种元素的最简单氢化物中最稳定 的是___________ (填化学式)
(5)元素③与元素④能形成原子个数比为1:1的化合物 Y,Y 在常温下为固态,焰色反应为黄色,常用与呼吸面具中做供氧剂。写出Y与水反应的化学方程式:___________ 。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | |||||
按要求回答下列问题:
(1)元素⑥的最高正化合价是
(2)元素⑤在周期表中的位置是
(3)元素②和元素③的非金属性强弱关系是②
(4)①~⑥六种元素中原子半径
(5)元素③与元素④能形成原子个数比为1:1的化合物 Y,Y 在常温下为固态,焰色反应为黄色,常用与呼吸面具中做供氧剂。写出Y与水反应的化学方程式:
您最近一年使用:0次
2021-11-12更新
|
1014次组卷
|
6卷引用:云南省弥勒市第二中学2020-2021学年高一下学期期中考试化学试题
云南省弥勒市第二中学2020-2021学年高一下学期期中考试化学试题专题八 原子结构与元素周期表(A卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)(已下线)易错专题28 元素周期律-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)陕西省西安市鄠邑区2021-2022学年高一下学期期中考试化学试题西藏林芝市第二高级中学2021-2022学年高三下学期第四次月考理综化学试题福建省厦门第二中学2022-2023学年高一下学期4月月考化学试题
名校
8 . 已知A、B两种元素,A的原子序数为x,A和B所在周期的元素种类数目分别为m和n。
(1)如果A和B同在IA族,当B在A的上一周期时,B的原子序数为___________ ,当B在A的下一周期时,B的原子序数为___________ ;
(2)如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为___________ ;当B在A的下一周期时,B的原子序数为___________ 。
(1)如果A和B同在IA族,当B在A的上一周期时,B的原子序数为
(2)如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为
您最近一年使用:0次
2021-09-02更新
|
662次组卷
|
4卷引用:云南省曲靖市罗平县第二中学2019-2020学年高一下学期期中考试化学试题
云南省曲靖市罗平县第二中学2019-2020学年高一下学期期中考试化学试题(已下线)4.1.2 元素周期表 核素-2021-2022学年高一化学课后培优练(人教版2019必修第一册)(已下线)5.1.2 元素周期表(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)海南省琼海市嘉积中学2023-2024学年高一上学期期末考试化学试题B卷
解题方法
9 . 如表列出了①~⑦七种元素在周期表中的位置:
请按要求回答下列问题:
(1)元素③的原子结构示意图是___________ ,以上元素的最高价氧化物形成的水化物酸性最强的是___________ (填分子式)。
(2)②、③、⑥三种元素的原子形成的简单离子半径由大到小的顺序排列为___________ (用离子符号表示)。
(3)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为___________ 。
(4)②和⑦按原子个数比1:1形成离子化合物乙的电子式为___________
(5)下列物质中,互为同系物的是___________ ,互为同分异构体的是___________ ,互为同素异形体的是___________ ,属于同位素的是___________ 。
①正戊烷 ②白磷 ③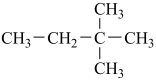 ④
④ ⑤
⑤ ⑥红磷 ⑦
⑥红磷 ⑦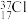
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 二 | ① | ⑦ | ||||||
| 三 | ② | ③ | ④ | ⑤ | ⑥ |
请按要求回答下列问题:
(1)元素③的原子结构示意图是
(2)②、③、⑥三种元素的原子形成的简单离子半径由大到小的顺序排列为
(3)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为
(4)②和⑦按原子个数比1:1形成离子化合物乙的电子式为
(5)下列物质中,互为同系物的是
①正戊烷 ②白磷 ③
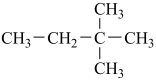 ④
④ ⑤
⑤ ⑥红磷 ⑦
⑥红磷 ⑦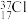
您最近一年使用:0次
2021-06-30更新
|
269次组卷
|
2卷引用:云南省玉溪市江川区第二中学2020-2021学年高一下学期期末考试化学试卷
名校
10 . 元素周期表的建立是化学发展史上重要的里程碑之一,它揭示了元素之间的内在联系。如图是元素周期表的短周期示意图,相应方格中每个序号代表处于该位置的一种元素。
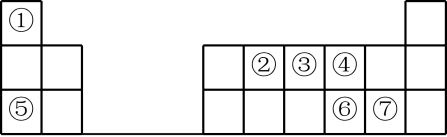
请回答下列问题:
(1)元素①的名称为_______ 。
(2)元素③的最高价氧化物的水化物为_______ (填化学式)
(3)⑥和⑦两种元素的气态氢化物中稳定性较强的是_______ (填化学式)。
(4)②和④两种元素形成的常见气态化合物中化学键类型为_______ 。
(5)⑤和⑦两种元素形成的化合物的电子式为_______ 。
(6)⑦的单质与⑤的最高价氧化物对应水化物反应的化学方程式为_______ 。

请回答下列问题:
(1)元素①的名称为
(2)元素③的最高价氧化物的水化物为
(3)⑥和⑦两种元素的气态氢化物中稳定性较强的是
(4)②和④两种元素形成的常见气态化合物中化学键类型为
(5)⑤和⑦两种元素形成的化合物的电子式为
(6)⑦的单质与⑤的最高价氧化物对应水化物反应的化学方程式为
您最近一年使用:0次



