名校
解题方法
1 . 根据要求填空:
(1)A元素原子的M层电子数是其电子总数的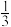 ,则其原子结构示意图为
,则其原子结构示意图为__ ;其简单离子的电子式为___ 。
(2)下列图示表示同种元素的是___ ;化学性质相似的是___ ;属于离子的是__ 。
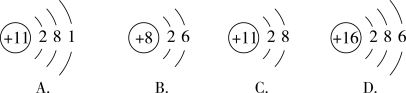
(3)已知Mm+与Nn-具有相同的电子层结构,若N的核电荷数为a,M的质量数为A,则M的中子数为__ ,两者形成的化合物的化学式可能为__ 。
(1)A元素原子的M层电子数是其电子总数的
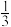 ,则其原子结构示意图为
,则其原子结构示意图为(2)下列图示表示同种元素的是
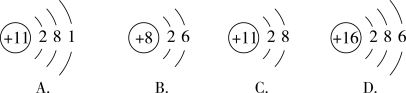
(3)已知Mm+与Nn-具有相同的电子层结构,若N的核电荷数为a,M的质量数为A,则M的中子数为
您最近一年使用:0次
2 . 写出符合下列要求的单原子形成的微粒的结构示意图。
(1)核内有10个质子的原子___ 。
(2)核外有10个电子的一价阴离子___ 。
(3)核外有18个电子的二价阳离子___ 。
(1)核内有10个质子的原子
(2)核外有10个电子的一价阴离子
(3)核外有18个电子的二价阳离子
您最近一年使用:0次
名校
解题方法
3 . 用化学用语回答下列问题
(1)画出钾原子的原子结构示意图:____________ 。
(2)写出氨分子的结构式:__________________ 。
(3)用电子式表示氟化钙(CaF2)的形成过程:_________________ 。
(4)完成下表
(1)画出钾原子的原子结构示意图:
(2)写出氨分子的结构式:
(3)用电子式表示氟化钙(CaF2)的形成过程:
(4)完成下表
| K层为最外层时,最多能容纳的电子数 | |
| 除K层外,其他各层为最外层时,最多能容纳的电子数 | |
| 次外层最多能容纳的电子数 | |
| 倒数第3层最多能容纳的电子数 | |
| 第n层里最多能容纳的电子数 |
您最近一年使用:0次
名校
解题方法
4 . 按要求填空:
(1)在第二周期中(稀有气体除外),第一电离能最大的元素的原子结构示意图是___ ,第一电离能最小的元素的电子排布图为___ 。
(2)以下是一些原子的2p能级和3d能级中电子排布的情况.试判断,哪些违反了泡利不相容原理,哪些违反了洪特规则。
① ②
② ③
③ ④
④ ⑤
⑤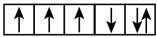 ⑥
⑥
违反泡利不相容原理的有__ ,违反洪特规则的有___ 。
(3)用VSEPR模型和杂化轨道理论相关知识填表:
(1)在第二周期中(稀有气体除外),第一电离能最大的元素的原子结构示意图是
(2)以下是一些原子的2p能级和3d能级中电子排布的情况.试判断,哪些违反了泡利不相容原理,哪些违反了洪特规则。
①
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥
违反泡利不相容原理的有
(3)用VSEPR模型和杂化轨道理论相关知识填表:
| 分子或离子 | 中心原子轨道杂化形式 | 分子或离子的立体结构 | 分子有无极性 |
| CH2O | |||
| NH4+ | |||
| CS2 |
您最近一年使用:0次
解题方法
5 . (1)画出下列元素的原子结构示意图。
①核电荷数为13的元素:_______ 。
②最外层电子数等于次外层电子数的元素原子:______ 。
(2)现有粒子:1H、35Cl、2H、14N、2H37Cl,其中:
①有_________ 种元素;
②__________ 之间互称同位素。
①核电荷数为13的元素:
②最外层电子数等于次外层电子数的元素原子:
(2)现有粒子:1H、35Cl、2H、14N、2H37Cl,其中:
①有
②
您最近一年使用:0次
2012·上海浦东新·三模
6 . 硼矿是无机盐工业的重要原料,硼镁石用硫酸分解的反应式为2MgO·B2O3·H2O+2H2SO4→2H3BO3+2MgSO4。
(1)上述反应中,核外电子排布式相同的离子有__ ;原子核外具有五种不同能量电子的元素名称是__ 。
(2)硼元素在元素周期表中的位置是__ ;已知BF3分子的空间构型为平面正三角形,则BF3属于__ 分子(填“极性”或“非极性”)。
(3)Mg元素的原子结构示意图为__ 。Mg(OH)2碱性比Ca(OH)2__ (填“强”或“弱”)。
(4)硼酸[H3BO3或B(OH)3]是一元弱酸,它的水溶液之所以呈弱酸性并非本身电离出H+,而是硼酸与水作用时,与水电离产生的OH-结合,导致溶液中c(H+)>c(OH-)。用离子方程式表示硼酸呈酸性的原因__ 。
(1)上述反应中,核外电子排布式相同的离子有
(2)硼元素在元素周期表中的位置是
(3)Mg元素的原子结构示意图为
(4)硼酸[H3BO3或B(OH)3]是一元弱酸,它的水溶液之所以呈弱酸性并非本身电离出H+,而是硼酸与水作用时,与水电离产生的OH-结合,导致溶液中c(H+)>c(OH-)。用离子方程式表示硼酸呈酸性的原因
您最近一年使用:0次
解题方法
7 . 下列关于碳和碳的化合物的结构和性质中
(1)和碳同一主族的硅原子中能量最高的电子处在______ 电子层上(填写电子层符号),最外层有___ 种运动状态不同的电子,碳原子核外有______ 种能量不同的电子,有______ 种不同形状的电子云.
(2)1个C原子的单键氢化物分子是CH4,2个C原子的单键氢化物分子则为C2H6.以下各对分子间不存在类似关系的是_________
A.NH3与N2H4 B.H2O与H2O2 C.SF6与S2F10 D.SCl4与S2Cl2
(3)金刚石的熔点低于石墨,原因可能是________
A.石墨中还有范德华力
B.石墨熔化也要破坏共价键,且键长更短
C.石墨热稳定性更好
(4)已知常温下,H2CO3:Ki1=4.3x10﹣7、Ki2=5.6x10﹣11.结合H+的能力Na2CO3溶液______ (填”>”、”<”或“=”)NaHCO3溶液,设计简单实验证明:______ .
(5)在1L 0.3mol/L的NaOH溶液中,通入4.48LCO2(标准状况),反应后所得溶液中离子的浓度之间有一些等量关系,例如:.c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣),另外对此溶液中存在的离子按浓度由大到小排序为______ .
(1)和碳同一主族的硅原子中能量最高的电子处在
(2)1个C原子的单键氢化物分子是CH4,2个C原子的单键氢化物分子则为C2H6.以下各对分子间不存在类似关系的是
A.NH3与N2H4 B.H2O与H2O2 C.SF6与S2F10 D.SCl4与S2Cl2
(3)金刚石的熔点低于石墨,原因可能是
A.石墨中还有范德华力
B.石墨熔化也要破坏共价键,且键长更短
C.石墨热稳定性更好
(4)已知常温下,H2CO3:Ki1=4.3x10﹣7、Ki2=5.6x10﹣11.结合H+的能力Na2CO3溶液
(5)在1L 0.3mol/L的NaOH溶液中,通入4.48LCO2(标准状况),反应后所得溶液中离子的浓度之间有一些等量关系,例如:.c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣),另外对此溶液中存在的离子按浓度由大到小排序为
您最近一年使用:0次
解题方法
8 . 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子核外电子排布式为___ 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是___ (填序号)。
a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性
(3)工业上,通过如图转化可制得KClO3晶体:
NaCl溶液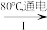 NaClO3溶液
NaClO3溶液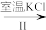 KClO3晶体
KClO3晶体
II中转化的基本反应类型是___ ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是___ 。
(4)晶体硅(熔点1410℃)是良好的半导体材料;四氯化硅熔点-70℃,沸点57.6℃;由粗硅制纯硅过程如图:
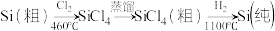
写出SiCl4的电子式:___ ;在上述由SiCl4制纯硅的反应中,测得生成7kg纯硅需吸收akJ热量,写出该反应的热化学方程式:___ 。
(5)ClO2是常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目___ 。
(1)与氯元素同族的短周期元素的原子核外电子排布式为
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是
a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性
(3)工业上,通过如图转化可制得KClO3晶体:
NaCl溶液
 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体II中转化的基本反应类型是
(4)晶体硅(熔点1410℃)是良好的半导体材料;四氯化硅熔点-70℃,沸点57.6℃;由粗硅制纯硅过程如图:
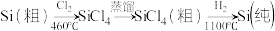
写出SiCl4的电子式:
(5)ClO2是常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目
您最近一年使用:0次
解题方法
9 . (1)写出符合下列条件的原子的元素符号并画出其原子结构示意图。
①核外有2个电子层、10个电子的原子__________________ ;
②质量数为23、中子数为12的原子__________________ ;
③电子总数是最外层电子数3倍的原子__________________ 。
(2)用下列原子或离子的结构示意图的编号(A、B、C、D)填空:
A.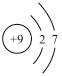 B.
B.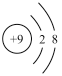 C.
C.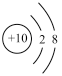 D.
D.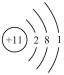
①电子层排布相同的是__________________ ;
②属于同一种元素的是__________________ ;
③属于金属元素的是__________________ ;
④属于稀有气体元素的是__________________ 。
①核外有2个电子层、10个电子的原子
②质量数为23、中子数为12的原子
③电子总数是最外层电子数3倍的原子
(2)用下列原子或离子的结构示意图的编号(A、B、C、D)填空:
A.
 B.
B. C.
C. D.
D.
①电子层排布相同的是
②属于同一种元素的是
③属于金属元素的是
④属于稀有气体元素的是
您最近一年使用:0次
19-20高二·浙江·阶段练习
解题方法
10 . (1)地壳由90多种化学元素组成,其含量最高的几种元素依次为①氧②硅③铝④铁,写出氧原子的结构示意图_______________ ;写出一种与氖具有相同核外电子 排布的离子___________ 。
(2)下列物质中① ②熔融碳酸钠③
②熔融碳酸钠③ 固体④蔗糖⑤
固体④蔗糖⑤ 溶液⑥铁能导电的是
溶液⑥铁能导电的是________ 属于非电解质的是________ ;(以上填写物质编号);写出②的电离方程式__________________ 。
(2)下列物质中①
 ②熔融碳酸钠③
②熔融碳酸钠③ 固体④蔗糖⑤
固体④蔗糖⑤ 溶液⑥铁能导电的是
溶液⑥铁能导电的是
您最近一年使用:0次



