解题方法
1 . 我国自主研制的C919大型客机的机身大量采用第三代铝锂合金减重并提高刚度。某铝锂合金成分(质量百分比)如下(Bal指剩余的百分含量):

为了使合金具有高耐腐性能,通常先用酸腐蚀除去铝锂合金表面的氧化层,再进行氧化处理,并进行适当封闭,以提高合金表面耐腐蚀性能。仔细阅读上述信息,回答下列问题:
(1)铝锂合金可用于制造飞机,铝锂合金材料的主要特点是______________________________ 。
(2)铝元素原子核外有_____ 种不同运动状态的电子,最外层电子排布式为___________ 。
(3)碱腐蚀工艺采用40~60g/L的NaOH溶液,在40~55℃下处理0.5~2min时间。写出碱腐蚀主要反应的化学方程式_____________________________ (写一个即可)。
(4) 镁与铝也是构成轻合金的两种常见金属,请从原子结构角度分析比较它们金属性的强弱_____________
(5) 向镁铝合金滴入盐酸至恰好全部溶解,再逐渐滴入氢氧化钠溶液至过量,在滴氢氧化钠过程中观察到的现象有:______________________________________ ;写出其现象中的一个离子方程式_________________ 。

| 成分 | Si | Fe | Cu | Mn | Mg | Zn | Ti | Li | Al |
| 含量 | 0.08 | 0.1 | 2.9~3.5 | 0.5 | 0.25~0.8 | 0.25 | 0.1 | 0.8~1.1 | Bal |
(1)铝锂合金可用于制造飞机,铝锂合金材料的主要特点是
(2)铝元素原子核外有
(3)碱腐蚀工艺采用40~60g/L的NaOH溶液,在40~55℃下处理0.5~2min时间。写出碱腐蚀主要反应的化学方程式
(4) 镁与铝也是构成轻合金的两种常见金属,请从原子结构角度分析比较它们金属性的强弱
(5) 向镁铝合金滴入盐酸至恰好全部溶解,再逐渐滴入氢氧化钠溶液至过量,在滴氢氧化钠过程中观察到的现象有:
您最近一年使用:0次
解题方法
2 . 金属“钙线”是炼制优质钢材的脱氧脱磷剂,某“钙线”的主要成分为金属M和Ca。
(1)Ca元素在元素周期表中的位置是_____ ,最外层电子排布式为________ 。
(2)CaF2的电子式为_____ ,CaF2熔点比SiF4熔点_______ (选填“高”、“低”或“相同”),原因是_____ 。
(3)将“钙线”试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n.则金属M为_____ ,检测Mn+的另一种方法是_____ 。
(4)配平下列化学方程式: P+ FeO+ CaO→ Ca3(PO4)2+ Fe,________ ,若生成的Fe为2.8g,则转移的电子数目为_____ 个。
(1)Ca元素在元素周期表中的位置是
(2)CaF2的电子式为
(3)将“钙线”试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n.则金属M为
(4)配平下列化学方程式: P+ FeO+ CaO→ Ca3(PO4)2+ Fe,
您最近一年使用:0次
3 . 观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题:
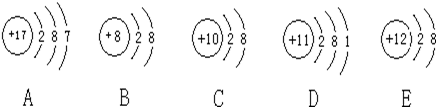
(1)属于离子结构示意图的是______ 、______ (填编号)。
(2)性质最稳定的原子是(填写编号,在本小题中下同)______ ,最容易失去电子的原子是______ ,最容易得到电子的原子是______ 。
(3)A、D两种元素形成的化合物在水溶液中的电离方程式______ 。
(4)在核电荷数1-18的元素内,列举两个与B核外电子层排布相同的离子,写出离子的符号______ 、______ 。

(1)属于离子结构示意图的是
(2)性质最稳定的原子是(填写编号,在本小题中下同)
(3)A、D两种元素形成的化合物在水溶液中的电离方程式
(4)在核电荷数1-18的元素内,列举两个与B核外电子层排布相同的离子,写出离子的符号
您最近一年使用:0次
2019-01-27更新
|
542次组卷
|
7卷引用:2011-2012学年江苏省江阴市一中高一上学期期中考试化学试卷
(已下线)2011-2012学年江苏省江阴市一中高一上学期期中考试化学试卷陕西省黄陵中学2018-2019学年高一(普通班)上学期期末考试化学试题(已下线)2019年4月1日《每日一题》 必修2 原子的组成与结构第1章原子结构与元素周期律第1节易错疑难集训(一)鲁科版(2019)必修第二册第一章第1节 易错疑难集训(已下线)2.3.2 原子核外电子排布练习(2)——《高中新教材同步备课》(苏教版 必修第一册)(已下线)2.3.2 原子核外电子排布-2021-2022学年高一化学10分钟课前预习练(苏教版2019必修第一册)
4 . 氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的 L 层电子数为___________ ;
(2)肼(N2H4)又称联氨。无色油状液体。有类似于氨的刺鼻气味。可作为火箭发动机的燃料。
①)肼中氮元素的化合价为____ 。
②NH3 与 NaClO 反应可得到肼,该反应的化学方程式为_____ 。
③16g 液态肼在空气中燃烧,生成氮气和水蒸气时放出的热量为 267.1kJ,写出该反应的热化学方程式:____ 。
(1)氮元素原子的 L 层电子数为
(2)肼(N2H4)又称联氨。无色油状液体。有类似于氨的刺鼻气味。可作为火箭发动机的燃料。
①)肼中氮元素的化合价为
②NH3 与 NaClO 反应可得到肼,该反应的化学方程式为
③16g 液态肼在空气中燃烧,生成氮气和水蒸气时放出的热量为 267.1kJ,写出该反应的热化学方程式:
您最近一年使用:0次
名校
5 . 按要求填写:
(1)二氧化碳的电子式:______________ ;小苏打的化学式:________________ ;质子数为6、中子数为6的原子结构示意图____________________ 。
(2)氯气与氢氧化钠溶液反应的化学方程式______________________________ 。
(1)二氧化碳的电子式:
(2)氯气与氢氧化钠溶液反应的化学方程式
您最近一年使用:0次
名校
6 . 下表是元素周期表的一部分。
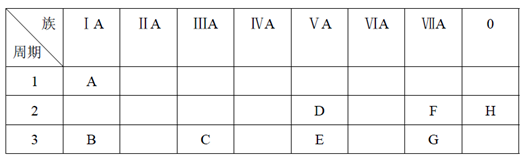
根据A~G元素在周期表中的位置,用化学式填写空白。
(1)氧化性最强的单质是______ ,还原性最强的单质是______ ,化学性质最不活泼的单质是______ 。(填相应的化学式)
(2)最稳定的氢化物是______ 。(填相应的化学式)
(3)一个E原子的核外电子总共有______ 种运动状态。
(4)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是_______ 。(填相应的化学式)

根据A~G元素在周期表中的位置,用化学式填写空白。
(1)氧化性最强的单质是
(2)最稳定的氢化物是
(3)一个E原子的核外电子总共有
(4)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是
您最近一年使用:0次
2018-05-28更新
|
555次组卷
|
2卷引用:【全国百强校】四川省南充高级中学2017-2018学年高二下学期期中化学试题
7 . A、B、C、D、E代表5种元素。请填空:
(1)A 元素基态原子的最外层有2 个未成对电子,次外层有2 个电子,其元素符号为______ ;
(2) B 元素的负一价离子和C元素的正一价离子的电子层结构都与氖相同,B 的元素符号为______ , C的元素符号为______ 。
(3) D 元素的正二价离子的3d能级为半充满,D的元素符号为_____ ,其基态原子的电子排布式为______ ,它位于第________ 周期第______ 族;
(4) E 元素基态原子的M 层能量最高的能级半充满,N 层没有成对电子,只有一个未成对电子,E 的元素符号为_____________ , 其基态原子的电子排布式为_______________ 。
(1)A 元素基态原子的最外层有2 个未成对电子,次外层有2 个电子,其元素符号为
(2) B 元素的负一价离子和C元素的正一价离子的电子层结构都与氖相同,B 的元素符号为
(3) D 元素的正二价离子的3d能级为半充满,D的元素符号为
(4) E 元素基态原子的M 层能量最高的能级半充满,N 层没有成对电子,只有一个未成对电子,E 的元素符号为
您最近一年使用:0次
8 . (1)某元素的原子序数为33,则:
①该元素原子的核外电子总数是________ ;
②该元素原子有________ 个电子层,________ 个能级;
③该元素原子的电子排布式为____________________________ 。
(2)写出S、Ca2+、Cl-的电子排布式:
①S:__________ ; ②Ca2+:__________ ; ③Cl-:__________ 。
①该元素原子的核外电子总数是
②该元素原子有
③该元素原子的电子排布式为
(2)写出S、Ca2+、Cl-的电子排布式:
①S:
您最近一年使用:0次
9 . 锗(Ge)原子结构示意图为: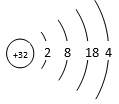
(1)锗位于元素周期表中的第_________ 周期,第________ 族,
(2)最高价氧化物化学式为________ ,对应水化物化学式为___________ 。
(3)根据示意图: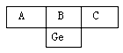
推得A、B、C依次为______ 、____ 、_____ 元素。A、B、C中,________ 是典型的非金属元素(填元素符号,下同),__________ 的最高价氧化物具有两性;可用作半导体的是_______ ,可作导体是________ ,常用来制农药的是__________ 。

(1)锗位于元素周期表中的第
(2)最高价氧化物化学式为
(3)根据示意图:

推得A、B、C依次为
您最近一年使用:0次
10 . 铁、铜、铬、镍及其化合物在现代社会中的用途越来越广泛。
(1)铁在元素周期表中的位置是_____________ ,基态铁原子价电子排布式为___________ 。
(2)锂—磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,PO43-的空间构型是______________ ,P、S元素第一电离能大小关系为_______________ 。
(3)镍可与CO形成配合物Ni(CO)n,CO分子与N2互为等电子体,则中CO分子σ键与π键的个数比为________ ;该配合物的熔点是170℃,则Ni(CO)n 属于 _______ 晶体。
(4)在铬的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是______ ,乙醇极易溶于水,其主要原因是_______________ 。
(5)立方NiO晶体结构类似于NaCl,则Ni2+的配位数为________ ,其晶胞边长为a cm,列式表示NiO晶体的密度为____ g/cm3(不必计算出结果,阿伏伽德罗常数的值为NA)。
(1)铁在元素周期表中的位置是
(2)锂—磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,PO43-的空间构型是
(3)镍可与CO形成配合物Ni(CO)n,CO分子与N2互为等电子体,则中CO分子σ键与π键的个数比为
(4)在铬的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是
(5)立方NiO晶体结构类似于NaCl,则Ni2+的配位数为
您最近一年使用:0次
2017-07-01更新
|
482次组卷
|
2卷引用:四川省广安市2016-2017学年高二下学期期末考试化学试题



