名校
解题方法
1 . Cl是一种电负性较大的非金属元素,请从结构角度解释 的酸性大于
的酸性大于 的原因:
的原因:___________ 。
 的酸性大于
的酸性大于 的原因:
的原因:
您最近半年使用:0次
名校
2 . 钛能与卤素单质发生反应,生成用途多样的卤化钛。
(1)卤族元素(F、Cl、Br、I)随着原子序数的递增,相关性质逐渐增强或变大的是___________。
(2) 易与
易与 结合,下列关于
结合,下列关于 分子说法错误的是___________。
分子说法错误的是___________。
(1)卤族元素(F、Cl、Br、I)随着原子序数的递增,相关性质逐渐增强或变大的是___________。
| A.元素的电负性 | B.简单离子的还原性 |
| C.气态氢化物的热稳定性 | D.最高价氧化物对应水化物的酸性 |
 易与
易与 结合,下列关于
结合,下列关于 分子说法错误的是___________。
分子说法错误的是___________。A.键角为 | B.是极性分子 |
C.含有 键 键 | D.中心原子采取 杂化 杂化 |
您最近半年使用:0次
名校
解题方法
3 . 下列说法正确的是
| A.某金属元素M气态基态原子的逐级电离能的数值分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成MCl3 |
| B.硫酸酸性强于亚硫酸的原因是硫酸分子中非羟基氧的个数多 |
C.CCl4分子中所有原子的最外层电子都满足了 稳定结构 稳定结构 |
D. 和CH4含有的共价键都是 和CH4含有的共价键都是 |
您最近半年使用:0次
名校
解题方法
4 . 我国可燃冰资源一直被视为能源领域的宝藏,可燃冰被寄予厚望成为替代传统石油和天然气的清洁能源。回答下列问题:
(1)一定条件下, 、
、 都能与
都能与 形成笼状结构(如图所示)的水合物晶体,其相关参数见下表。
形成笼状结构(如图所示)的水合物晶体,其相关参数见下表。 与
与 形成的水合物晶体俗称“可燃冰”。
形成的水合物晶体俗称“可燃冰”。
 和
和 所含的三种元素电负性从大到小的顺序为
所含的三种元素电负性从大到小的顺序为___________ ;碳原子的最高能级的符号是___________ ,其电子云形状是___________ 。
(2) 分子的空间结构为
分子的空间结构为___________ 。相同条件下 与
与 在水中的溶解度较大的是
在水中的溶解度较大的是 ,理由是
,理由是___________ 。
(3)“可燃冰”中分子间存在的两种作用力是___________ 。
(4)下列关于 和
和 的说法正确的是___________(填标号)。
的说法正确的是___________(填标号)。
(5)为开采深海海底的“可燃冰”,有科学家提出用 置换
置换 的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是
的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是___________ 。
(1)一定条件下,
 、
、 都能与
都能与 形成笼状结构(如图所示)的水合物晶体,其相关参数见下表。
形成笼状结构(如图所示)的水合物晶体,其相关参数见下表。 与
与 形成的水合物晶体俗称“可燃冰”。
形成的水合物晶体俗称“可燃冰”。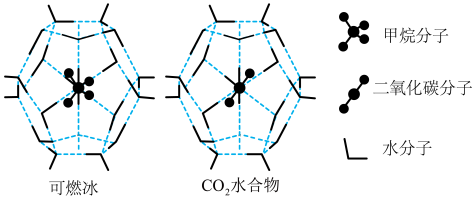
| 参数分子 | 分子直径/nm | 分子与 的结合能E/(kJ·mol 的结合能E/(kJ·mol ) ) |
 | 0.436 | 16.40 |
 | 0.512 | 29.91 |
 和
和 所含的三种元素电负性从大到小的顺序为
所含的三种元素电负性从大到小的顺序为(2)
 分子的空间结构为
分子的空间结构为 与
与 在水中的溶解度较大的是
在水中的溶解度较大的是 ,理由是
,理由是(3)“可燃冰”中分子间存在的两种作用力是
(4)下列关于
 和
和 的说法正确的是___________(填标号)。
的说法正确的是___________(填标号)。A. 分子中含有2个σ键和2个π键 分子中含有2个σ键和2个π键 |
B. 分子中含有极性共价键,是极性分子 分子中含有极性共价键,是极性分子 |
C.因为碳氢键键能小于碳氧键,所以 的熔点低于 的熔点低于 |
D. 和 和 分子中碳原子的杂化类型分别是 分子中碳原子的杂化类型分别是 和sp 和sp |
(5)为开采深海海底的“可燃冰”,有科学家提出用
 置换
置换 的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是
的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是
您最近半年使用:0次
名校
解题方法
5 . 硼氢化钠( ))被称为“万能还原剂”,能与水反应产生
))被称为“万能还原剂”,能与水反应产生 ,
, 在催化剂钉(Ru,第五周期元素,价层电子数为8)表面与水反应的历程如图所示:
在催化剂钉(Ru,第五周期元素,价层电子数为8)表面与水反应的历程如图所示:
 ))被称为“万能还原剂”,能与水反应产生
))被称为“万能还原剂”,能与水反应产生 ,
, 在催化剂钉(Ru,第五周期元素,价层电子数为8)表面与水反应的历程如图所示:
在催化剂钉(Ru,第五周期元素,价层电子数为8)表面与水反应的历程如图所示:
| A.整个过程中失电子的元素是硼 |
| B.电负性:O>H>B>Na |
| C.在元素周期表中元素钉与铁位于同一纵行 |
D.B原子2py轨道的电子云轮廓图: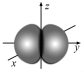 |
您最近半年使用:0次
名校
解题方法
6 . 下列说法正确的是
A. 空间结构模型 空间结构模型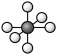 |
B.基态Si的价层电子排布图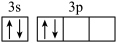 |
C.硫酸钾的电子式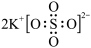 |
D.卤族元素电负性变化趋势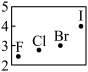 |
您最近半年使用:0次
7 . 下表是A、B、C、D、 五种短周期元素的某些性质,下列判断正确的是
五种短周期元素的某些性质,下列判断正确的是
 五种短周期元素的某些性质,下列判断正确的是
五种短周期元素的某些性质,下列判断正确的是| 元素 | A | B | C | D |  |
| 最低负化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
A.C、D、 的氢化物的稳定性: 的氢化物的稳定性: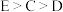 |
| B.元素A的原子最外层轨道中无自旋平行的电子 |
| C.元素B、C的原子之间可形成离子键 |
D.与元素B同周期且第一电离能最小的元素的单质能与 发生置换反应 发生置换反应 |
您最近半年使用:0次
解题方法
8 . 某离子液体结构如下图所示。W、X、Y、Z原子序数依次增大,W、X和Y的原子序数之和为14,Z 是第四周期元素。下列说法正确的是
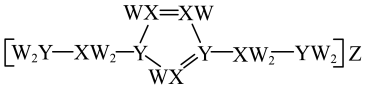
| A.简单氢化物的沸点: X<Z<Y | B.电负性: Y>W>X |
| C.原子半径: Z>Y>X | D.Z的氧化物的水化物为强酸 |
您最近半年使用:0次
9 . 下列说法正确的是:
A.24Cr原子的核外电子排布式是: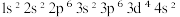 |
| B.最外层电子排布式为ns¹的基态原子所对应元素一定是金属元素 |
| C.原子半径:P>S>Cl |
| D.电负性:Br>Cl>F |
您最近半年使用:0次
10 . 请回答下列问题:
(1)基态氟原子核外9个电子,这些电子的电子云形状有___________ 种;氟原子有___________ 种不同能量的电子,价层电子的轨道表示式为___________ 。
(2)已知锡位于第五周期,与C同主族,写出Sn2+的最外层电子排布式:___________ ;Cl-中有___________ 种运动状态不同的电子。
(3)某元素简化电子排布式为[Xe]4f46s2,其应在___________ 区。
(4)Li、B、H元素的电负性由大到小的排列顺序为___________ 。
(5)Li3N中氮以N3-存在,基态N3-的电子排布式为___________ ,外围电子排布为3d104s2的元素在周期表中的位置是 ___________ 。
(6)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)4 ,呈正四面体结构。Ni(CO)4易溶于下列___________ 。
a.水 b.乙醇 c.C6H6(苯) d.NiSO4溶液
(1)基态氟原子核外9个电子,这些电子的电子云形状有
(2)已知锡位于第五周期,与C同主族,写出Sn2+的最外层电子排布式:
(3)某元素简化电子排布式为[Xe]4f46s2,其应在
(4)Li、B、H元素的电负性由大到小的排列顺序为
(5)Li3N中氮以N3-存在,基态N3-的电子排布式为
(6)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)4 ,呈正四面体结构。Ni(CO)4易溶于下列
a.水 b.乙醇 c.C6H6(苯) d.NiSO4溶液
您最近半年使用:0次
2024-05-01更新
|
72次组卷
|
2卷引用:黑龙江省哈尔滨市第三十二中学校2023-2024学年高二下学期4月期中考试化学试题



