1 . 三草酸合铁酸钾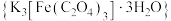 是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解:
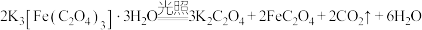 。回答下列问题:
。回答下列问题:
(1)基态 原子的电子排布式为
原子的电子排布式为___________ ,基态 与
与 中未成对电子的数目之比为
中未成对电子的数目之比为___________ 。
(2)三草酸合铁酸钾所含元素中,第一电离能最大的是___________ (填元素符号,下同),电负性最大的是___________ 。
(3)1个 与1个
与1个 分子中
分子中 键数目之比为
键数目之比为___________ , 分子的立体构型为
分子的立体构型为___________ 。
(4)金刚石的晶胞结构如图所示,碳原子分别位于顶点、面心和体内。

若图中原子1的坐标为 ,则原子2的坐标为
,则原子2的坐标为___________ 。
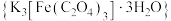 是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解: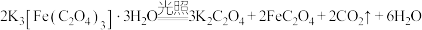 。回答下列问题:
。回答下列问题:(1)基态
 原子的电子排布式为
原子的电子排布式为 与
与 中未成对电子的数目之比为
中未成对电子的数目之比为(2)三草酸合铁酸钾所含元素中,第一电离能最大的是
(3)1个
 与1个
与1个 分子中
分子中 键数目之比为
键数目之比为 分子的立体构型为
分子的立体构型为(4)金刚石的晶胞结构如图所示,碳原子分别位于顶点、面心和体内。

若图中原子1的坐标为
 ,则原子2的坐标为
,则原子2的坐标为
您最近一年使用:0次
2022-05-09更新
|
517次组卷
|
3卷引用:福建省莆田市2022届高三下学期第三次质量检测化学试题
福建省莆田市2022届高三下学期第三次质量检测化学试题(已下线)第十二章 物质结构与性质(测)-2023年高考化学一轮复习讲练测(全国通用)山西省怀仁市大地中学高中部2021-2022学年高二下学期第三次月考化学试题
2 . 螯合树脂吸附法处理废水具有吸附容量大、速度快以及选择性好等特点,已成为近年来的研究热点。螯合树脂M与Cu2+形成新的螯合物Q,从而达到去除Cu2+的效果,吸附机理如图所示。
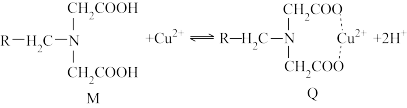
资料:
①吸附原理
螯合树脂M中的—COOH解离出H+,变成—COO-,而且树脂中含有N原子,在与Cu2+接触时,树脂中的—COO-、N原子与Cu2+形成配位键,形成新的螯合物Q,从而达到去除Cu2+的目的。
②在体系酸性较强情况下,氮原子与氢离子具有较强的配位能力。
(1)M中四种元素电负性由大到小的顺序为(用元素符号表示)____ 。
(2)M中N原子的杂化轨道类型为____ 。
(3)Q中存在配位键,其中提供空轨道的是____ 。
(4)在螯合树脂M处理含铜废水过程中,发现体系pH对Cu2+的吸附量有影响,实验结果如图所示。

①吸附去除Cu2+的过程中需保持体系处于适宜的pH,其中pH约为____ 时吸附效果最好。
②解释体系碱性过强时,吸附能力下降的原因____ 。
③从结构角度解释:体系酸性较强时,吸附能力下降的原因____ 。
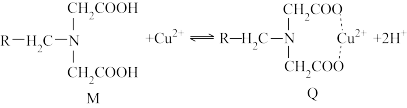
资料:
①吸附原理
螯合树脂M中的—COOH解离出H+,变成—COO-,而且树脂中含有N原子,在与Cu2+接触时,树脂中的—COO-、N原子与Cu2+形成配位键,形成新的螯合物Q,从而达到去除Cu2+的目的。
②在体系酸性较强情况下,氮原子与氢离子具有较强的配位能力。
(1)M中四种元素电负性由大到小的顺序为(用元素符号表示)
(2)M中N原子的杂化轨道类型为
(3)Q中存在配位键,其中提供空轨道的是
(4)在螯合树脂M处理含铜废水过程中,发现体系pH对Cu2+的吸附量有影响,实验结果如图所示。

①吸附去除Cu2+的过程中需保持体系处于适宜的pH,其中pH约为
②解释体系碱性过强时,吸附能力下降的原因
③从结构角度解释:体系酸性较强时,吸附能力下降的原因
您最近一年使用:0次
名校
3 . 近日,我国研究人员利用硫氰酸甲基铵{[CH3NH3]+[SCN]-}气相辅助生长技术,成功制得稳定的钙钛矿型甲脒铅碘(FAPbI3)。请回答下列问题:
(1)基态S原子的价电子排布图为___________ 。
(2)甲脒(FA)的结构简式为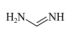
①其组成元素的电负性由小到大的排序为___________ ,其中碳原子的杂化方式为___________ 。
②甲脒比丙烷的熔点更高的原因是___________ 。
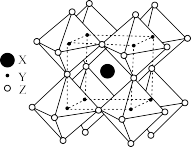
(3)FAPbI3的晶体结构单元如图所示,图中Y表示Pb,位于八面体中心,则甲脒的碘配位数为___________ 。
(1)基态S原子的价电子排布图为
(2)甲脒(FA)的结构简式为

①其组成元素的电负性由小到大的排序为
②甲脒比丙烷的熔点更高的原因是
(3)FAPbI3的晶体结构单元如图所示,图中Y表示Pb,位于八面体中心,则甲脒的碘配位数为

您最近一年使用:0次
2021-10-13更新
|
612次组卷
|
5卷引用:天津市五校2023届高三一模联考化学试题
天津市五校2023届高三一模联考化学试题福建省宁化第一中学2021-2022学年高三上学期第二次阶段考试化学试题天津市西青区杨柳青第一中学2021--2022 学年高三上学期第一次阶段检测化学试题(已下线)第19讲元素周期律与元素周期表(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
解题方法
4 . 光刻技术需要利用深紫激光,我国是唯一掌握通过非线性光学晶体变频来获得深紫外激光技术的国家。目前唯一实用化的晶体是氟代硼铍酸钾晶体 KBBF(KBe2BO3F2),实验室可用 BeO、KBF4和 B2O3 在 700℃左右灼烧获得氟代硼铍酸钾晶体(晶胞如下图所示,其中 K 原子已经给出,氧原子略去),并放出 BF3气体。回答下列问题:
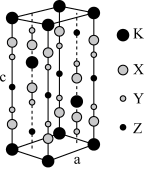
(1)基态钾原子的核外电子排布式为___________ ,能量最高的电子的电子云轮廓图形状为___________ 。
(2)BF3的空间构型为___________ ,与其互为等电子体的阴离子为___________ (填一种即可)。
(3)氟代硼铍酸钾晶体 KBBF(KBe2BO3F2)组成元素中电负性最大的元素和电负性最小的元素组成的物质为___________ 。
(4)KBF4中心 B 原子的杂化方式为___________ 杂化。
(5) 三卤化硼的性质如下:
BF3、BCl3、BBr3、BI3的沸点逐渐升高的原因是:___________ 。
(6)指出图中代表硼原子的字母为___________ ,该KBBF晶体的晶胞参数分别为a pm 和 c pm,α=β=γ=90°,则晶体密度为___________ g·cm-3(M 代表 KBBF 的摩尔质量,NA表示阿伏加德罗常数的值,列出计算式)。

(1)基态钾原子的核外电子排布式为
(2)BF3的空间构型为
(3)氟代硼铍酸钾晶体 KBBF(KBe2BO3F2)组成元素中电负性最大的元素和电负性最小的元素组成的物质为
(4)KBF4中心 B 原子的杂化方式为
(5) 三卤化硼的性质如下:
| BF3 | BCl3 | BBr3 | BI3 | |
| 熔点/℃ | -127. | | -107 | -46 | 49.9 |
| 沸点/℃ | -99 | 12.5 | 91.3 | 210. |
BF3、BCl3、BBr3、BI3的沸点逐渐升高的原因是:
(6)指出图中代表硼原子的字母为
您最近一年使用:0次
解题方法
5 . 硅铝合金广泛应用于航空、交通、建筑、汽车等行业。
完成下列填空:
(1)硅原子的结构示意图为___________ ;比较硅铝的原子半径:r(Si)___________ r(Al)(选填:“>”、“<”或“=”)。硅铝合金中的铝与氢氧化钠溶液反应的化学方程式为___________ 。
(2)氟化铝和氯化铝的熔点分别为1040 和194
和194 ,它们熔点差异大的原因可能是
,它们熔点差异大的原因可能是___________ 。
(3)门捷列夫准确预测了铝、硅下一周期的同主族元素(当时并未被发现)的性质,并将他们分别命名为“类铝”和“类硅”。你据此推断类铝的最外层电子排布式为___________ ,推断的依据是___________ 。
(4)制备硅铝合金时,在高温真空炉中发生如下反应:
 ;
;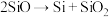 ;
;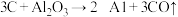
上述反应的最终还原产物为___________ ;当有1mol C参加反应时,转移的电子数目为___________ 。
完成下列填空:
(1)硅原子的结构示意图为
(2)氟化铝和氯化铝的熔点分别为1040
 和194
和194 ,它们熔点差异大的原因可能是
,它们熔点差异大的原因可能是(3)门捷列夫准确预测了铝、硅下一周期的同主族元素(当时并未被发现)的性质,并将他们分别命名为“类铝”和“类硅”。你据此推断类铝的最外层电子排布式为
(4)制备硅铝合金时,在高温真空炉中发生如下反应:
 ;
;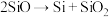 ;
;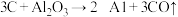
上述反应的最终还原产物为
您最近一年使用:0次
2021-04-20更新
|
416次组卷
|
3卷引用:上海市浦东新区2021届高三二模化学试题
上海市浦东新区2021届高三二模化学试题(已下线)第15讲 原子结构 化学键(练)-2023年高考化学一轮复习讲练测(全国通用)上海市奉贤区致远高级中学2021-2022学年高二上学期期末教学评估(等级考)化学试题
6 . 研究K、Ca、Fe、As、T等第四周期元素对生产、生活有重要意义。回答下列问题:
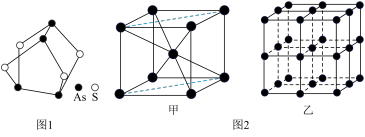
(1)我国中医把雄黄作为解毒剂,用来治疗癣疥、中风等。雄黄的结构如图1.雄黄分子中孤电子对数与成键电子对数之比为___ ,砷酸常用于制备颜料、砷酸盐、杀虫剂等,则AsO 的空间构型是
的空间构型是___ 。
(2)已知KCl、MgO、CaO、TiN的晶体于NaCl的晶体结构相似,且三种离子晶体的晶格能数据如表所示。
①Ti3+的电子排布式为___ 。
②KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为___ ,原因是___ 。
(3)Fe的一种晶体结构如图2甲、乙所示,若按甲虚线方向切割乙,得到的截面图中正确的是___ 。(填字母标号)假设铁原子的半径是rcm,铁的相对原子质量为M,则该晶体的密度为___ g/cm3。(列式即可,设阿伏加 德罗常数的值为NA)


(1)我国中医把雄黄作为解毒剂,用来治疗癣疥、中风等。雄黄的结构如图1.雄黄分子中孤电子对数与成键电子对数之比为
 的空间构型是
的空间构型是(2)已知KCl、MgO、CaO、TiN的晶体于NaCl的晶体结构相似,且三种离子晶体的晶格能数据如表所示。
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
①Ti3+的电子排布式为
②KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为
(3)Fe的一种晶体结构如图2甲、乙所示,若按甲虚线方向切割乙,得到的截面图中正确的是

您最近一年使用:0次
名校
解题方法
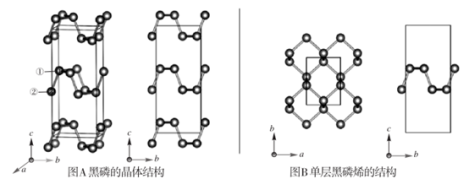
7 . 黑磷是磷的一种稳定的同素异形体,黑磷具有正交晶系的晶体结构(图A),晶胞参数a=3.310A,b=4.380A,c=10.500A。黑磷烯是二维的单层黑磷(图B),黑磷烯与石墨烯结构相似,P的配位数为3。与石墨烯相比,黑磷烯具有半导体性质,更适合于制作电子器件。已知黑磷结构中只有一种等效的三配位P,所有P原子的成键环境一样,图A中编号为①的P原子的晶胞内坐标为(0.50,0.090,0.598)。请回答下列问题:
(1)写出P原子的价电子排布:___ 。
(2)P和F的电负性大小顺序是X(P)___ X(F)。(填“<”“=”或“>”)P和F形成的分子PF3和PF5,它们的几何构型分别为__ 、__ 。
(3)①黑磷中P原子杂化类型是__ 。黑磷中不存在__ (选填字母序号)。
A.共价键 B.σ键 C.π键 D.范德华力
②红磷、白磷与黑磷熔点从高到低的顺序为__ ,原因是__ 。
(4)图A中编号为②的P原子的晶胞内坐标为__ ,黑磷的晶胞中含有__ 个P原子。

(1)写出P原子的价电子排布:
(2)P和F的电负性大小顺序是X(P)
(3)①黑磷中P原子杂化类型是
A.共价键 B.σ键 C.π键 D.范德华力
②红磷、白磷与黑磷熔点从高到低的顺序为
(4)图A中编号为②的P原子的晶胞内坐标为
您最近一年使用:0次
2020-07-13更新
|
233次组卷
|
2卷引用:江西省吉安、抚州、赣州市2020届高三一模理科综合化学试题
名校
解题方法
8 . LiFePO4、聚乙二醇、LiPF6、LiAsF6、LiCl等常用作锂离子聚合物电池的材料和载体。
回答下列问题:
(1)LiFePO4中Fe的价层电子排布式为___________ 。
(2)LiPF6、LiAsF6和LiCl中所含的四种非金属元素电负性由大到小的顺序为___________ 。
(3)含氧酸的通式可写为(HO)mROn,根据化学学科的规律下列几种酸中酸性与H3PO4相近的有________ 。
a.HClO b.HClO3 c.H2SO3 d.HNO2
(4)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸(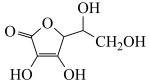 )常被用作碳包覆的碳源,其易溶于水的原因是
)常被用作碳包覆的碳源,其易溶于水的原因是____________________ ,该分子中碳原子的杂化方式为___________ 。
(5)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)
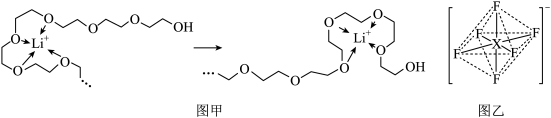
①从化学键角度看,Li+迁移过程发生___________ (填“物理变化”或“化学变化”)。
②相同条件,Li+在___________ (选填“LiPF6”或“LiAsF6”)中迁移较快,原因是___________ 。
(6)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属正交晶系(长方体形)晶胞参数为0.72mm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。
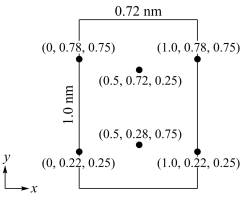
①该晶胞中Cl原子的数目为___________ 。
②LiCl·3H2O的摩尔质量为Mg·mol-1,设NA为阿伏加 德罗常数的值,则LiCl·3H20晶体的密度为___ g·cm-3(列出计算表达式)。
回答下列问题:
(1)LiFePO4中Fe的价层电子排布式为
(2)LiPF6、LiAsF6和LiCl中所含的四种非金属元素电负性由大到小的顺序为
(3)含氧酸的通式可写为(HO)mROn,根据化学学科的规律下列几种酸中酸性与H3PO4相近的有
a.HClO b.HClO3 c.H2SO3 d.HNO2
(4)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸(
 )常被用作碳包覆的碳源,其易溶于水的原因是
)常被用作碳包覆的碳源,其易溶于水的原因是(5)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)

①从化学键角度看,Li+迁移过程发生
②相同条件,Li+在
(6)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属正交晶系(长方体形)晶胞参数为0.72mm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。

①该晶胞中Cl原子的数目为
②LiCl·3H2O的摩尔质量为Mg·mol-1,设NA为阿伏加 德罗常数的值,则LiCl·3H20晶体的密度为
您最近一年使用:0次
9 . 铁及其化合物在生产、生活中有广泛应用。
(1)铁原子核外有__________ 种运动状态不同的电子,Fe3+基态核外电子排布式为_______________ 。
(2)实验室常用K3[Fe(CN)6]检验Fe2+,[Fe(CN)6]3-中三种元素电负性由大到小的顺序为________ (用元素符号表示),CN-中σ键与π键的数目比n(σ)∶n(π)=__________ ;HCN中C原子轨道的杂化类型为__________ 。HCN的沸点为25.7℃,既远大于N2的沸点(-195.8℃)也大于HCl的沸点(-85℃)的原因是__________ 。
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(Fe2Cl6)存在,该双聚分子的结构式为________ ,其中Fe的配位数为_____________ 。
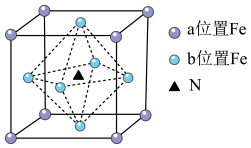
(4)铁氮化合物(Fe4N)在磁记录材料领域有着广泛的应用前景,其晶胞如上图所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中b位置Fe原子的坐标为(0, ,
, )、(
)、( ,0,
,0, )和(
)和( ,
, ,0),则a位置Fe原子和N原子的坐标分别为
,0),则a位置Fe原子和N原子的坐标分别为__________ 、__________ 。N与Fe原子之间最短距离a pm。设阿伏加 德罗常数的值为NA,则该铁氮化合物的密度是__________ g·cm-3(列出计算表达式)。
(1)铁原子核外有
(2)实验室常用K3[Fe(CN)6]检验Fe2+,[Fe(CN)6]3-中三种元素电负性由大到小的顺序为
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(Fe2Cl6)存在,该双聚分子的结构式为

(4)铁氮化合物(Fe4N)在磁记录材料领域有着广泛的应用前景,其晶胞如上图所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中b位置Fe原子的坐标为(0,
 ,
, )、(
)、( ,0,
,0, )和(
)和( ,
, ,0),则a位置Fe原子和N原子的坐标分别为
,0),则a位置Fe原子和N原子的坐标分别为
您最近一年使用:0次
名校
解题方法
10 . 铬、钼 、钨
、钨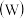 都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。
都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。
 铬元素的最高化合价为
铬元素的最高化合价为________ ;基态钼原子的核外电子排布类似于基态铬原子,其原子核外有________ 个未成对电子。
 钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
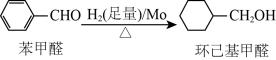
 环己基甲醇分子中采取
环己基甲醇分子中采取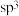 杂化的原子是
杂化的原子是________  写元素符号
写元素符号 。
。
 环己基甲醇的沸点高于苯甲醛,其原因是
环己基甲醇的沸点高于苯甲醛,其原因是________ 。
 铬离子
铬离子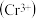 能形成多种配合物,例如
能形成多种配合物,例如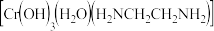 。
。
 已知配合物的中心粒子的配位数指配位原子总数。上述配合物中,
已知配合物的中心粒子的配位数指配位原子总数。上述配合物中, 的配位数为
的配位数为________ 。
 上述配合物中的非金属元素按电负性由小到大的顺序排列为
上述配合物中的非金属元素按电负性由小到大的顺序排列为________ 。
 铬的一种氧化物的晶胞结构如图所示。
铬的一种氧化物的晶胞结构如图所示。
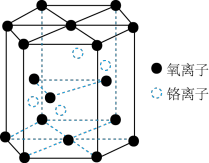
 该氧化物的化学式为
该氧化物的化学式为________ 。
 已知晶胞底面的边长为acm,晶胞的高为bcm,
已知晶胞底面的边长为acm,晶胞的高为bcm, 代表阿伏加 德罗常数的值,该铬的氧化物的摩尔质量为
代表阿伏加 德罗常数的值,该铬的氧化物的摩尔质量为 。该晶体的密度为
。该晶体的密度为________  用含a、b、
用含a、b、 和M的代数式表示
和M的代数式表示 。
。
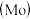 、钨
、钨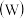 都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。
都是ⅥB族元素,且原子序数依次增大,它们的单质和化合物在生活、生产中有广泛应用。 铬元素的最高化合价为
铬元素的最高化合价为 钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
钼可作有机合成的催化剂。例如,苯甲醛被还原成环己基甲醇。
 环己基甲醇分子中采取
环己基甲醇分子中采取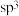 杂化的原子是
杂化的原子是 写元素符号
写元素符号 。
。 环己基甲醇的沸点高于苯甲醛,其原因是
环己基甲醇的沸点高于苯甲醛,其原因是 铬离子
铬离子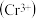 能形成多种配合物,例如
能形成多种配合物,例如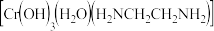 。
。 已知配合物的中心粒子的配位数指配位原子总数。上述配合物中,
已知配合物的中心粒子的配位数指配位原子总数。上述配合物中, 的配位数为
的配位数为 上述配合物中的非金属元素按电负性由小到大的顺序排列为
上述配合物中的非金属元素按电负性由小到大的顺序排列为 铬的一种氧化物的晶胞结构如图所示。
铬的一种氧化物的晶胞结构如图所示。
 该氧化物的化学式为
该氧化物的化学式为 已知晶胞底面的边长为acm,晶胞的高为bcm,
已知晶胞底面的边长为acm,晶胞的高为bcm, 代表阿伏加 德罗常数的值,该铬的氧化物的摩尔质量为
代表阿伏加 德罗常数的值,该铬的氧化物的摩尔质量为 。该晶体的密度为
。该晶体的密度为 用含a、b、
用含a、b、 和M的代数式表示
和M的代数式表示 。
。
您最近一年使用:0次
2020-02-03更新
|
742次组卷
|
5卷引用:2020届全国II卷高考化学模拟卷(三)



