名校
1 . 光伏材料又称太阳能材料,是指能将太阳能直接转换成电能的材料。可作太阳能电池材料的有单晶硅、多晶硅、非晶硅、GaAlAs、InP、CdS 等。回答下列问题:
(1)基态Cr原子的价电子排布式为___________ 。
(2)原子中电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数,则基态S原子中电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态S原子中电子自旋磁量子数的代数和为___________ 。
(3)基态P原子中电子占据的最高能层符号为___________ ; 的空间结构为
的空间结构为___________ 。
(4)砷化镓薄膜太阳能电池被用来为“天宫”空间站的核心舱供电。已知砷化镓的熔点为1238℃,其晶胞结构如下图所示。___________ 。
②该晶体的类型为___________ ;若晶胞密度为d  ,摩尔质量为M
,摩尔质量为M  ,阿伏加德罗常数的值用NA表示,则晶胞中最近的As和Ga原子核间距为
,阿伏加德罗常数的值用NA表示,则晶胞中最近的As和Ga原子核间距为___________ nm(只列计算式)。
(1)基态Cr原子的价电子排布式为
(2)原子中电子有两种相反的自旋状态,分别用
 和
和 表示,称为电子的自旋磁量子数,则基态S原子中电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态S原子中电子自旋磁量子数的代数和为(3)基态P原子中电子占据的最高能层符号为
 的空间结构为
的空间结构为(4)砷化镓薄膜太阳能电池被用来为“天宫”空间站的核心舱供电。已知砷化镓的熔点为1238℃,其晶胞结构如下图所示。
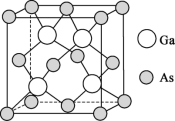
②该晶体的类型为
 ,摩尔质量为M
,摩尔质量为M  ,阿伏加德罗常数的值用NA表示,则晶胞中最近的As和Ga原子核间距为
,阿伏加德罗常数的值用NA表示,则晶胞中最近的As和Ga原子核间距为
您最近一年使用:0次
名校
2 . 锂一磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备: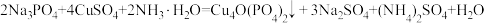 。回答下列问题:
。回答下列问题:
(1)铜位于周期表中_____ 区,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有_____ (填元素符号)。
(2)上述方程式中涉及的N、O、P、S元素第一电离能由小到大的顺序为________ ,电负性由小到大的顺序为______ 。
(3)常见含硫的微粒有SO2、SO3、 等,
等, 的空间构型为
的空间构型为________ ;SO2、SO3杂化轨道类型相同,但键角SO3大于SO2,原因是_______ 。
(4)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则[Cu(CN)4]2-中σ键与π键的数目之比为_______ 。
(5)铜的晶胞结构如图所示。
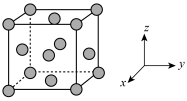
①铜晶胞在x轴方向的投影图是_____ (填标号)。
A.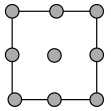 B.
B. 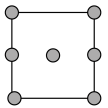
C.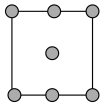 D.
D. 
②假设铜晶胞参数为anm,铜晶体的密度为bg·cm-3,则铜的相对原子质量为_____ (设NA为阿伏加德罗常数的值,用含a、b、NA的代数式表示)。
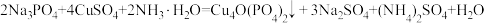 。回答下列问题:
。回答下列问题:(1)铜位于周期表中
(2)上述方程式中涉及的N、O、P、S元素第一电离能由小到大的顺序为
(3)常见含硫的微粒有SO2、SO3、
 等,
等, 的空间构型为
的空间构型为(4)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则[Cu(CN)4]2-中σ键与π键的数目之比为
(5)铜的晶胞结构如图所示。

①铜晶胞在x轴方向的投影图是
A.
 B.
B. 
C.
 D.
D. 
②假设铜晶胞参数为anm,铜晶体的密度为bg·cm-3,则铜的相对原子质量为
您最近一年使用:0次
解题方法
3 . 硫的化合物很多,如SO2、SO3、SO2Cl2、Na2SO3、三聚的(SO3)3等,三聚的(SO3)3的结构如图所示。下列说法正确的是


A.40 g(SO3)3分子中含有 6 mol 键 键 |
| B.SO2Cl2中S原子杂化方式为 sp3 |
C. 、 、 的价层电子对数不相同 的价层电子对数不相同 |
D.SO3、 均为平面三角形结构 均为平面三角形结构 |
您最近一年使用:0次
名校
4 . 下列化学用语表示正确的是
A.中子数为16的磷原子: |
B.羟基的电子式: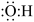 |
C. 的VSEPR模型: 的VSEPR模型: (平面三角形) (平面三角形) |
D.基态 最高能级的电子云轮廓图: 最高能级的电子云轮廓图: |
您最近一年使用:0次
2023-04-11更新
|
520次组卷
|
5卷引用:安徽省颍上第一中学2022-2023学年高二下学期5月月考化学试题
安徽省颍上第一中学2022-2023学年高二下学期5月月考化学试题浙江省嘉兴市2023届高三二模考试化学试题(已下线)浙江省嘉兴市2023届高三下学期二模化学试题(已下线)化学-2023年高考押题预测卷03(江苏卷)(含考试版、全解全析、参考答案、答题卡)(已下线)化学-2023年高考押题预测卷02(浙江卷)(含考试版、全解全析、参考答案、答题卡)
名校
解题方法
5 . 下表中各粒子对应的空间结构及解释均正确的是
| 选项 | 粒子 | 空间结构 | 解释 |
| A | 氨基负离子( ) ) | 直线形 | N原子采取 杂化 杂化 |
| B | 二氧化硫( ) ) | V形 | S原子采取 杂化 杂化 |
| C | 碳酸根离子( ) ) | 三角锥形 | C原子采取 杂化 杂化 |
| D | 乙炔( ) ) | 直线形 | C原子采取 杂化且C原子的价电子均参与成键 杂化且C原子的价电子均参与成键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-07更新
|
295次组卷
|
27卷引用:安徽省颍上第一中学2022-2023学年高二下学期5月月考化学试题
安徽省颍上第一中学2022-2023学年高二下学期5月月考化学试题2015-2016学年江苏省泰州中学高二下期中化学试卷四川省新津中学2019-2020学年高二下学期4月月考(入学)化学试题四川省成都外国语学校2019-2020学年高二下学期期中考试化学试题陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题四川绵阳南山中学双语学校2020-2021学年高二上学期10月月考化学试题湖南师范大学附属中学2020-2021学年高二上学期第三次大练习化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 B素养拓展区河南省名校联盟2020-2021学年高二下学期开学考试化学试题(已下线)2.2 分子的空间结构(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)山东省泰安市宁阳一中2020-2021学年高二下学期3月月考化学试题(已下线)作业04 分子的空间结构-2021年高二化学暑假作业(人教版2019)(已下线)2.2.2 杂化轨道理论(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)第2.2.2讲 杂化轨道理论-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)(已下线)第2章 章末综合测评B-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)专题4 分子空间结构与物质性质 专题强化练5 分子(离子)的空间结构与杂化轨道类型的判断第二节 分子的空间结构 第2课时 杂化轨道理论湖南省邵阳市新邵县2021-2022学年高二上学期期末考试化学试题福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(1卷)试题天津市耀华中学2022-2023学年高二上学期期末考试化学试题陕西省武功县普集高级中学2022-2023学年高二下学期第一次月考化学试题广东省阳山县南阳中学2022-2023学年高二下学期第一次月考化学试题广东省深圳龙岗四校2022--2023学年高二下学期期中考试化学试题黑龙江省大庆市肇州县第二中学2023-2024学年高二上学期12月月考化学试题湖南省岳阳市岳阳县第一中学2023-2024学年高二下学期开学化学试题四川省内江市威远县威远中学校2023-2024学年高二下学期第一次月考化学试卷四川省绵阳市东辰学校2023-2024学年高二上学期第四次月考化学试题
6 . 镍(Ni)、钴(Co) 、钛(Ti)是重要的金属,在材料科学等领域应用广泛。
(1)Ni在元素周期表中的位置是_______ , 其价电子层中有______ 个未成对电子。
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属于______ ( 填“极性”“非极性”)分子,其立体构型为_______ 。
(3)铁、钴、镍三种元素并称铁系元素,它们的性质相似。某含镍化合物的结构如图所示,则分子内不可能含有_ (填字母)。
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键

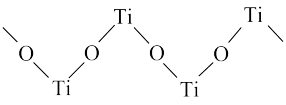
(4)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如图所示,其化学式为____ 。阴离子 中硫原子的杂化方式为
中硫原子的杂化方式为________ ,写出一种与 互为等电子体的分子:
互为等电子体的分子:_______ 。
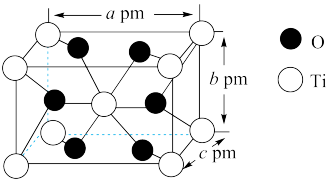
(5)自然界的钛主要以金红石(主要成分为TiO2 )的形式存在。TiO2的晶胞属于四方晶系,其长方体结构如图所示,已知TiO2的摩尔质量为Mg·mol-1,阿伏加 德罗常数的数值为NA,根据图中所示数据可知该晶体的密度ρ=______ (用NA表示阿伏加 德罗常数的数值,用含M、a、b、c、NA的代数式表示)g·cm-3。
(1)Ni在元素周期表中的位置是
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属于
(3)铁、钴、镍三种元素并称铁系元素,它们的性质相似。某含镍化合物的结构如图所示,则分子内不可能含有
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键

(4)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如图所示,其化学式为
 中硫原子的杂化方式为
中硫原子的杂化方式为 互为等电子体的分子:
互为等电子体的分子:
(5)自然界的钛主要以金红石(主要成分为TiO2 )的形式存在。TiO2的晶胞属于四方晶系,其长方体结构如图所示,已知TiO2的摩尔质量为Mg·mol-1,阿伏加 德罗常数的数值为NA,根据图中所示数据可知该晶体的密度ρ=

您最近一年使用:0次
名校
解题方法
7 . 已知X.Y和Z三种元素的原子序数之和等于42,X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子,请回答下列问题:
(1)X元素的原子结构示意图为_______ ;
(2)Y元素原子基态时的电子排布式为________ ;
(3)X与Z可形成化合物XZ3,该分子的VSEPR模型名称_____ ,该分子的立体构型名称_____ ;
(4)Z原子的电子云是_____ 形,电子云图上的黑点稠密,表明单位体积内电子_________ 。
(1)X元素的原子结构示意图为
(2)Y元素原子基态时的电子排布式为
(3)X与Z可形成化合物XZ3,该分子的VSEPR模型名称
(4)Z原子的电子云是
您最近一年使用:0次
名校
解题方法
8 . 按要求填空:
(1)在第二周期中(稀有气体除外),第一电离能最大的元素的原子结构示意图是___ ,第一电离能最小的元素的电子排布图为___ 。
(2)以下是一些原子的2p能级和3d能级中电子排布的情况.试判断,哪些违反了泡利不相容原理,哪些违反了洪特规则。
① ②
② ③
③ ④
④ ⑤
⑤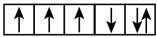 ⑥
⑥
违反泡利不相容原理的有__ ,违反洪特规则的有___ 。
(3)用VSEPR模型和杂化轨道理论相关知识填表:
(1)在第二周期中(稀有气体除外),第一电离能最大的元素的原子结构示意图是
(2)以下是一些原子的2p能级和3d能级中电子排布的情况.试判断,哪些违反了泡利不相容原理,哪些违反了洪特规则。
①
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥
违反泡利不相容原理的有
(3)用VSEPR模型和杂化轨道理论相关知识填表:
| 分子或离子 | 中心原子轨道杂化形式 | 分子或离子的立体结构 | 分子有无极性 |
| CH2O | |||
| NH4+ | |||
| CS2 |
您最近一年使用:0次
名校
解题方法
9 . 下列分子中的中心原子杂化轨道的类型相同的是( )
| A.SO3 与SO2 | B.BF3 与NH3 | C.BeCl2与SCl2 | D.H2O 与SO2 |
您最近一年使用:0次
2016-07-27更新
|
326次组卷
|
16卷引用:安徽省阜阳市太和中学2019-2020i学年高二下学期5月月考理科化学试题
安徽省阜阳市太和中学2019-2020i学年高二下学期5月月考理科化学试题(已下线)2011-2012学年四川省南充高中高二第一次月考化学试卷2014-2015河北省邢台市第一中学高二12月月考化学试卷2015-2016学年新疆哈密二中高二下期末化学试卷2016-2017学年山东省淄博市高青一中、淄博实验中学高二下学期期中联考化学试卷吉林省松原市扶余县第一中学2016-2017学年高二下学期期中考试化学试题河北省唐山市曹妃甸区第一中学2016-2017学年高二下学期期末考试化学试题河南省洛阳名校2017-2018学年高二上学期第二次联考化学试题吉林省扶余市第一中学2017-2018学年高二下学期期末考试化学试题【全国百强校】吉林省长春外国语学校2018-2019学年高二下学期第一次月考化学试题河南省焦作市济源市第六中学2019-2020学年高二下学期第二次月考化学试题陕西省西安中学2020-2021学年高二上学期期末考试化学试题吉林省长春市第二十九中学2020-2021学年高二下学期第一学程考试化学试题吉林省通化县综合高级中学2020-2021学年高二下学期期中考试化学试题江西省九江市柴桑区第一中学2020-2021学年高二下学期5月月考化学试题新疆乌鲁木齐市第四中学2021-2022学年高二下学期期中考试化学试题



