解题方法
1 . 2021年我国科学家在高效且稳定的全无机CsPbX3(X=Cl,Br,I)太阳能电池研究领域取得进展。
(1)写出基态Pb原子的外围电子排布图______ ,基态Cs原子核外共有______ 种不同运动状态的电子。
(2)I-可与I2形成 ,
, 中心原于的价层电子对数为
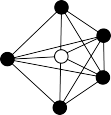
中心原于的价层电子对数为______ ,已知其VSEPR模型为三角双锥形(如图),则 的立体构型名称为
的立体构型名称为_______ 。
(3)化合物PCl5,、PBr5固态时均为离子晶体,其组成分别为[PCl4]+[PCl6]-、[PBr4]+Br-,分析PBr5中不存在类似[PCl6]-结构的原因:___________ 。
(4)卤素还可与金属形成丰富多彩的配合物,如与Pt(II)形成Pt(NH3)2Cl2.Pt(NH3)2Cl2有两种同分异构体(如图),其中顺铂是1969年发现的第一种具有抗癌活性的金属配合物,其配体为___________ ,推测在水中的溶解度顺铂___________ 反铂(填“>”或“<”)。

(5)CsPbI3晶体具有钙钛矿型的立方结构(如图),晶体中Cs+的配位数为___________ ,已知该晶体的密度为dg/cm3,阿伏加德罗常数值为NA,则晶胞参数a为___________ nm。
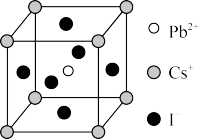
(6)CsPbI3晶胞结构的另一种表示中Cs+处于体心位置,则Pb2+处于______ 位置,I-处于______ 位置。
(1)写出基态Pb原子的外围电子排布图
(2)I-可与I2形成
 ,
, 中心原于的价层电子对数为
中心原于的价层电子对数为 的立体构型名称为
的立体构型名称为
(3)化合物PCl5,、PBr5固态时均为离子晶体,其组成分别为[PCl4]+[PCl6]-、[PBr4]+Br-,分析PBr5中不存在类似[PCl6]-结构的原因:
(4)卤素还可与金属形成丰富多彩的配合物,如与Pt(II)形成Pt(NH3)2Cl2.Pt(NH3)2Cl2有两种同分异构体(如图),其中顺铂是1969年发现的第一种具有抗癌活性的金属配合物,其配体为

(5)CsPbI3晶体具有钙钛矿型的立方结构(如图),晶体中Cs+的配位数为

(6)CsPbI3晶胞结构的另一种表示中Cs+处于体心位置,则Pb2+处于
您最近一年使用:0次
名校
解题方法
2 . 铁粉可用于处理水中污染物。铁粉的氧化物层可以导电。
(1)富铁矿石经破碎、筛分到微米级后,在氢气氛围下 高温还原1小时可以制备微米级铁粉。请写出磁铁矿与氢气反应制备铁的化学方程式:
高温还原1小时可以制备微米级铁粉。请写出磁铁矿与氢气反应制备铁的化学方程式:___________ 。
(2)采用 溶液还原铁盐,可以制备纳米级的铁粉,并生成
溶液还原铁盐,可以制备纳米级的铁粉,并生成 。
。
① 中
中 离子的空间构型为
离子的空间构型为___________ 。
②由 每生成
每生成 ,需要
,需要 物质的量是
物质的量是___________  。
。
(3)利用纳米铁粉可以有效处理废水中的 和
和 ,去除机理如图1所示。
,去除机理如图1所示。
①纳米铁粉去除污水中 和
和 机理不同,请解释原因并简述两者的区别
机理不同,请解释原因并简述两者的区别___________ 。


②由图2可知, 时,随
时,随 减小,
减小, 和
和 去除率减小的原因是
去除率减小的原因是___________ 。
(1)富铁矿石经破碎、筛分到微米级后,在氢气氛围下
 高温还原1小时可以制备微米级铁粉。请写出磁铁矿与氢气反应制备铁的化学方程式:
高温还原1小时可以制备微米级铁粉。请写出磁铁矿与氢气反应制备铁的化学方程式:(2)采用
 溶液还原铁盐,可以制备纳米级的铁粉,并生成
溶液还原铁盐,可以制备纳米级的铁粉,并生成 。
。①
 中
中 离子的空间构型为
离子的空间构型为②由
 每生成
每生成 ,需要
,需要 物质的量是
物质的量是 。
。(3)利用纳米铁粉可以有效处理废水中的
 和
和 ,去除机理如图1所示。
,去除机理如图1所示。①纳米铁粉去除污水中
 和
和 机理不同,请解释原因并简述两者的区别
机理不同,请解释原因并简述两者的区别

②由图2可知,
 时,随
时,随 减小,
减小, 和
和 去除率减小的原因是
去除率减小的原因是
您最近一年使用:0次
2022-01-24更新
|
466次组卷
|
2卷引用:江苏省海安市2021-2022学年高三上学期期末学业质量监测化学试题
解题方法
3 . 已知周期表前四周期的元素a、b、c、d、e、f原子序数依次增大。a的核外电子总数与其周期数相同,c原子的最外层电子数是内层电子数的3倍,b、c左右相邻,c与d同族,e元素正三价离子的3d能级为半充满,f原子的次外层全充满,最外层只有一个电子。请回答下列问题:
(1)元素e的原子核外共有______ 种不同运动状态的电子,有_____ 种不同能级的电子。
(2)实验室中制备ba3的化学方程式为____ ,产生的ba3与a2d比较,键角更大的是____ ,原因是_____ 。
(3)f晶胞为面心立方最密堆积,其空间利用率为________ ,由d、e、f组成的物质晶胞结构如图。

①该物质的化学式为___________ 。
②以该物质为原料炼f过程中,会产生d的低价氧化物,该d的低价氧化物分子空间构型为___________ ,与其互为等电子体的阴离子有___________ 。
(4)由a、b、c、d四种元素可组成两种酸式盐M和N,请写出M和N之间反应的离子方程式___________ 。
(1)元素e的原子核外共有
(2)实验室中制备ba3的化学方程式为
(3)f晶胞为面心立方最密堆积,其空间利用率为

①该物质的化学式为
②以该物质为原料炼f过程中,会产生d的低价氧化物,该d的低价氧化物分子空间构型为
(4)由a、b、c、d四种元素可组成两种酸式盐M和N,请写出M和N之间反应的离子方程式
您最近一年使用:0次
解题方法
4 . “祝融号”火星车在火星表面已完成计划内工作,其利用表面成分探测仪、多光谱相机等开展定点探测,一张公布的“祝融号”行进路上的火星岩石图象如图所示。研究发现,火星岩的主要成分为 和
和 。回答下列问题:
。回答下列问题:

(1)基态 原子核外电子占据能量最高的能级的电子云轮廓图为
原子核外电子占据能量最高的能级的电子云轮廓图为______ 。
(2)在上述氧化物中属于原子晶体的是_______ (填化学式)。
(3) 溶于
溶于 溶液生成
溶液生成 。
。 中Al的杂化类型是
中Al的杂化类型是_______ ,Al和O构成的空间结构是_______ 。
(4)配离子 中配位原子是C而不是O,可能的原因是
中配位原子是C而不是O,可能的原因是______ 。
(5)已知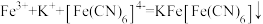 ,利用该离子方程式可以检验溶液中的
,利用该离子方程式可以检验溶液中的 。
。 中σ键、π键数目之比为
中σ键、π键数目之比为_______ 。
(6)已知铁和镁形成的晶胞如图所示。
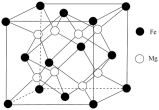
①在该晶胞中铁的配位数为___________ 。
②已知该晶胞参数为 。
。 为阿伏加德罗常数的值。两个
为阿伏加德罗常数的值。两个 原子的最近距离为
原子的最近距离为______  ,该晶胞的密度为
,该晶胞的密度为______ (只列计算式) 。
。
 和
和 。回答下列问题:
。回答下列问题:
(1)基态
 原子核外电子占据能量最高的能级的电子云轮廓图为
原子核外电子占据能量最高的能级的电子云轮廓图为(2)在上述氧化物中属于原子晶体的是
(3)
 溶于
溶于 溶液生成
溶液生成 。
。 中Al的杂化类型是
中Al的杂化类型是(4)配离子
 中配位原子是C而不是O,可能的原因是
中配位原子是C而不是O,可能的原因是(5)已知
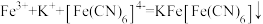 ,利用该离子方程式可以检验溶液中的
,利用该离子方程式可以检验溶液中的 。
。 中σ键、π键数目之比为
中σ键、π键数目之比为(6)已知铁和镁形成的晶胞如图所示。

①在该晶胞中铁的配位数为
②已知该晶胞参数为
 。
。 为阿伏加德罗常数的值。两个
为阿伏加德罗常数的值。两个 原子的最近距离为
原子的最近距离为 ,该晶胞的密度为
,该晶胞的密度为 。
。
您最近一年使用:0次
名校
解题方法
5 . 锰(Mn)、钴(Co)、镍(Ni)等过渡金属元素化合物的应用研究是前沿科学之一,回答下列问题:
(1)Mn的价电子排布式为___________ 。金属锰可导电、导热,有金属光泽和延展性,这些性质都可以用“___________ 理论”解释。
(2)已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列___________ (填序号),每个Mn原子周围紧邻的原子数为___________ 。
A. B.
B.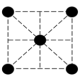 C.
C.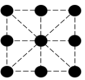 D.
D.
(3)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2。DMSO中硫原子的杂化轨道类型为___________ ,SO(CH3)2中键角∠C—S—O___________ CH3COCH3中键角∠C—C—O(填“大于”“小于”或“等于”),ClO 的空间构型是
的空间构型是___________ ,元素S、Cl、O的电负性由大到小的顺序为___________ 。
(4)镍和苯基硼酸在催化剂作用下可以合成丙烯醇(CH2=CH—CH2OH),其相对分子质量等于丙醛(CH3CH2CHO),但两者沸点相差较大,原因是___________ 。
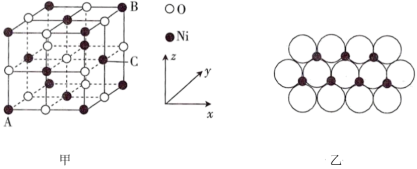
(5)NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,1),则C的离子坐标参数为___________ 。一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为apm,设阿伏加德罗常数值为NA,每平方米面积上具有该晶体的质量为___________ g(用含a、NA的代数式表示)。
(1)Mn的价电子排布式为
(2)已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列
A.
 B.
B. C.
C. D.
D.
(3)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2。DMSO中硫原子的杂化轨道类型为
 的空间构型是
的空间构型是(4)镍和苯基硼酸在催化剂作用下可以合成丙烯醇(CH2=CH—CH2OH),其相对分子质量等于丙醛(CH3CH2CHO),但两者沸点相差较大,原因是
(5)NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,1),则C的离子坐标参数为

您最近一年使用:0次
2021-12-23更新
|
1199次组卷
|
9卷引用:广东省“六校联盟”2021-2022学年高三上学期第三次联考化学试题
广东省“六校联盟”2021-2022学年高三上学期第三次联考化学试题(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)四川省成都市成都外国语学校2022届高三下学期第二次诊断性考试理科综合化学试题黑龙江省哈尔滨师范大学附属中学2022-2023学年高三上学期10月月考化学试题黑龙江省绥化市绥棱县第一中学2022-2023学年高三上学期10月月考化学试题四川省南充高级中学2023-2024学年高三下学期第二次模拟考试化学四川省南充高级中学2024届高三第二次模拟考试理综-化学试题
2021高三·全国·专题练习
解题方法
6 . 铬的同位素有 Cr、
Cr、 Cr、
Cr、 Cr、
Cr、 Cr。铬及其化合物在生活、生产中有广泛应用。回答下列问题:
Cr。铬及其化合物在生活、生产中有广泛应用。回答下列问题:
(1)基态 Cr的价层电子排布图为
Cr的价层电子排布图为___________ 。
(2)交警用“酒精仪”查酒驾,其化学反应原理为2K2Cr2O7+3CH3CH2OH+8H2SO4―→3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O。
①CH3CH2OH、CH3COOH的沸点高于对应的CH3OCH3(二甲醚)、HCOOCH3(甲酸甲酯),主要原因是___________ 。
②CH3COOH分子中碳原子的杂化类型是___________ ;CH3COOH分子中σ键和π键的数目之比为___________ 。
③K2SO4晶体中阴离子的立体构型是___________ 。
该反应中,只含极性键的极性分子有___________ (填分子式)。
(3)CrF3晶体、CrBr3晶体的熔点分别为1 100 ℃以上、79 ℃,其可能的原因是___________ 。
(4)晶体铬的晶胞结构如图所示,其堆积模型为___________ ;铬原子的配位数为___________ 。

 Cr、
Cr、 Cr、
Cr、 Cr、
Cr、 Cr。铬及其化合物在生活、生产中有广泛应用。回答下列问题:
Cr。铬及其化合物在生活、生产中有广泛应用。回答下列问题:(1)基态
 Cr的价层电子排布图为
Cr的价层电子排布图为(2)交警用“酒精仪”查酒驾,其化学反应原理为2K2Cr2O7+3CH3CH2OH+8H2SO4―→3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O。
①CH3CH2OH、CH3COOH的沸点高于对应的CH3OCH3(二甲醚)、HCOOCH3(甲酸甲酯),主要原因是
②CH3COOH分子中碳原子的杂化类型是
③K2SO4晶体中阴离子的立体构型是
该反应中,只含极性键的极性分子有
(3)CrF3晶体、CrBr3晶体的熔点分别为1 100 ℃以上、79 ℃,其可能的原因是
(4)晶体铬的晶胞结构如图所示,其堆积模型为

您最近一年使用:0次
解题方法
7 . 锆是冶金工业的“维生素”,它与氧族元素(O、S、Se、Te)形成的化合物在材料工业中应用广泛。其中碲化锆(ZrTe2)和硒化锆(ZrSe2)均为新型材料,氧化锆(ZrO2)具有特殊的热电性,氧化锆常用作陶瓷绝缘材料和陶瓷遮光剂。
(1)氧族元素各基态原子第一电离能随原子序数增大依次减小的原因为________ 。
(2)Zr(ClO4)4是一种常见的锆盐, 的空间构型为
的空间构型为_______ ,其中Cl原子的杂化方式为_______ 。
(3)如图为硒化锆的分子结构(图甲)和氧化锆的晶胞结构(图乙)。
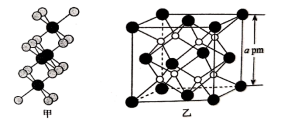
①硒化锆的沸点远低于氧化锆,原因为_______ ,硒化锆和氧化锆的配位数分别为_______ 、______ 。
②已知阿伏加德罗常数的值为NA,据图乙中数据计算氧化锆的密度为_______ g‧cm-3(用含NA和a的代数式表示,列式即可)
(1)氧族元素各基态原子第一电离能随原子序数增大依次减小的原因为
(2)Zr(ClO4)4是一种常见的锆盐,
 的空间构型为
的空间构型为(3)如图为硒化锆的分子结构(图甲)和氧化锆的晶胞结构(图乙)。

①硒化锆的沸点远低于氧化锆,原因为
②已知阿伏加德罗常数的值为NA,据图乙中数据计算氧化锆的密度为
您最近一年使用:0次
名校
解题方法
8 . 世界上首个五氮阴离子盐是(N5)6(H3O)3(NH4)4Cl(用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。回答下列问题:

(1)基态氮原子的价电子的轨道表达式为_______ 。
(2)从结构角度分析,R中两种阳离子的相同之处为_______。(填标号)
(3)R中阴离子N 中的σ键总数为
中的σ键总数为_______ 个。分子中的大π键可用符号 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为 ),则N
),则N 中的大π键应表示为
中的大π键应表示为_______ 。
(4)图中虚线代表氢键,其表示式为(H3O+)O—H…N、_______ 、_______ 。

(1)基态氮原子的价电子的轨道表达式为
(2)从结构角度分析,R中两种阳离子的相同之处为_______。(填标号)
| A.中心原子的杂化轨道类型 | B.中心原子的价层电子对数 |
| C.VSEPR模型名称 | D.共价键类型 |
 中的σ键总数为
中的σ键总数为 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为 ),则N
),则N 中的大π键应表示为
中的大π键应表示为(4)图中虚线代表氢键,其表示式为(H3O+)O—H…N、
您最近一年使用:0次
解题方法
9 . ⅣA族元素及其化合物在材料等方面有重要用途,碳在自然界中存在多种同素异形体,硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
(1)碳的一种单质的晶胞结构如图(a)所示。该单质的晶体类型为___ ,原子间存在的共价键类型为___ (填“σ键”、“π键”),碳原子杂化方式为___ 。

(2)基态Ge原子的核外电子排布式为[Ar]___ ,有___ 个未成对电子。
(3)硅和卤素单质反应可以得到SiX4,SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
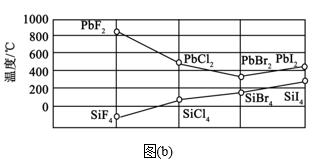
①0℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是___ (填化学式),沸点依次升高的原因是___ ,气态分子SiX4的空间构型是__ 。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I的次序,PbX2中的化学键的离子性__ 、共价性__ 。(填“增强”“不变”或“减弱”)
(4)立方氮化硼的结构与图(a)相似,已知晶胞边长为361.5pm,则立方氮化硼的密度是___ g·cm-3。(只要求列算式,不必计算出数值,阿伏加德罗常数用NA表示)
(1)碳的一种单质的晶胞结构如图(a)所示。该单质的晶体类型为

(2)基态Ge原子的核外电子排布式为[Ar]
(3)硅和卤素单质反应可以得到SiX4,SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。

①0℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I的次序,PbX2中的化学键的离子性
(4)立方氮化硼的结构与图(a)相似,已知晶胞边长为361.5pm,则立方氮化硼的密度是
您最近一年使用:0次
2021高三·山东·专题练习
解题方法
10 . CuInSe2晶体具有优良的光学特性,是当今光电转换领域的研究热点和太阳能电池吸收层的理想材料。回答下列问题:
(1)硒(Se)是人体内必需的微量元素之一、基态Se原子的电子排布式为[Ar]___________ 。H2O、H2S和H2Se的沸点由低到高的顺序为___________ (填化学式,下同),还原性由弱到强的顺序为___________ ,键角由小到大的顺序为___________ 。SeF2分子存在角形和直线形两种异构体,其中直线形分子的键长较长,___________ 分子的能量较大。
(2)铟(In)为ⅢA族元素,InF3和InI3的熔点分别是1170℃和210℃,熔点差异的原因是___________ 。在乙醚中InCl3和LiH反应生成LiInH4,LiInH4中阴离子的空间结构为___________ 。
(3)四方晶系CuInSe2的晶胞结构如图所示,晶胞参数为a=b=a pm,c=c pm,α=β=γ=90°。设阿伏加德罗常数的值为NA,CuInSe2的相对质量为M,则该晶体密度ρ=___________ g·cm-3(用含有a、c、M和NA的代数式表示)。该晶胞中,原子坐标分别为1号Se原子___________ ,2号Cu原子(0,0.5,0.25),3号In原子(0,0.5,0.75)。晶体中有___________ 个Se原子距离4号Cu原子最近。

(1)硒(Se)是人体内必需的微量元素之一、基态Se原子的电子排布式为[Ar]
(2)铟(In)为ⅢA族元素,InF3和InI3的熔点分别是1170℃和210℃,熔点差异的原因是
(3)四方晶系CuInSe2的晶胞结构如图所示,晶胞参数为a=b=a pm,c=c pm,α=β=γ=90°。设阿伏加德罗常数的值为NA,CuInSe2的相对质量为M,则该晶体密度ρ=

您最近一年使用:0次



