解题方法
1 . 铜及其化合物是生活、生产中运用广泛的材料。
(1)铜元素在周期表中的位置是___________ ,基态 原子核外电子占据最高能层的符号是
原子核外电子占据最高能层的符号是___________ 。
(2)合成氨工业常用醋酸二氨合铜(I){ }溶液吸收对氨合成的催化剂有毒害作用的
}溶液吸收对氨合成的催化剂有毒害作用的 。
。
① 中存在的化学键类型有
中存在的化学键类型有___________ 。
② 的沸点比
的沸点比 的沸点
的沸点___________ ,原因是___________ 。 的键角小于
的键角小于 的键角,原因是
的键角,原因是___________ 。
(3)晶胞的两个基本要素。
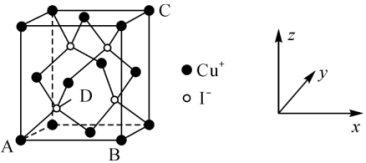
①原子坐标参数:晶胞内部各微粒的相对位置。 的晶胞结构如图所示,其中原子坐标参数:A
的晶胞结构如图所示,其中原子坐标参数:A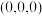 ;B
;B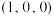 ;C
;C 。则
。则 处微粒的坐标参数为
处微粒的坐标参数为___________ 。
②晶胞参数:描述晶胞的大小和形状。若晶胞的边长为 ,则
,则 与
与 的最短距离为
的最短距离为___________  ,设
,设 为阿伏加德罗常数的值,该化合物的密度为
为阿伏加德罗常数的值,该化合物的密度为___________ (用含 、
、 的代数式表示)
的代数式表示) 。
。
(1)铜元素在周期表中的位置是
 原子核外电子占据最高能层的符号是
原子核外电子占据最高能层的符号是(2)合成氨工业常用醋酸二氨合铜(I){
 }溶液吸收对氨合成的催化剂有毒害作用的
}溶液吸收对氨合成的催化剂有毒害作用的 。
。①
 中存在的化学键类型有
中存在的化学键类型有②
 的沸点比
的沸点比 的沸点
的沸点 的键角小于
的键角小于 的键角,原因是
的键角,原因是(3)晶胞的两个基本要素。
①原子坐标参数:晶胞内部各微粒的相对位置。
 的晶胞结构如图所示,其中原子坐标参数:A
的晶胞结构如图所示,其中原子坐标参数:A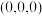 ;B
;B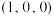 ;C
;C 。则
。则 处微粒的坐标参数为
处微粒的坐标参数为
②晶胞参数:描述晶胞的大小和形状。若晶胞的边长为
 ,则
,则 与
与 的最短距离为
的最短距离为 ,设
,设 为阿伏加德罗常数的值,该化合物的密度为
为阿伏加德罗常数的值,该化合物的密度为 、
、 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次
解题方法
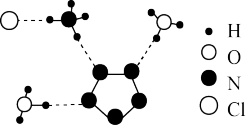
2 . 我国科学家最近成功合成了世界上首个五氮阴离子盐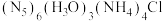 (用R代表)。经X射线衍射测得化合物R的晶体局部结构如图所示(已知
(用R代表)。经X射线衍射测得化合物R的晶体局部结构如图所示(已知 是平面结构)。下列说法不正确的是
是平面结构)。下列说法不正确的是
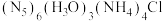 (用R代表)。经X射线衍射测得化合物R的晶体局部结构如图所示(已知
(用R代表)。经X射线衍射测得化合物R的晶体局部结构如图所示(已知 是平面结构)。下列说法不正确的是
是平面结构)。下列说法不正确的是
| A.化合物R中存在极性键和非极性键 |
| B.化合物R中存在氢键 |
C. 中氧原子采取 中氧原子采取 杂化, 杂化, 中氮原子采取 中氮原子采取 杂化 杂化 |
D.阴离子 中氮原子是 中氮原子是 杂化 杂化 |
您最近一年使用:0次
2022-06-30更新
|
391次组卷
|
3卷引用:河北省沧州市2021-2022学年高二下学期期末考试化学试题
名校
解题方法
3 . 液氨是一种很好的溶剂,液氨可以微弱的电离产生NH 和NH
和NH 。NH3中的一个H原子若被-NH2取代可形成N2H4(联氨),若被-OH取代可形成NH2OH(羟胺)。在有NH
。NH3中的一个H原子若被-NH2取代可形成N2H4(联氨),若被-OH取代可形成NH2OH(羟胺)。在有NH 存在时,Cu(OH)2能溶于氨水形成[Cu(NH3)4]2+。NH3经过一定的转化可以形成N2、NO、NO2、N2O4(无色)、HNO3等。下列有关NH2OH、NH3、NH
存在时,Cu(OH)2能溶于氨水形成[Cu(NH3)4]2+。NH3经过一定的转化可以形成N2、NO、NO2、N2O4(无色)、HNO3等。下列有关NH2OH、NH3、NH 、NO
、NO 的说法正确的是
的说法正确的是
 和NH
和NH 。NH3中的一个H原子若被-NH2取代可形成N2H4(联氨),若被-OH取代可形成NH2OH(羟胺)。在有NH
。NH3中的一个H原子若被-NH2取代可形成N2H4(联氨),若被-OH取代可形成NH2OH(羟胺)。在有NH 存在时,Cu(OH)2能溶于氨水形成[Cu(NH3)4]2+。NH3经过一定的转化可以形成N2、NO、NO2、N2O4(无色)、HNO3等。下列有关NH2OH、NH3、NH
存在时,Cu(OH)2能溶于氨水形成[Cu(NH3)4]2+。NH3经过一定的转化可以形成N2、NO、NO2、N2O4(无色)、HNO3等。下列有关NH2OH、NH3、NH 、NO
、NO 的说法正确的是
的说法正确的是| A.NH2OH难溶于水 | B.NO 的空间构型为直线形 的空间构型为直线形 |
C.NH3的键角比NH 中的大 中的大 | D.[Cu(NH3)4]2+中提供孤电子对的原子是Cu |
您最近一年使用:0次
2022-05-30更新
|
772次组卷
|
2卷引用:江苏省扬州中学2022届高三下学期考前模拟(三)化学试题
4 . “碳中和”的一种重要方案就是将 转化处理为有用物质或能源转化,由于
转化处理为有用物质或能源转化,由于 分子的结构非常稳定,不容易活化,常用的方法有,光化学催化,热催化光催化、热催化及光热催化法。
分子的结构非常稳定,不容易活化,常用的方法有,光化学催化,热催化光催化、热催化及光热催化法。
(1) 的
的 模型是
模型是_______ 形非极性对称分子,其中C原子的轨道杂化类型是_______ 。
(2)研究表明,在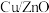 催化剂存在下,
催化剂存在下, 和
和 可发生两个平行反应,分别生成
可发生两个平行反应,分别生成 和
和 。反应的热化学方程式如下:
。反应的热化学方程式如下:
I.
II.
已知:① 和
和 的标准燃烧热分别为
的标准燃烧热分别为 和
和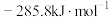
②
反应Ⅱ的
_______  。
。
(3) 与
与 可以用来生产尿素
可以用来生产尿素 ,其反应过程为:
,其反应过程为: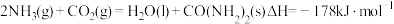 。
。
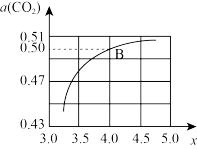
① 时,在
时,在 的密闭容器中充入
的密闭容器中充入 与
与 模拟工业生产。投料比
模拟工业生产。投料比 ,图是
,图是 平衡转化率
平衡转化率 与X的关系。则图中B点
与X的关系。则图中B点 的平衡转化率
的平衡转化率
_______ 。
②当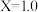 时,若起始的压强为
时,若起始的压强为 ,水为液态,平衡时压强变为起始的
,水为液态,平衡时压强变为起始的 。用平衡分压(分压=总压×物质的量分数)代替平衡浓度表示该反应的平衡常数
。用平衡分压(分压=总压×物质的量分数)代替平衡浓度表示该反应的平衡常数
_______ 。
(4)以二氧化钛表面覆盖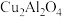 为催化剂,可以将
为催化剂,可以将 和
和 直接转化成乙酸。
直接转化成乙酸。

①在不同温度下催化剂的催化效率与乙酸的生成速率的变化情况如图Ⅲ所示。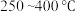 阶段,温度升高而乙酸的生成速率变化的原因是
阶段,温度升高而乙酸的生成速率变化的原因是_______ 。
②为了提高该反应中 的转化率,可以采取的措施是
的转化率,可以采取的措施是_______ 。
(5)纳米二氧化钛膜中 的电对吸附
的电对吸附 并将其还原。以纳米二氧化钛膜为工作电极,以一定浓度的硫酸为介质,在一定条件下通入
并将其还原。以纳米二氧化钛膜为工作电极,以一定浓度的硫酸为介质,在一定条件下通入 进行电解,在阴极可制得低密度聚乙烯(
进行电解,在阴极可制得低密度聚乙烯(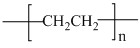 简称
简称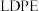 )。电解时,
)。电解时, 最终转化为
最终转化为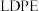 的电极反应式是
的电极反应式是_______ 。
(6)绿色植物进行光合作用的简易流程如下图:

①写出暗反应过程中 发生转化的总反应方程式:
发生转化的总反应方程式:_______ 。光反应过程中水分解为氧气脱离体系对于暗反应阶段的意义是:_______ (一条即可)。
②下图为光电催化能源化利用 制备太阳能燃料的示意图。下列说法正确的是
制备太阳能燃料的示意图。下列说法正确的是_______ 。

A.阳极反应式为
B. 还原产物可能为
还原产物可能为 等
等
C.阳极、阴极材料互换对制备太阳能燃料影响不大
 转化处理为有用物质或能源转化,由于
转化处理为有用物质或能源转化,由于 分子的结构非常稳定,不容易活化,常用的方法有,光化学催化,热催化光催化、热催化及光热催化法。
分子的结构非常稳定,不容易活化,常用的方法有,光化学催化,热催化光催化、热催化及光热催化法。(1)
 的
的 模型是
模型是(2)研究表明,在
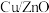 催化剂存在下,
催化剂存在下, 和
和 可发生两个平行反应,分别生成
可发生两个平行反应,分别生成 和
和 。反应的热化学方程式如下:
。反应的热化学方程式如下:I.

II.

已知:①
 和
和 的标准燃烧热分别为
的标准燃烧热分别为 和
和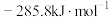
②

反应Ⅱ的

 。
。(3)
 与
与 可以用来生产尿素
可以用来生产尿素 ,其反应过程为:
,其反应过程为: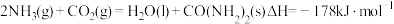 。
。①
 时,在
时,在 的密闭容器中充入
的密闭容器中充入 与
与 模拟工业生产。投料比
模拟工业生产。投料比 ,图是
,图是 平衡转化率
平衡转化率 与X的关系。则图中B点
与X的关系。则图中B点 的平衡转化率
的平衡转化率

②当
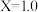 时,若起始的压强为
时,若起始的压强为 ,水为液态,平衡时压强变为起始的
,水为液态,平衡时压强变为起始的 。用平衡分压(分压=总压×物质的量分数)代替平衡浓度表示该反应的平衡常数
。用平衡分压(分压=总压×物质的量分数)代替平衡浓度表示该反应的平衡常数
(4)以二氧化钛表面覆盖
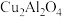 为催化剂,可以将
为催化剂,可以将 和
和 直接转化成乙酸。
直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率的变化情况如图Ⅲ所示。
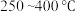 阶段,温度升高而乙酸的生成速率变化的原因是
阶段,温度升高而乙酸的生成速率变化的原因是②为了提高该反应中
 的转化率,可以采取的措施是
的转化率,可以采取的措施是(5)纳米二氧化钛膜中
 的电对吸附
的电对吸附 并将其还原。以纳米二氧化钛膜为工作电极,以一定浓度的硫酸为介质,在一定条件下通入
并将其还原。以纳米二氧化钛膜为工作电极,以一定浓度的硫酸为介质,在一定条件下通入 进行电解,在阴极可制得低密度聚乙烯(
进行电解,在阴极可制得低密度聚乙烯(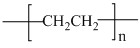 简称
简称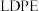 )。电解时,
)。电解时, 最终转化为
最终转化为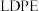 的电极反应式是
的电极反应式是(6)绿色植物进行光合作用的简易流程如下图:

①写出暗反应过程中
 发生转化的总反应方程式:
发生转化的总反应方程式:②下图为光电催化能源化利用
 制备太阳能燃料的示意图。下列说法正确的是
制备太阳能燃料的示意图。下列说法正确的是
A.阳极反应式为

B.
 还原产物可能为
还原产物可能为 等
等C.阳极、阴极材料互换对制备太阳能燃料影响不大
您最近一年使用:0次
5 . A、B、C、D、E为原子序数依次增大的五种短周期元素,其中C为第三周期简单离子半径最小的元素, A、B、D的最高价氧化物对应的水化物溶液加水稀释时溶液的
A、B、D的最高价氧化物对应的水化物溶液加水稀释时溶液的 变化情况如图所示,则下列说法中错误的是
变化情况如图所示,则下列说法中错误的是

 A、B、D的最高价氧化物对应的水化物溶液加水稀释时溶液的
A、B、D的最高价氧化物对应的水化物溶液加水稀释时溶液的 变化情况如图所示,则下列说法中错误的是
变化情况如图所示,则下列说法中错误的是 
| A.浓的D最高价氧化物对应水化物溶液在加热条件下可以与C发生反应 |
B.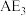 分子空间结构为三角锥形 分子空间结构为三角锥形 |
| C.B、D、E的单质或者化合物能作漂白剂 |
D. 具有两性,既能和酸反应也能和碱反应 具有两性,既能和酸反应也能和碱反应 |
您最近一年使用:0次
2022-05-25更新
|
871次组卷
|
4卷引用:辽宁省辽南协作体2022届高三第三次模拟考试化学试题
辽宁省辽南协作体2022届高三第三次模拟考试化学试题辽宁省沈阳市2021-2022学年高三下学期第三次模拟考试化学试题(已下线)考点07 元素周期律和元素周期表-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第16讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(全国通用)
6 . 近年,我国科学家通过热磷化法制备出了电催化分解水的催化剂Co-Fe-P和Ni-Fe-P等过渡金属磷化物,将推动电解水制氢技术的快速发展。回答下列问题:
(1)铁元素在元素周期表中的位置_______ ,Fe3+的价电子排布式_______ 。
(2)磷的一些卤化物的熔沸点如表所示,试解释PF3、PCl3、PBr3、PI3熔沸点逐渐升高的原因_______
(3)磷酸具有很强的配位能力,PO 的中心原子杂化类型为
的中心原子杂化类型为_______ ,写出与PO 互为等电子体的一种分子
互为等电子体的一种分子_______
(4)钴的配合物种类很多,如[Co(NO2)(NH3)5]Cl2和[Co(NH3)4Cl2]Cl等,[Co(NO2)(NH3)5]2+的配位数是_______ ,其配体中的NH3的分子空间构型为_______ ;等物质的量的[Co(NO2)(NH3)5]Cl2和[Co(NH3)4Cl2]Cl分别与足量的硝酸银溶液反应,两者生成氯化银的质量比为_______ 。
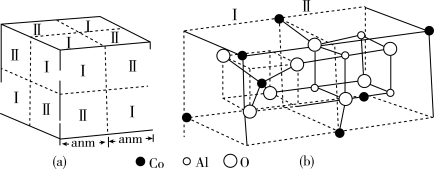
(5)钴蓝晶体结构如图(a)所示,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成,求晶体的化学式为_______ ,密度为_______ g·cm-3。
(1)铁元素在元素周期表中的位置
(2)磷的一些卤化物的熔沸点如表所示,试解释PF3、PCl3、PBr3、PI3熔沸点逐渐升高的原因
| 卤化磷 | 熔点/K | 沸点/K |
| PF3 | 121.5 | 171.5 |
| PCl3 | 161 | 348.5 |
| PBr3 | 233 | 451.2 |
| PI3 | 334 | 573 |
 的中心原子杂化类型为
的中心原子杂化类型为 互为等电子体的一种分子
互为等电子体的一种分子(4)钴的配合物种类很多,如[Co(NO2)(NH3)5]Cl2和[Co(NH3)4Cl2]Cl等,[Co(NO2)(NH3)5]2+的配位数是
(5)钴蓝晶体结构如图(a)所示,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成,求晶体的化学式为

您最近一年使用:0次
名校
解题方法
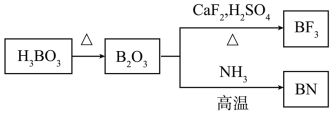
7 . Ⅰ.用硼镁矿(主要成分为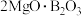 ,含
,含 、
、 、铁的氧化物等杂质)生产硼酸(H3BO3)并回收硫酸镁的工艺流程如图:
、铁的氧化物等杂质)生产硼酸(H3BO3)并回收硫酸镁的工艺流程如图:
(1)“酸浸”过程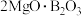 发生的主要化学反应方程式为
发生的主要化学反应方程式为_______ 。为避免“酸浸”产生大量气泡使物料溢出,应采取的措施为_______ 。
(2)“除杂”时向滤液中加入 和试剂a,
和试剂a, 的作用为
的作用为_______ (用离子方程式表示)。试剂a为_______ 。
(3)硫酸镁的溶解度随温度变化曲线如图所示。为从“母液”中充分回收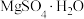 ,应保持“母液”在
,应保持“母液”在_______ ℃以上蒸发浓缩结晶、_______ ,再用乙醇洗涤后干燥。_______ 。
(5)在 中,F-B-F的键角是
中,F-B-F的键角是_______ , 和过NaF作用可生成
和过NaF作用可生成 ,
, 的空间结构为
的空间结构为_______ 。 的电子式为
的电子式为_______ 。
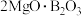 ,含
,含 、
、 、铁的氧化物等杂质)生产硼酸(H3BO3)并回收硫酸镁的工艺流程如图:
、铁的氧化物等杂质)生产硼酸(H3BO3)并回收硫酸镁的工艺流程如图: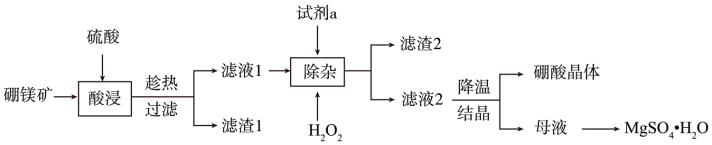
(1)“酸浸”过程
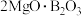 发生的主要化学反应方程式为
发生的主要化学反应方程式为(2)“除杂”时向滤液中加入
 和试剂a,
和试剂a, 的作用为
的作用为(3)硫酸镁的溶解度随温度变化曲线如图所示。为从“母液”中充分回收
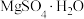 ,应保持“母液”在
,应保持“母液”在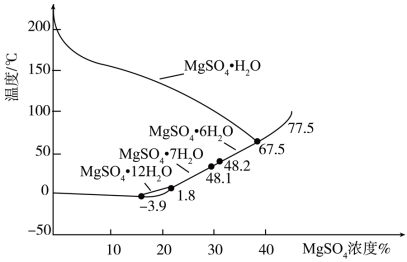
(5)在
 中,F-B-F的键角是
中,F-B-F的键角是 和过NaF作用可生成
和过NaF作用可生成 ,
, 的空间结构为
的空间结构为 的电子式为
的电子式为
您最近一年使用:0次
2022-05-03更新
|
286次组卷
|
2卷引用:广东省广州市第六中学2021-2022学年高二下学期期中测试化学试题
解题方法
8 . 中国科学技术大学吴长征教授团队通过四烷基铵阳离子的插层及随后对合适氧化还原电位的选择,成功剥离制备出二维非范德华 纳米片。回答下列问题:
纳米片。回答下列问题:
(1)基态硫原子核外有_______ 种电子运动状态, 与铜元素同族,其基态原子价电子排布式
与铜元素同族,其基态原子价电子排布式_______ 。
(2)氧族元素有氧、硫、硒、碲等元素。 的
的 模型为
模型为_______ , 中碲的杂化轨道类型是
中碲的杂化轨道类型是_______ 。
(3)高氧化态 的过氧化物大多不稳定,容易分解,但
的过氧化物大多不稳定,容易分解,但 却是稳定的。这种配合物仍保持
却是稳定的。这种配合物仍保持 的过氧化物的结构特点,
的过氧化物的结构特点, 该配合物含有
该配合物含有_______  配位键(
配位键( 与O、N均形成了配位键);该结构中
与O、N均形成了配位键);该结构中 键角
键角_______  (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
(4) 晶胞与
晶胞与 晶胞相似(如图),
晶胞相似(如图), 晶胞中部分原子的分数坐标为:A点
晶胞中部分原子的分数坐标为:A点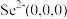 ,从该晶胞中找出距离B点
,从该晶胞中找出距离B点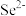 最远的
最远的 的位置
的位置_______ (用分数坐标表示),晶胞中距离最近的两个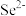 的距离为
的距离为 ,请计算
,请计算 晶胞的密度
晶胞的密度_______  。
。

 纳米片。回答下列问题:
纳米片。回答下列问题:(1)基态硫原子核外有
 与铜元素同族,其基态原子价电子排布式
与铜元素同族,其基态原子价电子排布式(2)氧族元素有氧、硫、硒、碲等元素。
 的
的 模型为
模型为 中碲的杂化轨道类型是
中碲的杂化轨道类型是(3)高氧化态
 的过氧化物大多不稳定,容易分解,但
的过氧化物大多不稳定,容易分解,但 却是稳定的。这种配合物仍保持
却是稳定的。这种配合物仍保持 的过氧化物的结构特点,
的过氧化物的结构特点, 该配合物含有
该配合物含有 配位键(
配位键( 与O、N均形成了配位键);该结构中
与O、N均形成了配位键);该结构中 键角
键角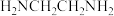 (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。(4)
 晶胞与
晶胞与 晶胞相似(如图),
晶胞相似(如图), 晶胞中部分原子的分数坐标为:A点
晶胞中部分原子的分数坐标为:A点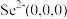 ,从该晶胞中找出距离B点
,从该晶胞中找出距离B点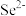 最远的
最远的 的位置
的位置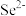 的距离为
的距离为 ,请计算
,请计算 晶胞的密度
晶胞的密度 。
。
您最近一年使用:0次
解题方法
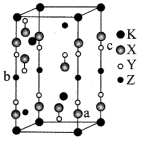
9 . 光电材料[氟代硼铍酸钾晶体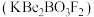 等]是目前科学家特别关注的材料。其结构如图,其中氧原子已省略,图中的原子分别位于立方体的顶点、棱及面上,可由BeO、
等]是目前科学家特别关注的材料。其结构如图,其中氧原子已省略,图中的原子分别位于立方体的顶点、棱及面上,可由BeO、 和
和 在一定条件下制得,同时放出
在一定条件下制得,同时放出 气体。
气体。
(1)基态B原子中有_______ 种能量不同的电子,存在未成对电子的能级电子云空间有_______ 种伸展方向。
(2)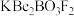 结构图中X表示
结构图中X表示_______ (填元素符号),组成元素中非金属元素的电负性由强到弱的顺序为_______ (填元素符号); 中B原子的杂化方式为
中B原子的杂化方式为_______ ,已知苯分子中含有大 键,可记为
键,可记为 (右下角“6”表示6个原子,右上角“6”表示6个共用电子),实验测得
(右下角“6”表示6个原子,右上角“6”表示6个共用电子),实验测得 分子中B-F键的键长远小于二者原子半径之和,所以
分子中B-F键的键长远小于二者原子半径之和,所以 分子中存在大
分子中存在大 键,可表示为
键,可表示为_______ 。
(3)已知卤化物的水解机理分亲核水解和亲电水解。发生亲核水解的结构条件:中心原子具有 和有空的价轨道;发生亲电水解的结构条件:中心原子有孤对电子,接受
和有空的价轨道;发生亲电水解的结构条件:中心原子有孤对电子,接受 的
的 进攻。则
进攻。则 发生水解的产物是
发生水解的产物是_______ 。
(4)已知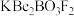 结构图中,X-Y的键长为r,a、b原子的分数坐标分别为
结构图中,X-Y的键长为r,a、b原子的分数坐标分别为 、
、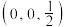 ,则c原子的分数坐标为
,则c原子的分数坐标为_______ ,若立方体边长分别为m,m,n(单位为pm),则该晶体的密度为_______  (列出计算式)。
(列出计算式)。
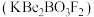 等]是目前科学家特别关注的材料。其结构如图,其中氧原子已省略,图中的原子分别位于立方体的顶点、棱及面上,可由BeO、
等]是目前科学家特别关注的材料。其结构如图,其中氧原子已省略,图中的原子分别位于立方体的顶点、棱及面上,可由BeO、 和
和 在一定条件下制得,同时放出
在一定条件下制得,同时放出 气体。
气体。
(1)基态B原子中有
(2)
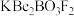 结构图中X表示
结构图中X表示 中B原子的杂化方式为
中B原子的杂化方式为 键,可记为
键,可记为 (右下角“6”表示6个原子,右上角“6”表示6个共用电子),实验测得
(右下角“6”表示6个原子,右上角“6”表示6个共用电子),实验测得 分子中B-F键的键长远小于二者原子半径之和,所以
分子中B-F键的键长远小于二者原子半径之和,所以 分子中存在大
分子中存在大 键,可表示为
键,可表示为(3)已知卤化物的水解机理分亲核水解和亲电水解。发生亲核水解的结构条件:中心原子具有
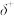 和有空的价轨道;发生亲电水解的结构条件:中心原子有孤对电子,接受
和有空的价轨道;发生亲电水解的结构条件:中心原子有孤对电子,接受 的
的 进攻。则
进攻。则 发生水解的产物是
发生水解的产物是(4)已知
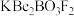 结构图中,X-Y的键长为r,a、b原子的分数坐标分别为
结构图中,X-Y的键长为r,a、b原子的分数坐标分别为 、
、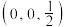 ,则c原子的分数坐标为
,则c原子的分数坐标为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
解题方法
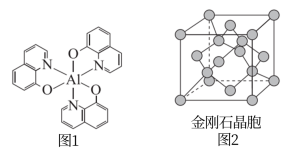
10 . 光电材料在能源军事等领域有重要应用,分为无机光电材料如ZnS、ZnSe、GaAs、 等,及有机光电材料(如图1所示化合物)。回答下列问题:
等,及有机光电材料(如图1所示化合物)。回答下列问题:
(1)基态Zn原子的价层电子排布图为_____ ;Ga、As、Se的第一电离能由大到小的顺序为___________ 。
(2)图1所示化合物中所含有的化学键类型有_____ (填选项字母),N原子的杂化方式为_____ 。
A.共价键 B.离子键 C.配位键 D.氢键
(3)在水溶液中,以 为电子供体,
为电子供体, 在
在 光催化剂上可还原为CO,部分氧化物的沸点如表所示:
光催化剂上可还原为CO,部分氧化物的沸点如表所示:
①表中氧化物之间沸点差异的原因为___________ 。
② 的VSEPR模型为
的VSEPR模型为___________ 。
③ 和
和 分子中,键角更大的是
分子中,键角更大的是___________ 。
(4)ZnS和ZnSe晶体的立方晶胞结构相似,均可看作将金刚石晶胞(如图2)内部的碳原子用Zn代替,晶胞顶角与面心位置的碳原子被S或Se代替。
①ZnS晶体中,Zn原子在S原子围成的正四面体空隙中的占用率为___________ 。
②若阿伏加德罗常数的值为 ,ZnS晶体的密度为
,ZnS晶体的密度为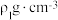 ,ZnSe晶体的密度为
,ZnSe晶体的密度为 ,则ZnS晶体中Zn与S原子最短距离和ZnSe晶体中Zn与Se原子最短距离之比为
,则ZnS晶体中Zn与S原子最短距离和ZnSe晶体中Zn与Se原子最短距离之比为___________ 。
 等,及有机光电材料(如图1所示化合物)。回答下列问题:
等,及有机光电材料(如图1所示化合物)。回答下列问题:(1)基态Zn原子的价层电子排布图为
(2)图1所示化合物中所含有的化学键类型有
A.共价键 B.离子键 C.配位键 D.氢键

(3)在水溶液中,以
 为电子供体,
为电子供体, 在
在 光催化剂上可还原为CO,部分氧化物的沸点如表所示:
光催化剂上可还原为CO,部分氧化物的沸点如表所示:| 氧化物 |  |  |  |
| 沸点/℃ | 100 | -10 | -78.5 |
②
 的VSEPR模型为
的VSEPR模型为③
 和
和 分子中,键角更大的是
分子中,键角更大的是(4)ZnS和ZnSe晶体的立方晶胞结构相似,均可看作将金刚石晶胞(如图2)内部的碳原子用Zn代替,晶胞顶角与面心位置的碳原子被S或Se代替。
①ZnS晶体中,Zn原子在S原子围成的正四面体空隙中的占用率为
②若阿伏加德罗常数的值为
 ,ZnS晶体的密度为
,ZnS晶体的密度为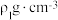 ,ZnSe晶体的密度为
,ZnSe晶体的密度为 ,则ZnS晶体中Zn与S原子最短距离和ZnSe晶体中Zn与Se原子最短距离之比为
,则ZnS晶体中Zn与S原子最短距离和ZnSe晶体中Zn与Se原子最短距离之比为
您最近一年使用:0次
2022-03-23更新
|
295次组卷
|
2卷引用:河北省张家口市2022届高三第一次模拟考试化学试题



